MSTER EN INGENIERA DE PROCESOS QUMICOS Y DESARROLLO







- Slides: 21

MÁSTER EN INGENIERÍA DE PROCESOS QUÍMICOS Y DESARROLLO SOSTENIBLE CURSO: VECTOR HIDRÓGENO Y CELDAS DE COMBUSTIBLE Departamento de Ingeniería Química CELDAS DE COMBUSTIBLE: TIPOS, OPERACIÓN E I+D J. Ignacio Lombraña 1

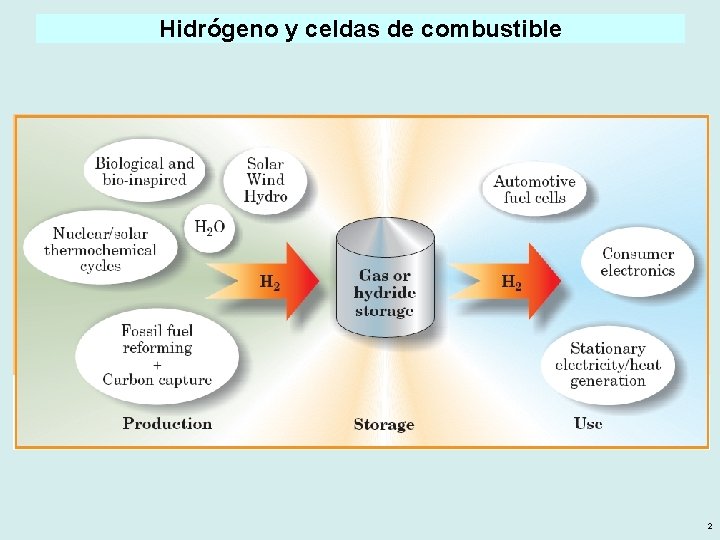
Hidrógeno y celdas de combustible 2

Definiciones Una celda de combustible opera como una batería. Genera electricidad combinando hidrógeno y oxígeno electroquímicamente sin ninguna combustión. A diferencia de las baterías, una celda de combustible no se agota ni requiere recarga. Producirá energía en forma de electricidad y calor mientras se le provea de combustible. El único subproducto que se genera es agua 100% pura. Consiste en dos electrodos separados por un electrolito. Oxígeno pasa sobre un electrodo e hidrógeno sobre el otro. Cuando el hidrógeno es ionizado pierde un electrón y al ocurrir esto ambos (hidrógeno y electrón) toman diferentes caminos hacia el segundo electrodo. El hidrógeno migra hacia el otro electrodo a través del electrolito mientras que el electrón lo hace a través de un material conductor. Este proceso producirá agua, corriente eléctrica y calor útil. Para generar cantidades utilizables de corriente las celdas de combustibles son "amontonadas" en un emparedado de varias capas. Las celdas de combustible son una familia de tecnologías que usan diferentes electrólitos y que operan a diferentes temperaturas. Cada miembro de esa familia tiende a ser más apropiada para ciertas aplicaciones. Por ejemplo, las celdas de combustible de membrana eléctrica polimérica han demostrado ser apropiadas para su aplicación en autos, mientras que las celdas de combustible de carbonatos fundidos parecen ser más apropiadas para uso con turbinas a gas. 3

Historia de las Celdas de Combustible 1838. Descubierto por el científico Christian Friedrich Schönbein en Suiza (Philosophical Magazine 1839). 1843. Desarrollada por Sir William Grove un científico Galés. Materiales similares a los usados hoy en PAFC’s. 1959. No fue hasta cuando el ingeniero británico Francis Thomas Bacon desarrolló con éxito una celda de 5 k. W. 1959. un equipo encabezado por Harry Ihrig construyó un tractor basado en una celda de combustible de 15 k. W para Allis-Chalmers (EE. UU. ). Celda alcalina (KOH). 1959. Bacon y sus colegas mostraron una unidad de 5 k. W. Patentes en los años 60 motores de aviación Pratt y Whitney. Progrma espacial de EE. UU Apolo-Soyuz, de Skylab. 60’s. UTX subsidiara de UTC Power fue la primera compañía en fabricar y comercializar un sistema de gran escala inmóvil. Central eléctrica de cogeneración en hospitales, universidades UTC Power expuso la primera celda de combustible capaz de comenzar a funcionar a bajas temperaturas con su celda automotora de combustible de membrana de intercambiadora de protones (PEM). Nota: La energía del UTC también utiliza el nombre de las celdas de combustible del UTC al referir a productos de la celda de combustible. 80’s y principios de los en que las celdas de combustible se convirtieron en una opción verdadera de uso más amplio. 90’s Varias innovaciones, catalizador con menos platino y electrodos de película fina, bajaron el costo de las celdas de combustible, haciendo que el desarrollo de sistemas PEMFC (como por ejemplo automóviles) fuese más viable. 4

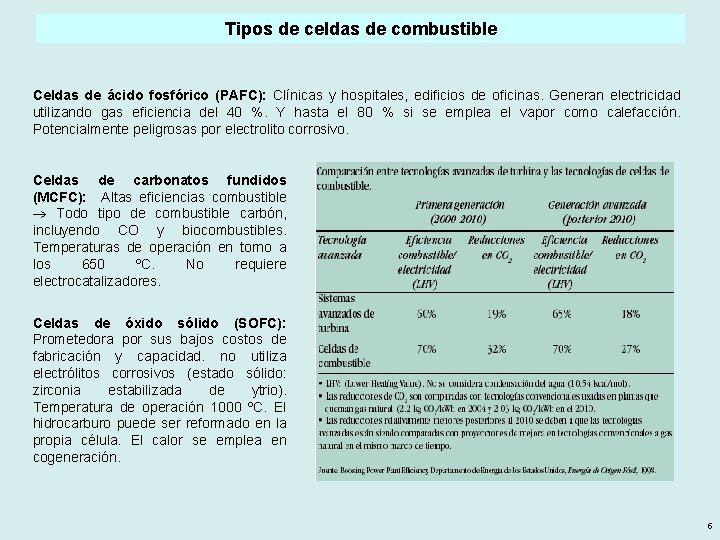
Tipos de celdas de combustible Celdas de ácido fosfórico (PAFC): Clínicas y hospitales, edificios de oficinas. Generan electricidad utilizando gas eficiencia del 40 %. Y hasta el 80 % si se emplea el vapor como calefacción. Potencialmente peligrosas por electrolito corrosivo. Celdas de carbonatos fundidos (MCFC): Altas eficiencias combustible Todo tipo de combustible carbón, incluyendo CO y biocombustibles. Temperaturas de operación en torno a los 650 ºC. No requiere electrocatalizadores. Celdas de óxido sólido (SOFC): Prometedora por sus bajos costos de fabricación y capacidad. no utiliza electrólitos corrosivos (estado sólido: zirconia estabilizada de ytrio). Temperatura de operación 1000 ºC. El hidrocarburo puede ser reformado en la propia célula. El calor se emplea en cogeneración. 5

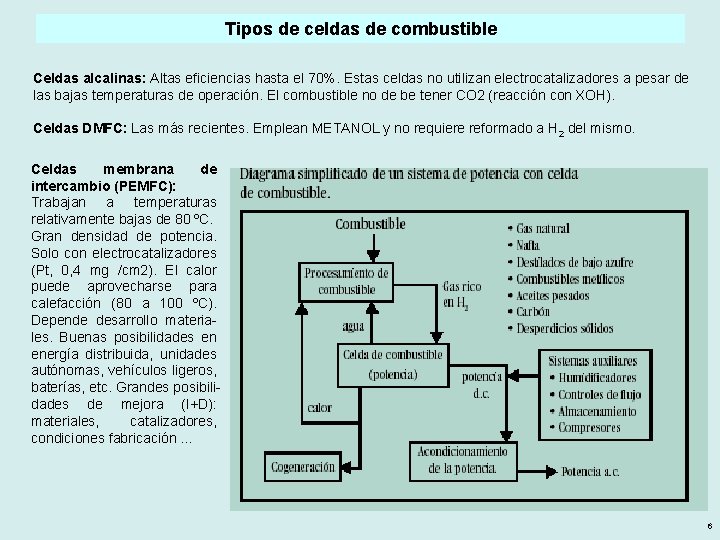
Tipos de celdas de combustible Celdas alcalinas: Altas eficiencias hasta el 70%. Estas celdas no utilizan electrocatalizadores a pesar de las bajas temperaturas de operación. El combustible no de be tener CO 2 (reacción con XOH). Celdas DMFC: Las más recientes. Emplean METANOL y no requiere reformado a H 2 del mismo. Celdas membrana de intercambio (PEMFC): Trabajan a temperaturas relativamente bajas de 80 ºC. Gran densidad de potencia. Solo con electrocatalizadores (Pt, 0, 4 mg /cm 2). El calor puede aprovecharse para calefacción (80 a 100 ºC). Depende desarrollo materiales. Buenas posibilidades en energía distribuida, unidades autónomas, vehículos ligeros, baterías, etc. Grandes posibilidades de mejora (I+D): materiales, catalizadores, condiciones fabricación … 6

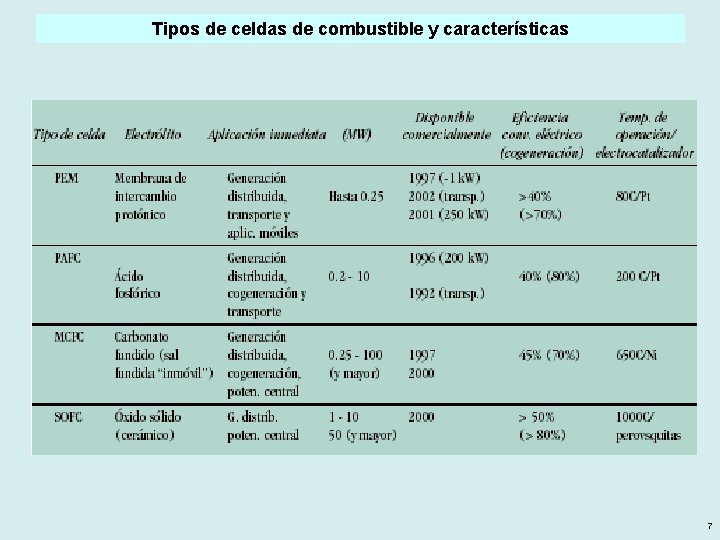
Tipos de celdas de combustible y características 7

Celdas de combustible PEMFC Temperatura de 80 ºC. Gran densidad de potencia. Electrocatalizadores (Pt, 0, 4 mg /cm 2). El calor puede aprovecharse para calefacción (80 a 100 ºC). Grandes posibilidades en energía distribuida: baterías. . . Gran importancia de I+D: Desarrollo materiales. Catalizadores. Condiciones fabricación. 8

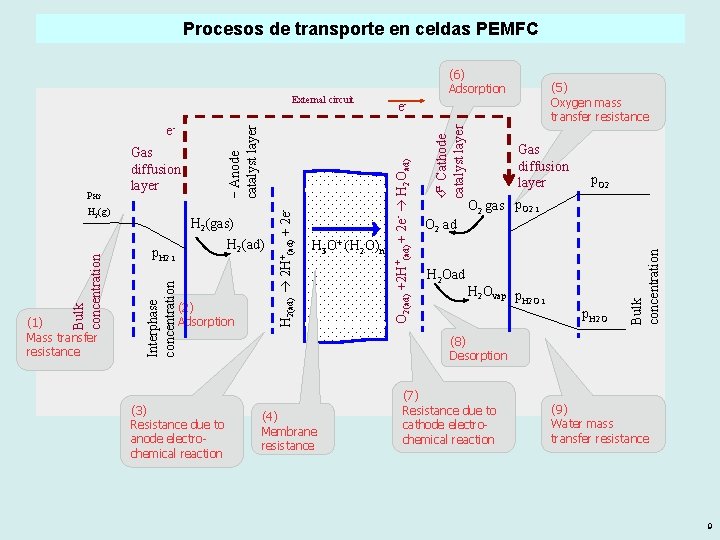
Procesos de transporte en celdas PEMFC H 2(ad) p. H 2 i (2) Adsorption (3) Resistance due to anode electrochemical reaction H 3 O+ (H 2 O)n Gas diffusion layer p. O 2 gas p. O 2 i O 2 ad H 2 Ovap p H 2 O i p. H 2 O Bulk concentration (1) Mass transfer resistance H 2(gas) Interphase concentration Bulk concentration H 2(g) Cathode catalyst layer Gas diffusion layer H 2(ad) 2 H+(ad) + 2 e- p. H 2 − Anode catalyst layer e- (5) Oxygen mass transfer resistance e- O 2(ad) +2 H+(ad) + 2 e- H 2 Oad) External circuit (6) Adsorption (8) Desorption (4) Membrane resistance (7) Resistance due to cathode electrochemical reaction (9) Water mass transfer resistance 9

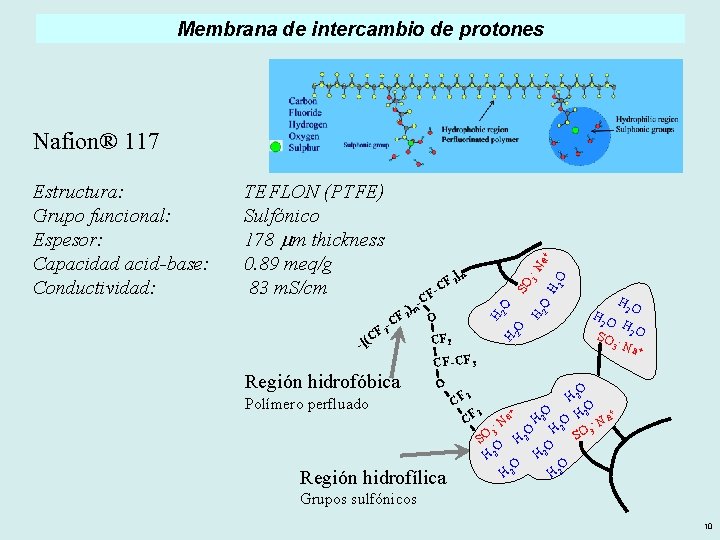
Membrana de intercambio de protones CF 2 2 O H 2 O 3 -N SO H - 2 2 O F-C )m 2 O CF 2 O CF ( [ - ] n 2 F C H TEFLON (PTFE) Sulfónico 178 mm thickness 0. 89 meq/g 83 m. S/cm H Estructura: Grupo funcional: Espesor: Capacidad acid-base: Conductividad: a+ Nafion® 117 HO O Polímero perfluado Región hidrofílica 2 2 SO 3 CF-CF 3 Región hidrofóbica HO - HO 2 Na + O 2 H 2 CF O + + O 2 2 F H 2 a H C O - Na - N 2 H 3 O 3 SO SO H 2 O O H 2 H 2 Grupos sulfónicos 10

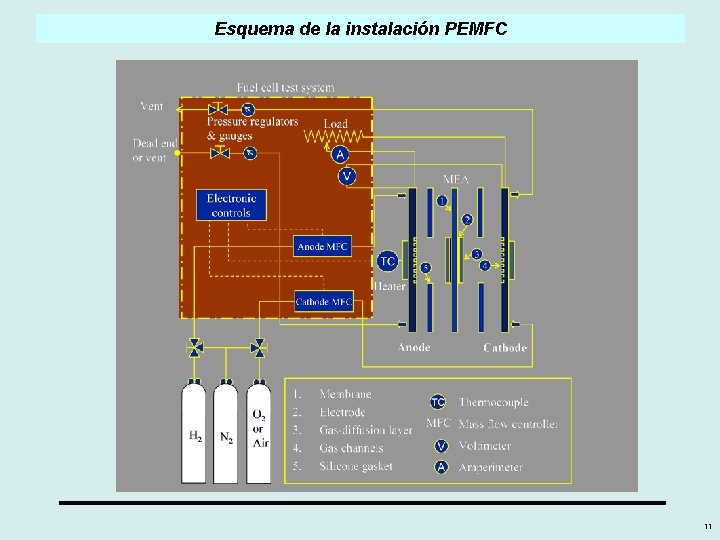
Esquema de la instalación PEMFC 11

I+D en PEMFC FABRICACIÓN DE MEMBRANA-ELECTRODO Materiales Adecuación de membranas Condiciones de fabricación MODELOS MATEMÁTICOS DE FLUJO TRANSMEMBRANA Variación de la concentración de agua TÉCNICAS DE ANÁLi. SIS DE FENÓMENOS DIFUSIONALES Curva de polarización Respuestas transitorias Espectroscopia de impedancia 12

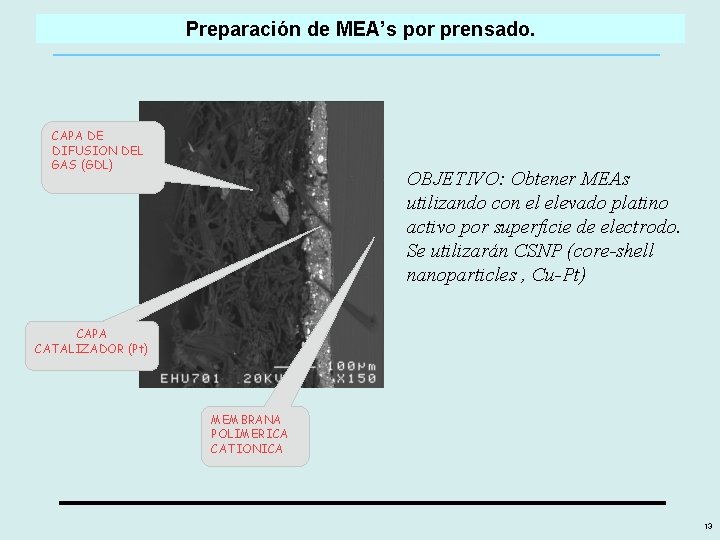
Preparación de MEA’s por prensado. CAPA DE DIFUSION DEL GAS (GDL) OBJETIVO: Obtener MEAs utilizando con el elevado platino activo por superficie de electrodo. Se utilizarán CSNP (core-shell nanoparticles , Cu-Pt) CAPA CATALIZADOR (Pt) MEMBRANA POLIMERICA CATIONICA 13

Preparación de MEAS por prensado Pressure & time a) GDE Hot PEM GDE H 2 O O 2 Membrane Temperature, T Gas phase c) b) Ionomer Phase Pt catalyst H+ Electrode penetration, x Electrode Porosity, e Carbon black, high area support GDL Pressure, P 14

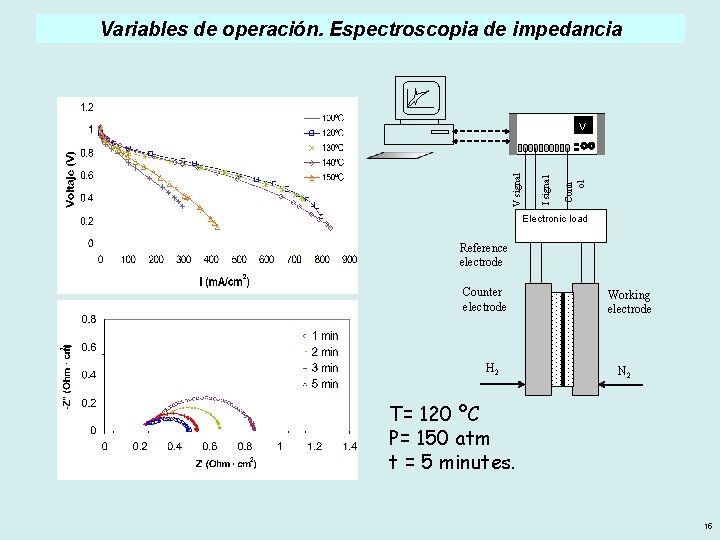
Variables de operación. Espectroscopia de impedancia Contr ol I signal V Electronic load Reference electrode Counter electrode H 2 Working electrode N 2 T= 120 ºC P= 150 atm t = 5 minutes. 15

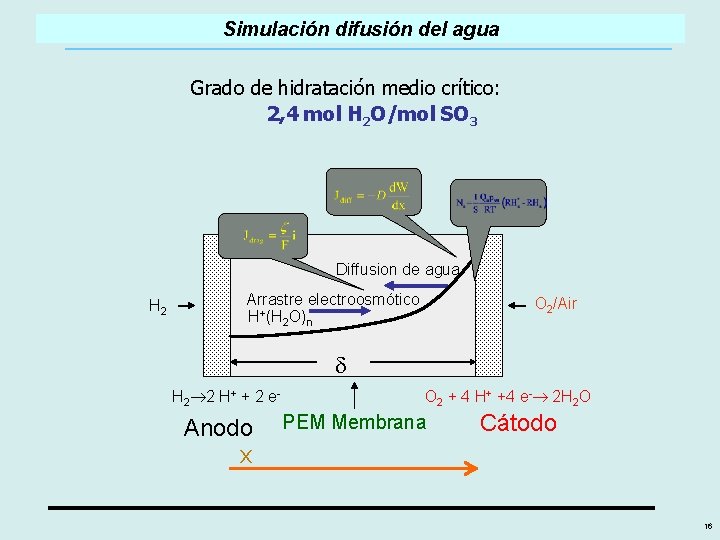
Simulación difusión del agua Grado de hidratación medio crítico: 2, 4 mol H 2 O/mol SO 3 Diffusion de agua H 2 Arrastre electroosmótico H+(H 2 O)n O 2/Air d H 2 2 H+ + 2 e- Anodo x O 2 + 4 H+ +4 e- 2 H 2 O PEM Membrana Cátodo 16

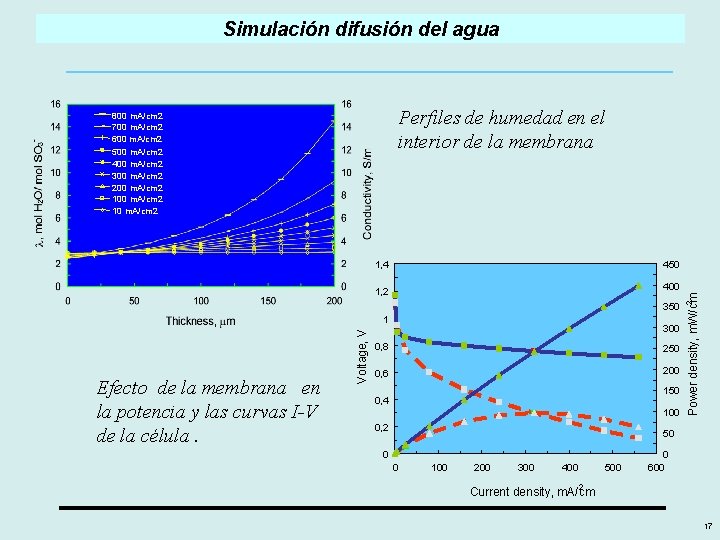
Simulación difusión del agua Perfiles de humedad en el interior de la membrana 800 m. A/cm 2 700 m. A/cm 2 600 m. A/cm 2 500 m. A/cm 2 400 m. A/cm 2 300 m. A/cm 2 200 m. A/cm 2 10 m. A/cm 2 1, 4 450 350 Efecto de la membrana en la potencia y las curvas I-V de la célula. Voltage, V 1 300 0, 8 250 0, 6 200 150 0, 4 100 0, 2 2 Power density, m. W/cm 400 1, 2 50 0 0 100 200 300 400 500 0 600 2 Current density, m. A/cm 17

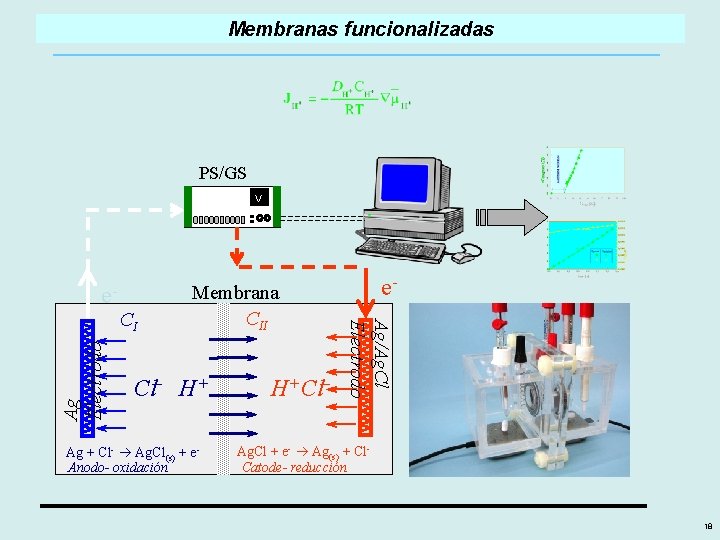
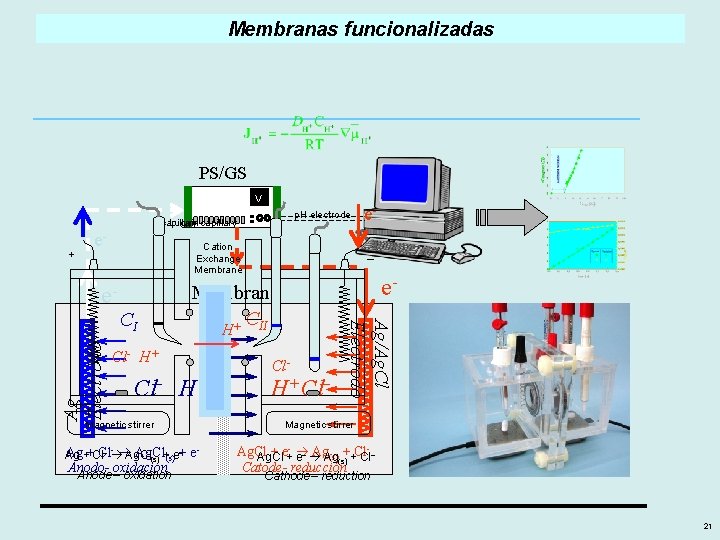
Membranas funcionalizadas PS/GS V _ Cl H+ Ag + Cl- Ag. Cl(s) + e. Anodo- oxidación _ H+ Cl Ag/Ag. Cl Electrodo CI Ag Electrodo e- Membrana CII e- Ag. Cl + e- Ag(s) + Cl. Catode- reducción 18

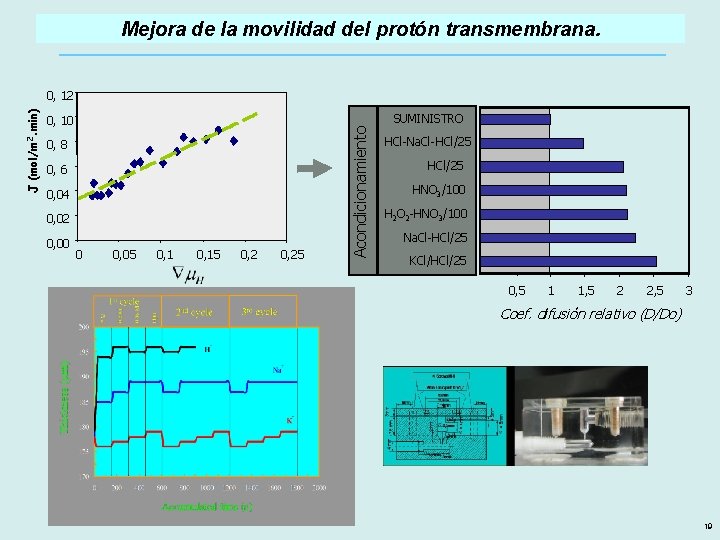
Mejora de la movilidad del protón transmembrana. SUMINISTRO 0, 10 0, 8 0, 6 0, 04 0, 02 0, 00 0 0, 05 0, 15 0, 25 Acondicionamiento J (mol/m 2. min) 0, 12 HCl-Na. Cl-HCl/25 HNO 3/100 H 2 O 2 -HNO 3/100 Na. Cl-HCl/25 KCl/HCl/25 0, 5 1 1, 5 2 2, 5 3 Coef. difusión relativo (D/Do) 19

20

Membranas funcionalizadas PS/GS V p. H electrode Luggin capillary + e- Cation Exchange Membrane e- H Cl- H+ _ Cl H+ Magnetic stirrer – Ag. Cl Ag++Cl. Cl Ag Ag. Cl(s) +(s)e–+ e - Anodooxidación Anode – oxidation Cl_ H+ Cl Ag/Ag. Cl Electrodo CI Ag Electrodo – Membrana + CII e- e- Magnetic stirrer - Ag. Cl + e+- Ag. Ag (s)(s)++Cl Ag. Cl e– Cl– Catode- reducción Cathode – reduction 21
 Dimensiones del desarrollo infantil
Dimensiones del desarrollo infantil Mster
Mster Mster
Mster Mster
Mster Abismo gmao
Abismo gmao Mster
Mster Universidad nacional de ingeniera
Universidad nacional de ingeniera 1.ingenieramédicaprogramadoraperiodistahijastra
1.ingenieramédicaprogramadoraperiodistahijastra Universidad alonso de ojeda
Universidad alonso de ojeda Factores del suelo
Factores del suelo Control procesos
Control procesos Introduccion procesos cognitivos
Introduccion procesos cognitivos Control de procesos sistemas operativos
Control de procesos sistemas operativos Nitrilo hidratasa
Nitrilo hidratasa Morfema derivativo y flexivo
Morfema derivativo y flexivo Mapa de procesos construccion
Mapa de procesos construccion Diagrama de procesos sistemas operativos
Diagrama de procesos sistemas operativos Abastecimiento
Abastecimiento Procesos complejos
Procesos complejos Fase oscura
Fase oscura Procesos productivos
Procesos productivos Procesos prioritarios en salud
Procesos prioritarios en salud