Mechanika Kwantowa I Stara teoria kwantw WYKAD 2

















- Slides: 22

Mechanika Kwantowa I. „Stara teoria kwantów” WYKŁAD 2 Elektron i atom – kwantowe próby opisu

Plan wykładu • • • serie widmowe atomów, model atomu Bohra, doświadczenie Francka-Hertza, hipoteza de Broglie’a, doświadczenie Davissona-Germera, dualizm korpuskularno-falowy,

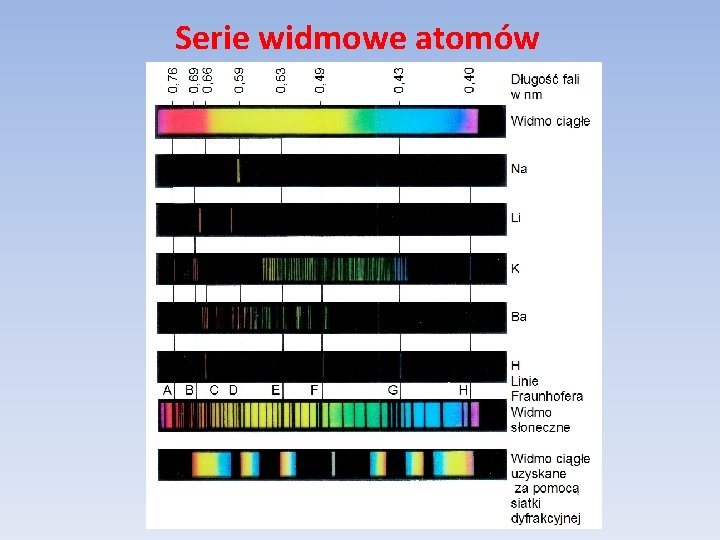
Serie widmowe atomów Do roku 1913 w fizyce do opisu atomu stosowano model Rutherforda. Model ten miał jednak dość poważne braki: 1. Nie potrafił wyjaśnić struktury promieniowania atomów : 2. Nie potrafił wyjaśnić stabilności atomów – elektron po czasie rzędu 10 -11 s powinien „spaść” na jądro na skutek wypromieniowania energii.

Serie widmowe atomów

Serie widmowe atomów

Serie widmowe atomów Znane do roku 1913 fakty doświadczalne dotyczące serii widmowych atomu wodoru: 1. W 1885 r. Balmer podał wzór empiryczny 2. W 1890 r. Rydberg przeprowadził serię eksperymentów poświęconych widmom atomowym. Korzystał on z pojęcia liczb falowych

Serie widmowe atomów 3. Dla atomów pierwiastków alkalicznych: gdzie R to stała Rydberga dla danego pierwiastka, zaś a i b są stałymi dla poszczególnych serii. 4. W 1908 r. Ritz sformułował zasadę kombinacji (tzw. zasada kombinacji Rydberga-Ritza): Liczby falowe dowolnych linii spektralnych mogą być wyrażone jako różnice odpowiednich termów, które z kolei przez kombinację z innymi termami służyć mogą do obliczania liczb

Model atomu Bohra Niels Bohr (1886 -1962) Nagroda Nobla – 1922 r.

Model atomu Bohra W 1913 r. Niels Bohr opublikował słynne postulaty dotyczące budowy atomu: 1. Elektrony w atomie poruszają się po orbitach o promieniu r takich, aby ich moment pędu był całkowitą wielokrotnością stałej Plancka (podzielonej przez 2 ) 2. Elektrony poruszając się po orbitach nie wypromieniowują energii (stany stacjonarne).

Model atomu Bohra 3. Elektrony mogą dokonywać przejść (nieciągłych) z jednej (dozwolonej) orbity na drugą wypromieniowując różnicę energii w postaci fotonu o częstości 4. Atom może absorbować energię, dzięki czemu jego elektrony „przechodzą” na wyższą (energetycznie) orbitę.

Model atomu Bohra Wyniki teorii Bohra (atom wodoropodobny): - promień n-tej orbity atomu: - energia dla n-tej orbity: - liczba falowa: stała Rydberga

Serie widmowe atomów

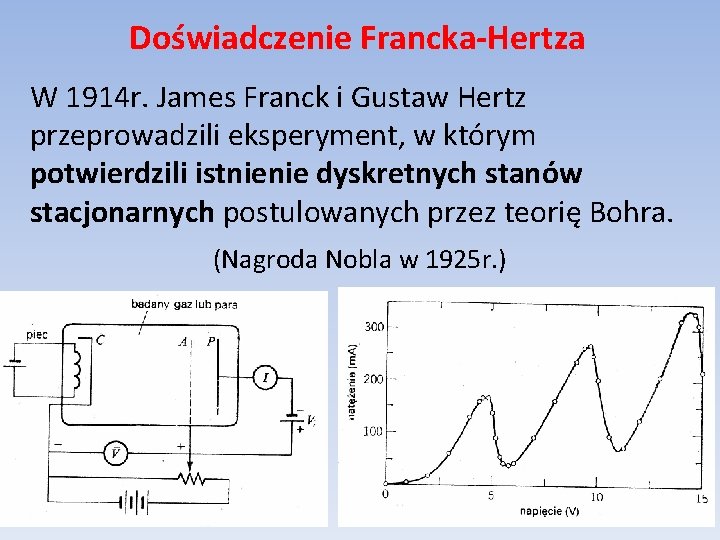
Doświadczenie Francka-Hertza W 1914 r. James Franck i Gustaw Hertz przeprowadzili eksperyment, w którym potwierdzili istnienie dyskretnych stanów stacjonarnych postulowanych przez teorię Bohra. (Nagroda Nobla w 1925 r. )

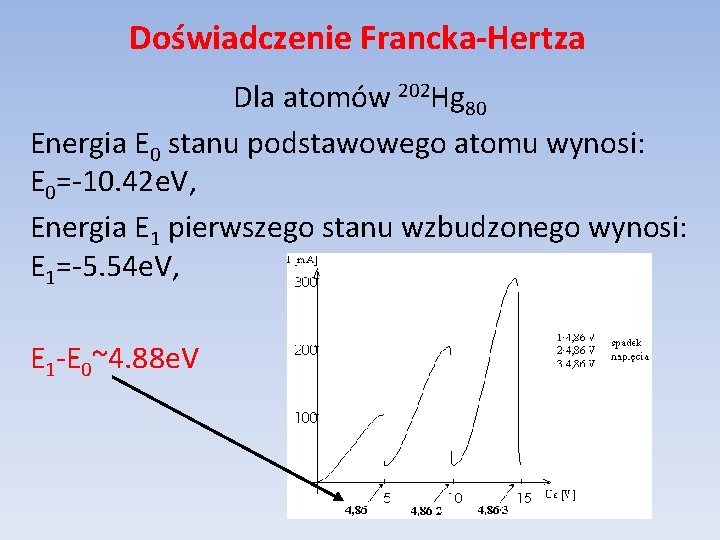
Doświadczenie Francka-Hertza Dla atomów 202 Hg 80 Energia E 0 stanu podstawowego atomu wynosi: E 0=-10. 42 e. V, Energia E 1 pierwszego stanu wzbudzonego wynosi: E 1=-5. 54 e. V, E 1 -E 0~4. 88 e. V

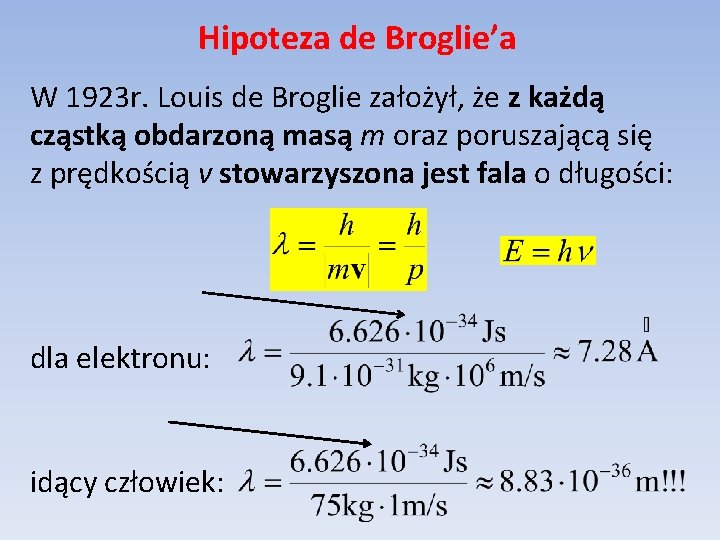
Hipoteza de Broglie’a W 1923 r. Louis de Broglie założył, że z każdą cząstką obdarzoną masą m oraz poruszającą się z prędkością v stowarzyszona jest fala o długości: dla elektronu: idący człowiek:

Doświadczenie Davissona-Germera W 1927 r. Clinton Davisson i Lester Germer przeprowadzili doświadczenie ukazujące dyfrakcję wiązki elektronowej na kryształach niklu (stałe sieciowe porównywalne z długością fali elektronów: stała sieci a=2. 15Å, energia elektronów E=160 e. V). Louis de Broglie Nagroda Nobla w 1929 r. Clinton Davisson Nagroda Nobla w 1937 r.

Doświadczenie Davissona-Germera Dyfrakcja elektronów na a) dwu-wymiarowym graficie, b) polikrystalicznym aluminium, c) polikrystalicznym graficie. a) b) c)

Doświadczenie Davissona-Germera W 1994 r. grupa japońskich naukowców z NEC (Nippon Electronics) wykonała eksperyment wykazujący interferencję wiązki atomów neonu na dwóch szczelinach (odpowiednik dośw. Younga). Atomy neonu Szerokość szczelin: 2 m, odległość obu szczelin: 6 m.

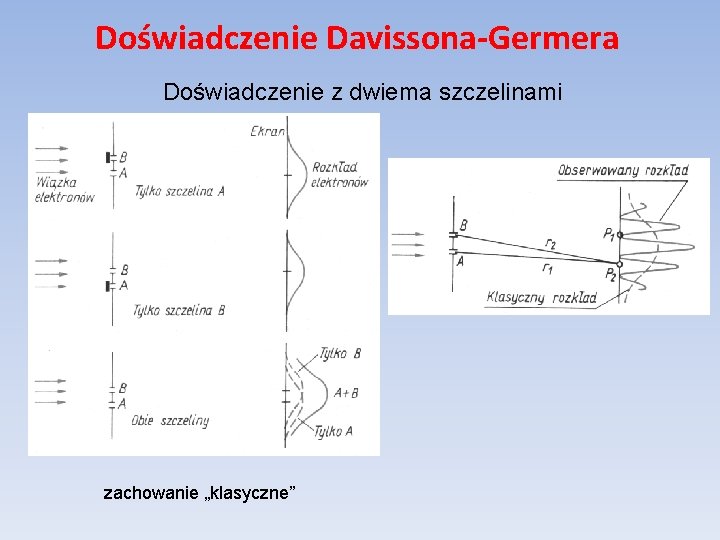
Doświadczenie Davissona-Germera Doświadczenie z dwiema szczelinami zachowanie „klasyczne”

Doświadczenie Davissona-Germera Zamiast wypuszczać wiązkę atomów, wypuszczajmy po jednym atomie w dużych odstępach czasu. Co zaobserwujemy: 1. Każdy atom zostawia jeden „ślad” na ekranie – nie dzieli się na części, 2. Po nałożeniu na siebie wszystkich „śladów” otrzymujemy rozkład losowy, 3. Przy odsłoniętej tylko jednej szczelinie mamy rozkład „klasyczny”,

Doświadczenie Davissona-Germera 4. Przy odsłoniętych obu szczelinach mamy obraz dyfrakcyjny (możliwość przejścia atomu dodatkową drogą do detektora uniemożliwia mu dotarcie do niektórych położeń na ekranie!!!), 5. Próba zaobserwowania, przez którą szczelinę „przeszedł” atom niszczy obraz dyfrakcyjny!!!

TRUDNE PYTANIA 1. CZYM JEST FALA DE BROGLIE’A? ? ? 2. Światło jest falą czy zbiorem cząstek? 3. Cząstki (np. proton, elektron) są obiektami zlokalizowanymi, czy są rozmyte w całej przestrzeni (tak jak fala)?
 Epr warszawa
Epr warszawa Menisk wklęsły i wypukły
Menisk wklęsły i wypukły Równanie schrodingera
Równanie schrodingera Wargawa stara
Wargawa stara Stara wartownia borne sulinowo
Stara wartownia borne sulinowo Sztuka helleńska
Sztuka helleńska Smš sb
Smš sb Herb niemiec
Herb niemiec Pesnik grafenauer
Pesnik grafenauer Stara pijaczka rzeźba
Stara pijaczka rzeźba Zgradba biblije
Zgradba biblije Le vkup uboga gmajna pomen
Le vkup uboga gmajna pomen Biblija stara zaveza
Biblija stara zaveza Stara ruska zastava
Stara ruska zastava Stará kovadlina
Stará kovadlina Vzroki za kmečke upore
Vzroki za kmečke upore Lime stara zagora
Lime stara zagora Moment síly
Moment síly Mechanika plynů
Mechanika plynů Rovnice kontinuity vzorec
Rovnice kontinuity vzorec Mechanika zemin
Mechanika zemin Gwo mechanika
Gwo mechanika Szabadságfok mechanika
Szabadságfok mechanika