Lo ione idrogeno H 36 43 n EqlL
![Lo ione idrogeno • • [H+] 36 -43 n. Eql/L 0. 00004 m. Eq/L Lo ione idrogeno • • [H+] 36 -43 n. Eql/L 0. 00004 m. Eq/L](https://slidetodoc.com/presentation_image_h2/4a9278320b63c156f5dec07c0205da01/image-1.jpg)








![Le variabili indipendenti di Stewart ([SID+], [ATOT] e PCO 2 con la costante di Le variabili indipendenti di Stewart ([SID+], [ATOT] e PCO 2 con la costante di](https://slidetodoc.com/presentation_image_h2/4a9278320b63c156f5dec07c0205da01/image-10.jpg)




![Approccio di Stewart all’Equilibrio Acido-Base p. H = p. K + log [SID+] - Approccio di Stewart all’Equilibrio Acido-Base p. H = p. K + log [SID+] -](https://slidetodoc.com/presentation_image_h2/4a9278320b63c156f5dec07c0205da01/image-15.jpg)





![Materiali e metodi BE con l’equazione di Siggaard-Andersen AG=([Na+]+[K+])-([Cl-]+[HCO 3 -]) AG =AG +2, Materiali e metodi BE con l’equazione di Siggaard-Andersen AG=([Na+]+[K+])-([Cl-]+[HCO 3 -]) AG =AG +2,](https://slidetodoc.com/presentation_image_h2/4a9278320b63c156f5dec07c0205da01/image-25.jpg)



![Fisiologia secondo Stewart p. H plasmatico UPSETTERS Tratto GI Dieta Circolazione tissutale REGULATORS [SID] Fisiologia secondo Stewart p. H plasmatico UPSETTERS Tratto GI Dieta Circolazione tissutale REGULATORS [SID]](https://slidetodoc.com/presentation_image_h2/4a9278320b63c156f5dec07c0205da01/image-30.jpg)


![[Atot] L’importanza dell’Albumina [Atot] L’importanza dell’Albumina](https://slidetodoc.com/presentation_image_h2/4a9278320b63c156f5dec07c0205da01/image-35.jpg)









![Materiali e metodi BE con l’equazione di Siggaard-Andersen AG=([Na+]+[K+])-([Cl-]+[HCO 3 -]) AG =AG +2, Materiali e metodi BE con l’equazione di Siggaard-Andersen AG=([Na+]+[K+])-([Cl-]+[HCO 3 -]) AG =AG +2,](https://slidetodoc.com/presentation_image_h2/4a9278320b63c156f5dec07c0205da01/image-46.jpg)












- Slides: 72
![Lo ione idrogeno H 36 43 n EqlL 0 00004 m EqL Lo ione idrogeno • • [H+] 36 -43 n. Eql/L 0. 00004 m. Eq/L](https://slidetodoc.com/presentation_image_h2/4a9278320b63c156f5dec07c0205da01/image-1.jpg)
Lo ione idrogeno • • [H+] 36 -43 n. Eql/L 0. 00004 m. Eq/L [Na+] 142 m. Eq/L E’ > di circa 3, 5 milioni di volte Gli ioni H+ sono dotati di un’attività biologica molto elevata piccolo raggio alta densità di carica grande campo elettrico

Lo ione idrogeno • Interagendo con i siti negativi di varie molecole, ne modificano la conformazione e l’eventuale attività biologica • legame ad idrogeno ubiquitario • reazioni biochimiche • legami di ormoni e farmaci con le proteine plasmatiche o con i recettori di membrana • performance cellulare alterando sia il legame intracellulare del calcio che la carica elettrica delle proteine

Peter Stewart Brown University, Rhode Island How to understand acid-base A quantitative acid-base primer for biology and medicine 1981 http: //www. acidbase. org/

Stewart • I first confronted the confusion surronding biological uses of term “ph” and “buffer” • What is that determines hidrogen ion concentration in a solution • H+ in body fluids cannot be understood

Approccio di Stewart all’Equilibrio Acido-Base Strong Ion Difference (SID) Na+ + K+ + Ca++ + Mg++ - Cl- - Lat- LE VARIABILI INDIPENDENTI Acidi. CHE deboli [Atot] (Albumina DETERMINANO IL p. H fosfati) AH A- + H+ p. CO 2 H 2 CO 3 HCO 3 - + H+ e

Le variabili indipendenti di Stewart • Il loro valore non viene alterato primariamente da nessun altro, sono piuttosto le modificazioni delle variabili indipendenti che influiscono sulla dissociazione dell’acqua e che, quindi, alterano la concentrazione di idrogenioni [H+]. • p. H e [HCO 3 -] sono variabili dipendenti, infatti, né l’uno e né l’altro possono variare primariamente e individualmente. • Le variabili dipendenti variano (tutte simultaneamente) se e solo se mutano una o più delle variabili indipendenti. • Pertanto l’interpretazione delle alterazioni dell’equilibrio acido-base basata su parametri dipendenti (H+, OH-, HCO 3 -, A-) osserva quello che è un effetto piuttosto che la causa dell’alterazione dell’equilibrio acido-base

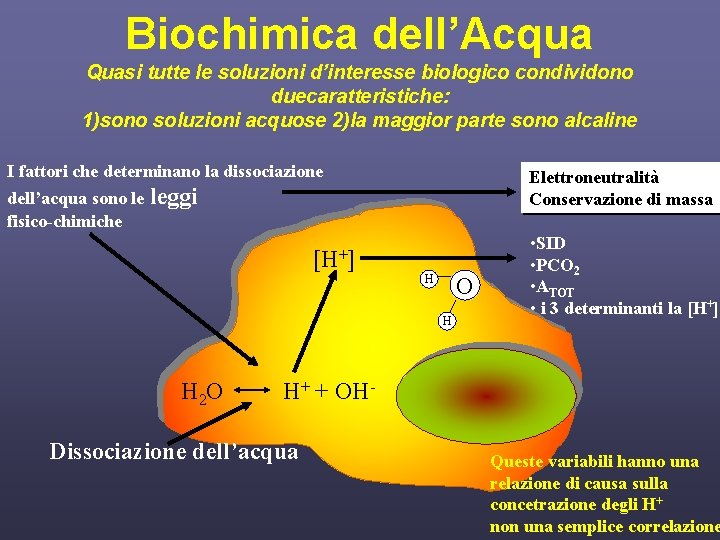
Fisica chimica dell’acqua • In accordo con la legge di azione di massa, la costante di equilibrio della ionizzazione dell’acqua per una data temperatura è: Ke=[H+][OH-]/[H 2 O] che a 25°C vale circa 1, 8· 10 -16 mol/L. • solo due molecole su circa 1 miliardo sono presenti in forma dissociata. • L’acqua è la più importante componente inorganica degli esseri viventi, di cui costituisce mediamente oltre il 60% del peso corporeo. In pratica tutte le soluzioni del corpo umano contengono acqua e questa costituisce una fonte praticamente inesauribile di H+ • In queste soluzioni, la concentrazione d’idrogenioni [H+] è determinata dalla dissociazione dell’acqua in ioni H+ e OH-. In altre parole le alterazioni nella concentrazione di idrogeno derivano non da quanto H+ è addizionato o sottratto, ma sono conseguenza della dissociazione dell’acqua.

Leggi della chimica fisica • Elettroneutralità – in una soluzione la concentrazione totale delle cariche positive deve essere uguale alla concentrazione totale della cariche negative • Conservazione di massa – in una reazione chimica la massa delle sostanze rimane invariata; la materia può trasformarsi ma, non può essere, né creata, né distrutta. • equilibrio di dissociazione di tutte le sostanze debolmente ionizzate • cambiamenti di temperatura- l’acqua diventa alcalina con il diminuire della temperatura (0°C, p. H=7, 5) e acida con l’aumentare della temperatura (100°C, p. H=6, 1). • Dobbiamo inoltre considerare che quasi tutte le soluzioni di interesse biologico condividono due importanti caratteristiche: la prima è che praticamente tutte sono soluzioni acquose, la seconda è che la maggior parte sono alcaline

Legge della elettroneutralità nel plasma K+ Na+ Mg++, Ca++ H+ Lactate PO 4 Cl. Alb- Cl 2 SO 4 --, OH-, others La legge della elettroneutalità afferma: In una soluzione acquosa la somma di tutte le cariche positive (cationi) deve equivalere alla somma di tutte le cariche negative (anioni). Nota che tutti i cationi nel plasma sono ioni forti tranne H+: solo questo può variare in risposta alle variazioni degli anioni. Invece molti degli anioni mostrati sono ioni deboli e qindi la loro carica puo cambiare.
![Le variabili indipendenti di Stewart SID ATOT e PCO 2 con la costante di Le variabili indipendenti di Stewart ([SID+], [ATOT] e PCO 2 con la costante di](https://slidetodoc.com/presentation_image_h2/4a9278320b63c156f5dec07c0205da01/image-10.jpg)
Le variabili indipendenti di Stewart ([SID+], [ATOT] e PCO 2 con la costante di dissociazione dell’acqua (K'w), determinano le variabili dipendenti [H+] e [HCO 3 -] [SID+] PCO 2 HCO 3 - H+ OH- K'w A- [ATOT]

Elettroneutralità nel plasma m. Eq/L 150 100 50 Cations Anions K+, Ca 2+, Mg 2+ Na+ HCO 3 Alb- APi- SIDe SIDa XA- lactate SIG = SIDa -SIDe Cl- XA- =anioni non misurati

SID ACIDI DEBOLI CO 2 + - Elettroneutralità 00 ? Strong Ion Gap (SIG) SIG > 0 Acidosi Metabolica

SID • Il valore normale è di 40 -42 m. Eq/L nell’individuo sano. Può mutare in due situazioni: primo, se varia la concentrazione di uno ione forte; secondo, tramite eccesso o deficit d’acqua nel plasma che determina un equivalente diluizione o concentrazione di cationi e anioni forti (acidosi diluizionale, alcalosi concentrazionale).

Approccio di Stewart all’Equilibrio Acido-Base
![Approccio di Stewart allEquilibrio AcidoBase p H p K log SID Approccio di Stewart all’Equilibrio Acido-Base p. H = p. K + log [SID+] -](https://slidetodoc.com/presentation_image_h2/4a9278320b63c156f5dec07c0205da01/image-15.jpg)
Approccio di Stewart all’Equilibrio Acido-Base p. H = p. K + log [SID+] - Ka[ATOT]/ Ka + 10 -p. H S x PCO 2 Se SID = [HCO 3 -] e ATOT = 0 p. H = p. K + log [HCO 3 -] S x PCO 2

Biochimica dell’Acqua Quasi tutte le soluzioni d’interesse biologico condividono duecaratteristiche: 1)sono soluzioni acquose 2)la maggior parte sono alcaline I fattori che determinano la dissociazione dell’acqua sono le fisico-chimiche Elettroneutralità Conservazione di massa leggi [H+] O H H H 2 O • SID • PCO 2 • ATOT • i 3 determinanti la [H+] H+ + OH- Dissociazione dell’acqua Queste variabili hanno una relazione di causa sulla concetrazione degli H+ non una semplice correlazione

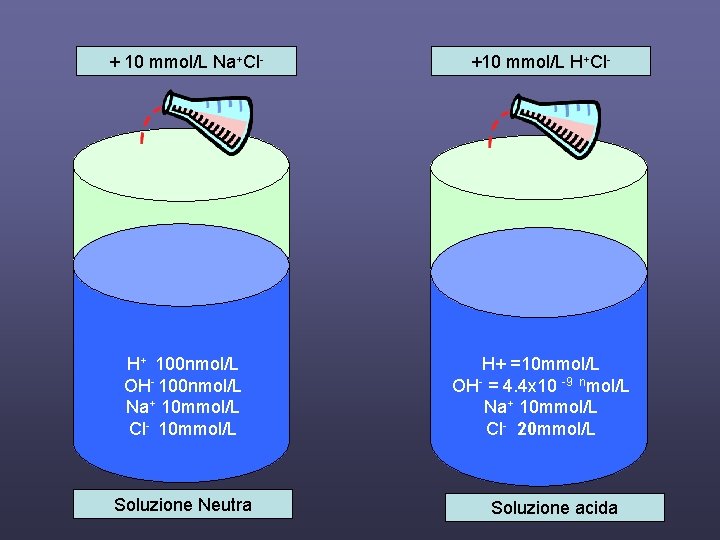
+ 10 mmol/L Na+Cl- +10 mmol/L H+Cl- H+ 100 nmol/L OH- 100 nmol/L Na+ 10 mmol/L Cl- 10 mmol/L H+ =10 mmol/L OH- = 4. 4 x 10 -9 nmol/L Na+ 10 mmol/L Cl- 20 mmol/L Soluzione Neutra Soluzione acida

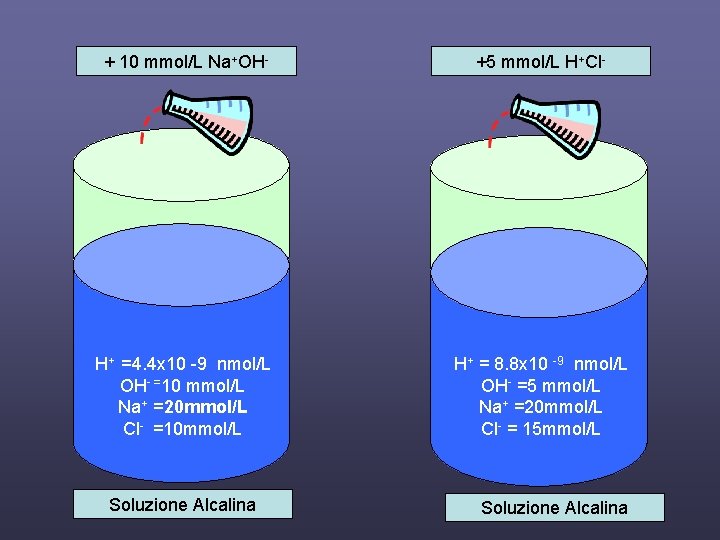
+ 10 mmol/L Na+OH- +5 mmol/L H+Cl- H+ =4. 4 x 10 -9 nmol/L OH- =10 mmol/L Na+ =20 mmol/L Cl- =10 mmol/L H+ = 8. 8 x 10 -9 nmol/L OH- =5 mmol/L Na+ =20 mmol/L Cl- = 15 mmol/L Soluzione Alcalina

Paziente Critico • • Disturbi complessi dell’equilibrio acidobase La patologia di base I trattamenti terapeutici La ventilazione meccanica

Applicazioni Cliniche • Una classificazione delle alterazioni dei disturbi dell’equilibrio acido base, basata sull’ approccio di Stewart, è rappresentata nella Figura

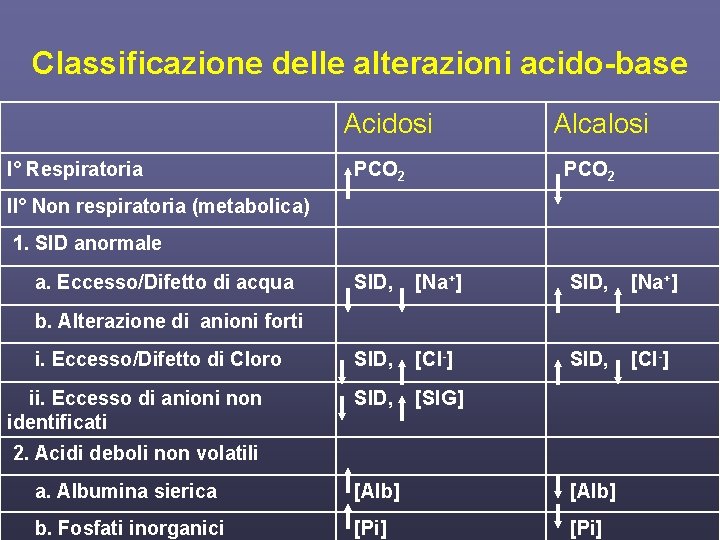
Classificazione delle alterazioni acido-base Acidosi I° Respiratoria PCO 2 Alcalosi PCO 2 II° Non respiratoria (metabolica) 1. SID anormale a. Eccesso/Difetto di acqua SID, [Na+] SID, [Cl-] SID, [SIG] b. Alterazione di anioni forti i. Eccesso/Difetto di Cloro ii. Eccesso di anioni non identificati 2. Acidi deboli non volatili a. Albumina sierica [Alb] b. Fosfati inorganici [Pi]

Caso Clinico Parametri Caso 1 “acidosi metabolica parzialmente p. H 7. 30 compensata. Pa. CO con (mm. Hg) AG normale” 30 2 HCO 3 - (mmol/L) 14. 72 Diagnosi differenziale: Na+ (mmol/L) 139. 8 RTA, TPN, perdita di succo K+ (mmol/L) 4 pancreatico, Clacidosi - (mmol/L)da resine a 115 scambio ionico, diarrea. Ca 2 -(mmol/L) 1. 0 Mg (mg/d. L) 2 Pi (mg/d. L) 3. 5 “acidosi metabolica Lattato(mmol/L) compensate, con 1 parzialmente compensata Albumina(g/d. L) alto” norma”. 4. 4 basso SIDe e SIG nella SBE (m. Eq/L) -10. 85 AG (m. Eq/L) 14. 6 Diagnosi differenziale: SIDa (m. Eq/L) 31. 46 ketoacidosi, SIDe acidosi lattica, (m. Eq/L) 28. 49 intossicazione da salicilati, metanolo, SIG (m. Eq/L) 2. 97 formati. Caso 2 7. 30 “acidosi metabolica parzialmente 30 con AG normale” compensata 14. 72 139. 8 4 “acidosi metabolica 115 parzialmente compensata con 1. 0 basso SIDe e SIG nella norma”. 2 3. 5 1 Diagnosi differenziale: 1. 5 RTA, TPN, perdita di succo -10. 85 pancreatico, 14. 6 acidosi da resine a scambio ionico, diarrea. 31. 46 20. 75 10. 71

Acidosi Metabolica Basso SID basso SIG RTA, TPN, perdita di succo pancreatico, acidosi da resine a scambio ionico, diarrea. Basso SID alto SIG ketoacidosi, acidosi lattica, intossicazione da salicilati, metanolo, formati.

Alcalosi Metabolica Ipoalbuminemia Alto SID Sindrome Nefrosica, cirrosi epatica Carico di Sodio, perdita di Cloro, vomito, drenaggio gastrico, diuretici, eccesso d mineralcorticoidi, Sindrome di Chushing, corticosteroidi esogeni
![Materiali e metodi BE con lequazione di SiggaardAndersen AGNaKClHCO 3 AG AG 2 Materiali e metodi BE con l’equazione di Siggaard-Andersen AG=([Na+]+[K+])-([Cl-]+[HCO 3 -]) AG =AG +2,](https://slidetodoc.com/presentation_image_h2/4a9278320b63c156f5dec07c0205da01/image-25.jpg)
Materiali e metodi BE con l’equazione di Siggaard-Andersen AG=([Na+]+[K+])-([Cl-]+[HCO 3 -]) AG =AG +2, 5(4. 3 -albumina ) SIDa=([Na+]+[K+]+[Mg 2+]+[Ca 2+])-([Cl-]+[Lattato-]) SIDe=([2, 46*10 x([PCO 2]/10 )]+[10 x[Alb]x(0, 123 xp. H-0, 469)]+[([Pi]x 10/30. 97)x(0. 309 x[p. H]-0. 469)]) CORRETTO CALCOCLATO -8 OSSERVATA -p. H SIDe= [HCO 3 -] + [Alb-] SIG= SIDa-SIDe. + [Pi- ]

Fisiologia secondo l’approccio di Stewart L’importanza del cloro • Na+ e Cl- sono gli elettroliti principali nel determinare le variazioni del SID. Un aumento della concentrazione di sodio rispetto a quella del cloro o una diminuzione della concentrazione del cloro rispetto a quella del sodio aumentano il SID e di conseguenza il p. H. Variazioni nel senso opposto diminuiscono il SID ed il p. H. • Dal momento che la concentrazione del sodio è strettamente regolata per mantenere la tonicità e la volemia, è il cloro che assume il ruolo principale nel controllo del SID e di conseguenza del p. H.

L’importanza del cloro • Na+ e Cl- sono gli elettroliti principali nel determinare le variazioni del SID. Un aumento della concentrazione di sodio rispetto a quella del cloro o una diminuzione della concentrazione del cloro rispetto a quella del sodio aumentano il SID e di conseguenza il p. H. Variazioni nel senso opposto diminuiscono il SID ed il p. H. • Dal momento che la concentrazione del sodio è strettamente regolata per mantenere la tonicità e la volemia, è il cloro che assume il ruolo principale nel controllo del SID e di conseguenza del p. H.

L’importanza del cloro • molti dei disturbi dell’equilibrio acido base sono causati da alterazioni nella omeostasi del cloro. Ad esempio l’alcalosi metabolica ipercloremica, causata dalla perdita di succhi gastrici, o l’acidosi da diluzione, determinata dall’infusione di soluzione fisiologica, non sono determinate dalla perdita o aggiunta di idrogenioni(o diluizione del bicarbonato), ma dalla variazione del SID determinata dalla perdita o aggiunta di Cloro

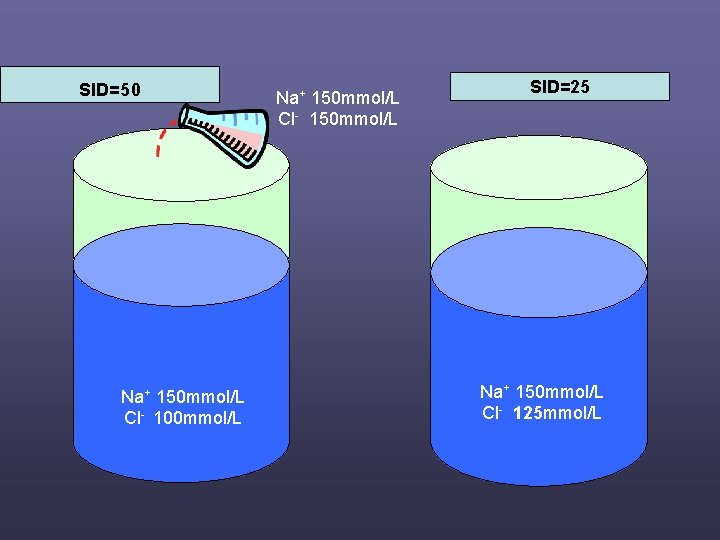
SID=50 Na+ 150 mmol/L Cl- 100 mmol/L Na+ 150 mmol/L Cl- 150 mmol/L SID=25 Na++300 mmol/2 L 150 mmol/L Na Cl- - 250 mmol/2 L 125 mmol/L Cl
![Fisiologia secondo Stewart p H plasmatico UPSETTERS Tratto GI Dieta Circolazione tissutale REGULATORS SID Fisiologia secondo Stewart p. H plasmatico UPSETTERS Tratto GI Dieta Circolazione tissutale REGULATORS [SID]](https://slidetodoc.com/presentation_image_h2/4a9278320b63c156f5dec07c0205da01/image-30.jpg)
Fisiologia secondo Stewart p. H plasmatico UPSETTERS Tratto GI Dieta Circolazione tissutale REGULATORS [SID] PCO 2 [ATOT] Rene Polmone Fegato Plasma RBC………. . Fluido interstiziale Fluido intracellulare MODIFIERS

Rene • • E’ il più importante regolatore del SID. La concentrazione di ioni forti nel plasma può essere alterata regolandone la secrezione o il riassorbimento dall’ultrafiltrato glomerulare. L’omeostasi del K+ è strettamente controllata per assicurare la funzione cardiaca e neuromuscolare, la concentrazione del Na+ per il controllo del volume intravascolare, quindi la regolazione dell’equilibrio acido base da parte del rene è generalmente mediata dalla escrezione del cloro Ogni ione cloro filtrato e quindi non riassorbito nel plasma causa un aumento del SID. La teoria classica focalizza il ruolo del rene nel mantenimento dell’Equilibrio acido base tramite escrezione di idrogenioni ed enfatizza l’importanza della ammoniaca e dello ione ammonio ad essa correlato, come un meccanismo atto ad aumentare l’escrezione di H+. L’escrezione di H+ è di per se irrilevante perché l’acqua corporea è una fonte virtualmente inesauribile di idrogenioni liberi. La funzione del catione debole ammonio, quando rivalutata secondo l’approccio fisico-chimico, è quella di accompagnarsi con l’escrezione dell’anione forte Cl-, senza la perdita di nessun catione forte come Na+ o K+. Lo ione ammonio arriva al rene preformato dal fegato, l’escrezione del quale da parte del rene ha come risultato l’aggiunta netta di HCO 3 - al liquido extracellulare. Questo schema differisce notevolmente da quello classico che (erroneamente) prevedeva la rimozione di un H+ derivato dall’ H 2 CO 3 e unito all’ammoniaca (NH 3+H+ NH 4+).

Fegato • • • Il nuovo approccio comporta l’assunzione di un importante ruolo da parte del fegato nella regolazione dell’equilibrio acido-base. L’ammoniogenesi epatica, come anche la formazione di glutamina, è importante per l’omeostasi acido-base ed è strettamente controllata da meccanismi sensibili al p. H In particolare la sintesi epatica della glutamina è stimolata dall’acidosi L’azoto a livello epatico è utilizzato per la produzione di urea, glutamina e NH 4+. La produzione epatica di urea o di glutamina determina effetti diversi a livello renale. La glutamina è utilizzata dal rene per la ammoniogenesi, quindi facilita l’escrezione di ioni cloro. In questo senso la produzione di glutamina ha un effetto alcalinizzante sul plasma. Gli epatociti che sono meglio predisposti alla produzione di urea sono quelli più vicini alle venule portali e possono utilizzare più facilmente l’ammonio. L’acidosi inibisce la produzione dell’urea e quindi più ammonio è a disposizione degli epatociti più lontani dalle venule portali che sono, invece, predisposti alla sintesi di glutamina. In questo modo l’ammonio è utilizzato per la sintesi di glutamina che, a sua volta, è utlizzata dal rene per facilitare l’escrezione di cloro e determinare un aumento del SID.

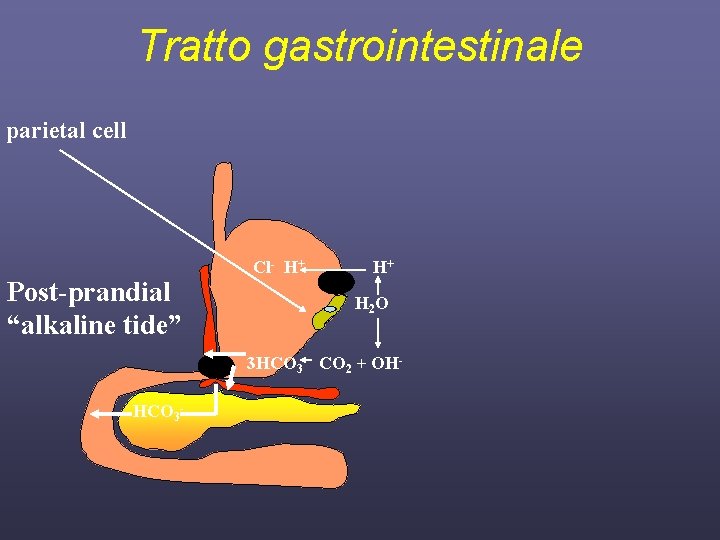
Tratto gastrointestinale parietal cell Post-prandial “alkaline tide” Cl- H+ H+ H 2 O 3 HCO 3 CO 2 + OHHCO 3 -

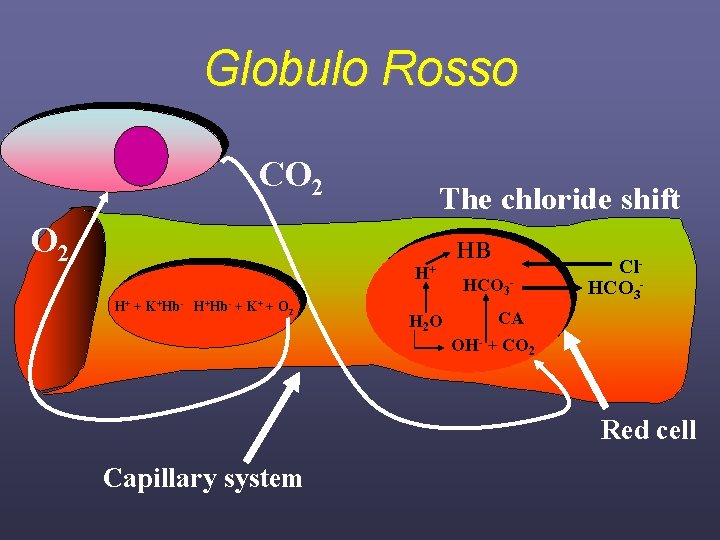
Globulo Rosso CO 2 The chloride shift H+ H+ + K+Hb- H+Hb- + K+ + O 2 H 2 O HB HCO 3 - Cl. HCO 3 - CA OH- + CO 2 Red cell Capillary system
![Atot Limportanza dellAlbumina [Atot] L’importanza dell’Albumina](https://slidetodoc.com/presentation_image_h2/4a9278320b63c156f5dec07c0205da01/image-35.jpg)
[Atot] L’importanza dell’Albumina

Albumina • Nell’ambito di p. H compreso tra valori di 6. 8 e 7. 8, l’albumina ha una carica negativa netta di 21 m. Eq/L, quindi la sua diminuzione ha un effetto alcalinizzante. • Nel plasma con una bassa concentrazione sierica di albumina il SIG può essere elevato (indicando la presenza di anioni non misurati), anche se i valori di AG e SBE possono essere normali.

Albumina • • • Le variazioni dalla norma dello SBE sono considerate equivalenti a quelle del SID Tuttavia questo avviene solo se la concentrazione plasmatica dei tamponi diversi dal bicarbonato (albumina e fosfati) è nella norma. In queste situazioni il SIG può essere un miglior indicatore della presenza di anioni non misurati rispetto al AG e allo SBE Schlichtig R. [Base excess] vs [Strong ion difference]: which is more helpfull? Adv Exp Med Biol 1997; 411: 91 -95

• Gli approcci tradizionali all’equilibrio acido-base quali la valutazione dello SBE e dell’AG non consentono di apprezzare la presenza di acidosi metabolica, quando questa è mascherata dalla ipoalbuminemia Salem MM, Mujas SK: Gaps in the anion gap. Arch. Intern. Med. 1992; 152: 1625 -2 Wilkes P: Hypoproteinemia, strong-ion difference, and acid-base status in critically ill patients. J. Appl. Physil 1998; 84: 1740 -48

Sia il deficit di basi (BE) che il gap anionico (AG) sottostimano frequentemente la presenza di acidosi metabolica sopratutto nel malato critico Fencl V, Jabor A, Kazda A, Figge J: Diagnosis of metabolic acid-base disturbance in critically ill patients. Am J. Respir Crit Care Med. 2000; 162: 2246 -51

Benché ci sia stato un energico dibattito riguardo l’accuratezza e l’utilità di ogni approccio, tutti danno un risultato praticamente identico quando vengono impiegati per quantificare lo stato acidobase di un campione di sangue. I tre approcci si distinguono invece nella comprensione del meccanismo su cui si fondano le variazioni di p. H Kellum JA: Determinants of blood p. H in health and disease. Critical Care 2000; 4: 6 -14

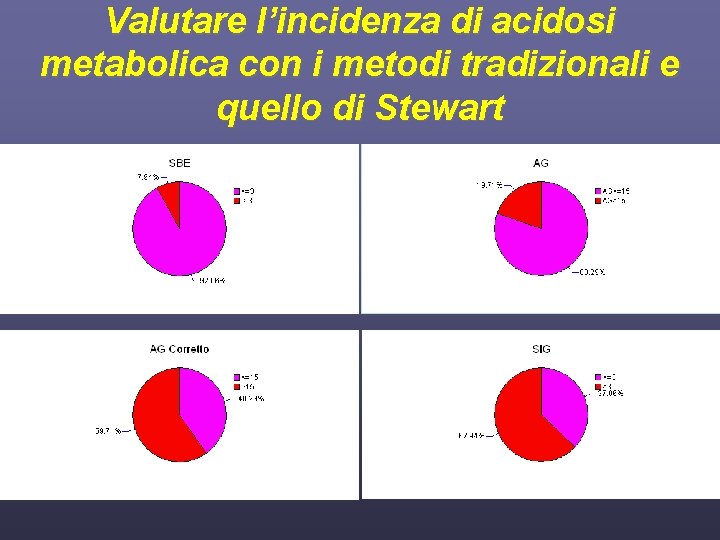
Valutare l’incidenza di acidosi metabolica con i metodi tradizionali e quello di Stewart

Anioni non misurati • Gli anioni non misurati possono essere rappresentati da composti organici o inorganici come lattato, salicilato, penicillina, metanolo e glicole etilenico e altri non ancora conosciuti (presenti ad esempio nella sepsi).

The Stewart’s approach to acid-base chemistry • Compared with the Henderson Hasselbalch approach, the Stewart approach has a number of appealing features • 1 the control of acid base and water homeostasis can be explained in terms of both sodium and chloride regulation • 2 acid base status is partly controlled by a number of plasma electrolytes, notably sodium and chloride. These electrolytes can be manipulated in the clinical setting to optimize acid base status • 3 the factors controlling acid base status are independent. Pa. CO 2 , SID (strong ion difference), ATOT (total weak acid concentration) • Criticism of the Henderson Hasselbalch approach include a lack of interdependence between carbon dioxide and bicarbonate • 4 the Henderson Hasselbalch approach does not allow assessment of non volatile buffers, whereas the Stewart

STUDIO CLINICO Studio prospettico, non randomizzato, osservazionale con lo scopo di confrontare gli approcci diagnostici all’equilibrio acido base attualmente disponibili nei pazienti Critici

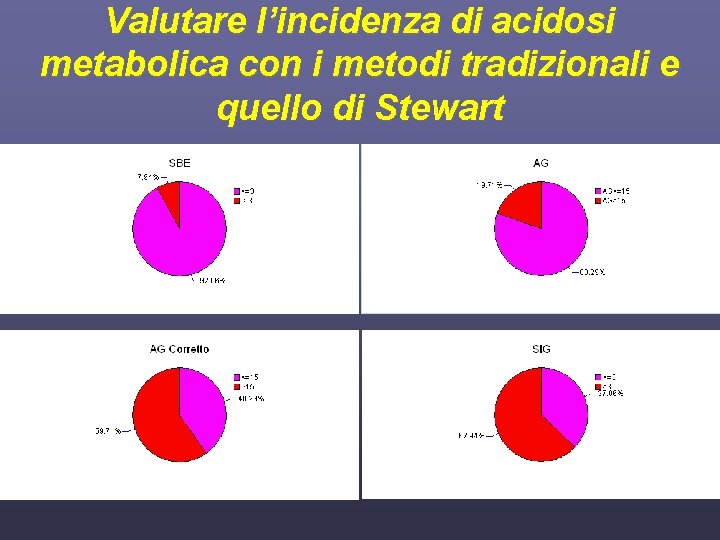
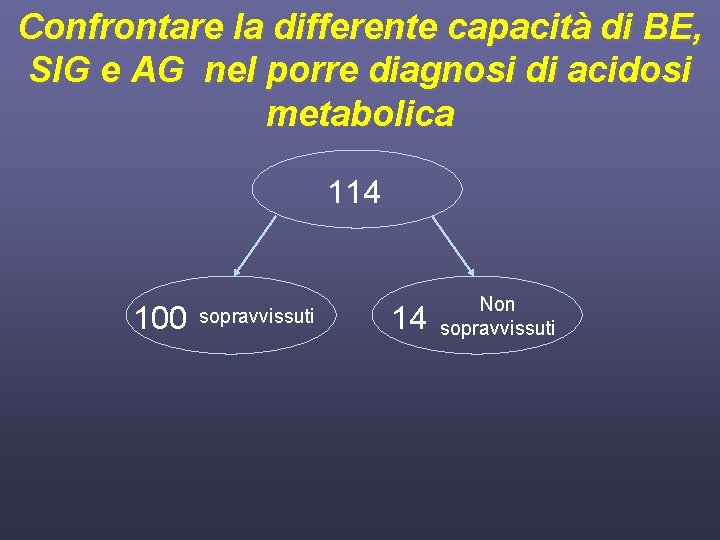
Obiettivi dello studio • Valutare l’incidenza di acidosi metabolica con i metodi tradizionali e quello di Stewart • Confrontare la differente capacità di BE, SIG e AG nel porre diagnosi di acidosi metabolica • Valutare le variazioni dell’equilibrio acido base e dell’equilibrio idroelettrolitico nel tempo • Valutare una possibile correlazione tra i parametri classici e alternativi con la mortalità dei pazienti osservati
![Materiali e metodi BE con lequazione di SiggaardAndersen AGNaKClHCO 3 AG AG 2 Materiali e metodi BE con l’equazione di Siggaard-Andersen AG=([Na+]+[K+])-([Cl-]+[HCO 3 -]) AG =AG +2,](https://slidetodoc.com/presentation_image_h2/4a9278320b63c156f5dec07c0205da01/image-46.jpg)
Materiali e metodi BE con l’equazione di Siggaard-Andersen AG=([Na+]+[K+])-([Cl-]+[HCO 3 -]) AG =AG +2, 5(4. 3 -albumina ) SIDa=([Na+]+[K+]+[Mg 2+]+[Ca 2+])-([Cl-]+[Lattato-]) SIDe=([2, 46*10 x([PCO 2]/10 )]+[10 x[Alb]x(0, 123 xp. H-0, 469)]+[([Pi]x 10/30. 97)x(0. 309 x[p. H]-0. 469)]) CORRETTO CALCOCLATO -8 OSSERVATA -p. H SIDe= [HCO 3 -] + [Alb-] SIG= SIDa-SIDe. + [Pi- ]

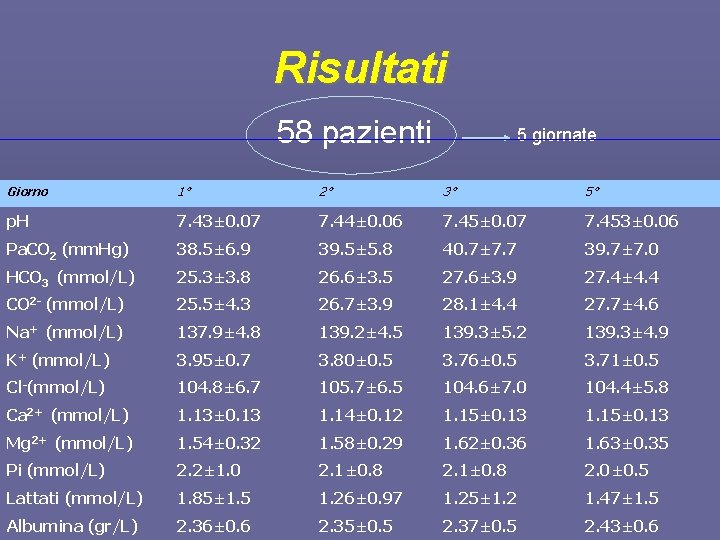
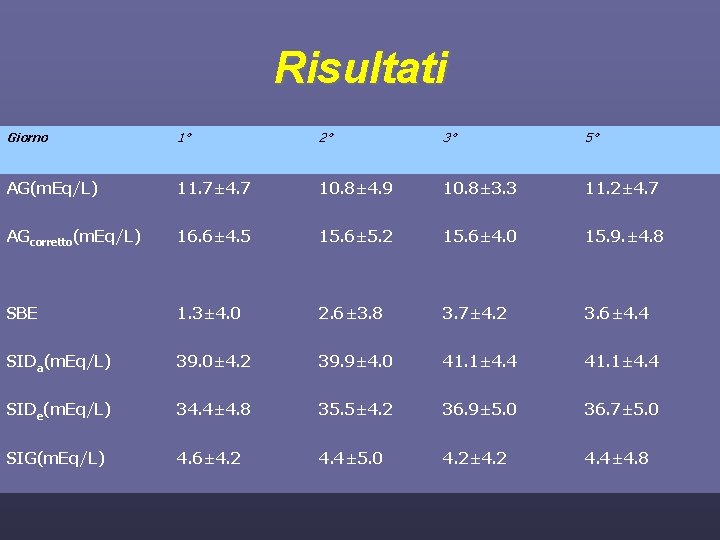
Materiali e metodi 340 osservazioni 114 pazienti 5 gior nate 58 pazienti prelievi giornalieri tra le ore 6 e le ore 8 un tempo massimo di 5 giorni 1°, 2°, 3°, 5° variabili incluse caratteristiche demografiche, SAPS II, SOFA, Pa. O 2/Fi. O 2, elettroliti, albumina, p. H, PCO 2, t. Hb, lattato

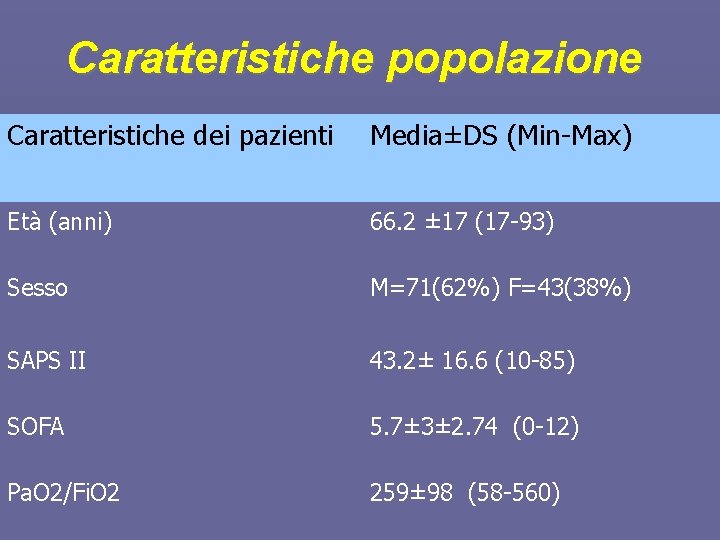
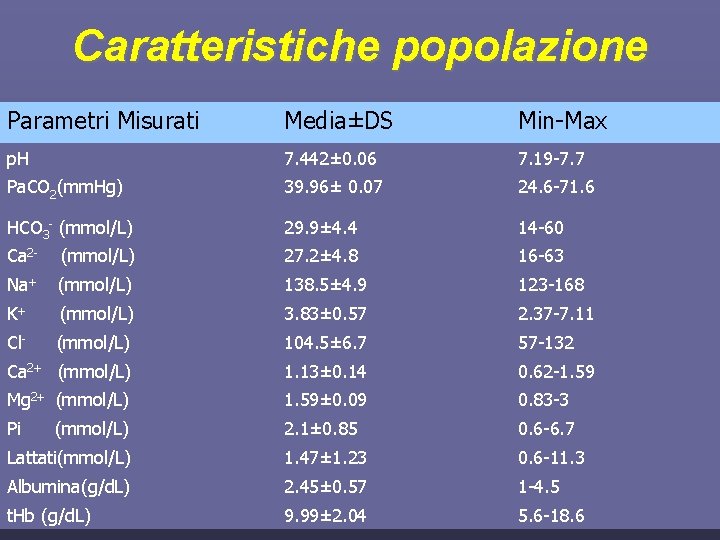
Caratteristiche popolazione Caratteristiche dei pazienti Media±DS (Min-Max) Età (anni) 66. 2 ± 17 (17 -93) Sesso M=71(62%) F=43(38%) SAPS II 43. 2± 16. 6 (10 -85) SOFA 5. 7± 3± 2. 74 (0 -12) Pa. O 2/Fi. O 2 259± 98 (58 -560)

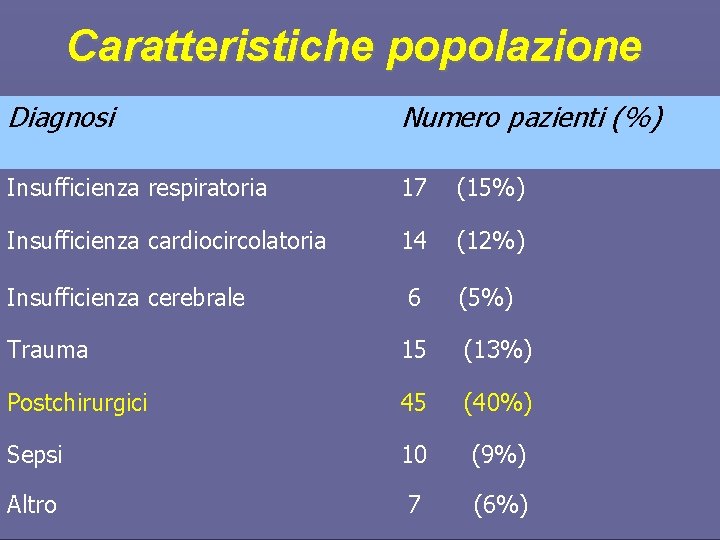
Caratteristiche popolazione Diagnosi Numero pazienti (%) Insufficienza respiratoria 17 (15%) Insufficienza cardiocircolatoria 14 (12%) 6 (5%) Insufficienza cerebrale Trauma 15 (13%) Postchirurgici 45 (40%) Sepsi 10 (9%) Altro 7 (6%)

Caratteristiche popolazione Parametri Misurati Media±DS Min-Max p. H 7. 442± 0. 06 7. 19 -7. 7 Pa. CO 2(mm. Hg) 39. 96± 0. 07 24. 6 -71. 6 HCO 3 - (mmol/L) 29. 9± 4. 4 14 -60 Ca 2 - (mmol/L) 27. 2± 4. 8 16 -63 Na+ (mmol/L) 138. 5± 4. 9 123 -168 K+ (mmol/L) 3. 83± 0. 57 2. 37 -7. 11 Cl- (mmol/L) 104. 5± 6. 7 57 -132 Ca 2+ (mmol/L) 1. 13± 0. 14 0. 62 -1. 59 Mg 2+ (mmol/L) 1. 59± 0. 09 0. 83 -3 Pi 2. 1± 0. 85 0. 6 -6. 7 Lattati(mmol/L) 1. 47± 1. 23 0. 6 -11. 3 Albumina(g/d. L) 2. 45± 0. 57 1 -4. 5 t. Hb (g/d. L) 9. 99± 2. 04 5. 6 -18. 6 (mmol/L)

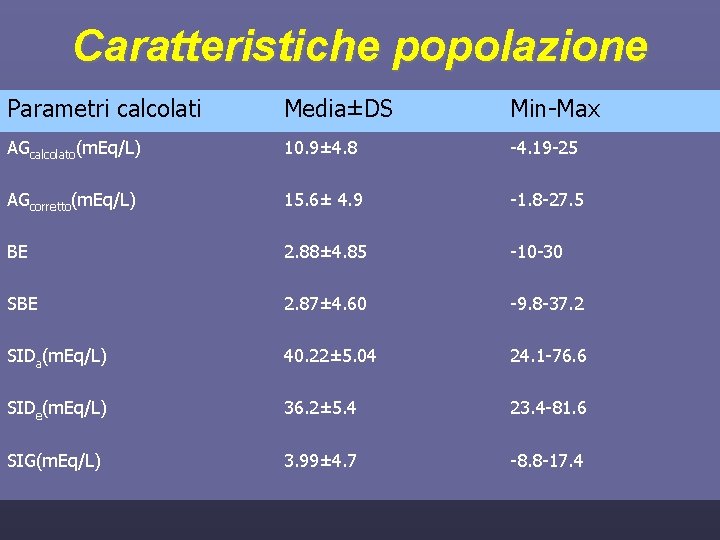
Caratteristiche popolazione Parametri calcolati Media±DS Min-Max AGcalcolato(m. Eq/L) 10. 9± 4. 8 -4. 19 -25 AGcorretto(m. Eq/L) 15. 6± 4. 9 -1. 8 -27. 5 BE 2. 88± 4. 85 -10 -30 SBE 2. 87± 4. 60 -9. 8 -37. 2 SIDa(m. Eq/L) 40. 22± 5. 04 24. 1 -76. 6 SIDe(m. Eq/L) 36. 2± 5. 4 23. 4 -81. 6 SIG(m. Eq/L) 3. 99± 4. 7 -8. 8 -17. 4

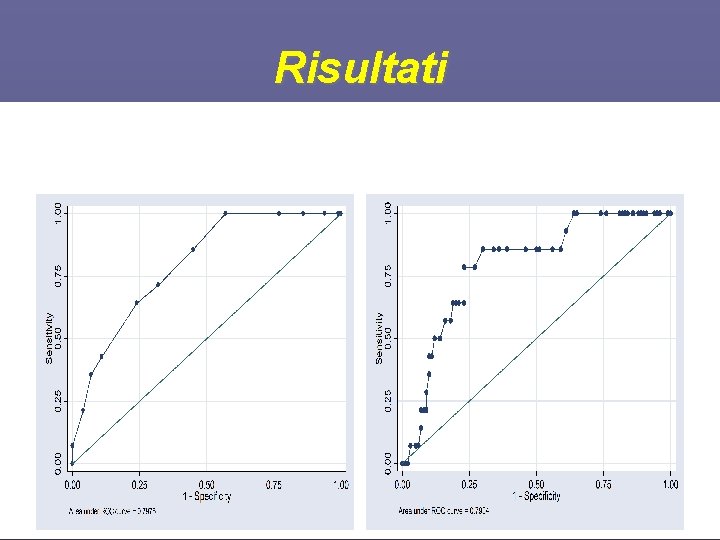
Risultati

Risultati • • 17 pazienti ipercloremia (Cl-≥ 110 m. Eq/L) 16 pazienti ipocloremia (Cl- ≤ 99 m. Eq/L) 4 pazienti ipernatriemia (Na≥ 148 m. Eq/L) 16 pazienti iponatriemia (Na≤ 135 m. Eq/L) 21 pazienti iperkaliemia (K≥ 4. 5) 17 pazienti ipokaliemia (K≤ 3. 5) 37 pazienti livelli di lattati elevati(Lattati≥ 2) 108 pazienti ipoalbuminemia(Alb≤ 3. 5)

Valutare l’incidenza di acidosi metabolica con i metodi tradizionali e quello di Stewart

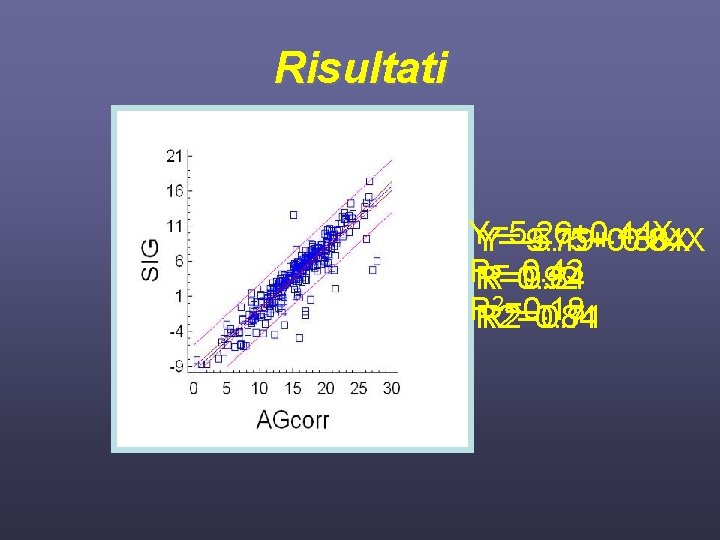
Risultati Y=5. 26+0. 44 X Y=-9. 75+0. 88 X Y=-5. 19+ 0. 84 X R=-0. 43 R=0. 92 R=0. 84 2=0. 18 R R 2=0. 84 R 2=0. 71

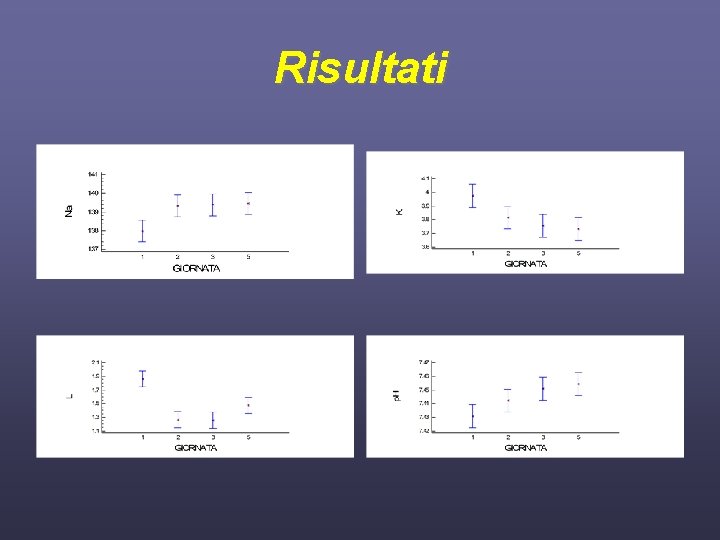
Risultati 58 pazienti 5 giornate Giorno 1° 2° 3° 5° p. H 7. 43± 0. 07 7. 44± 0. 06 7. 45± 0. 07 7. 453± 0. 06 Pa. CO 2 (mm. Hg) 38. 5± 6. 9 39. 5± 5. 8 40. 7± 7. 7 39. 7± 7. 0 HCO 3 (mmol/L) 25. 3± 3. 8 26. 6± 3. 5 27. 6± 3. 9 27. 4± 4. 4 CO 2 - (mmol/L) 25. 5± 4. 3 26. 7± 3. 9 28. 1± 4. 4 27. 7± 4. 6 Na+ (mmol/L) 137. 9± 4. 8 139. 2± 4. 5 139. 3± 5. 2 139. 3± 4. 9 K+ (mmol/L) 3. 95± 0. 7 3. 80± 0. 5 3. 76± 0. 5 3. 71± 0. 5 Cl-(mmol/L) 104. 8± 6. 7 105. 7± 6. 5 104. 6± 7. 0 104. 4± 5. 8 Ca 2+ (mmol/L) 1. 13± 0. 13 1. 14± 0. 12 1. 15± 0. 13 Mg 2+ (mmol/L) 1. 54± 0. 32 1. 58± 0. 29 1. 62± 0. 36 1. 63± 0. 35 Pi (mmol/L) 2. 2± 1. 0 2. 1± 0. 8 2. 0± 0. 5 Lattati (mmol/L) 1. 85± 1. 5 1. 26± 0. 97 1. 25± 1. 2 1. 47± 1. 5 Albumina (gr/L) 2. 36± 0. 6 2. 35± 0. 5 2. 37± 0. 5 2. 43± 0. 6

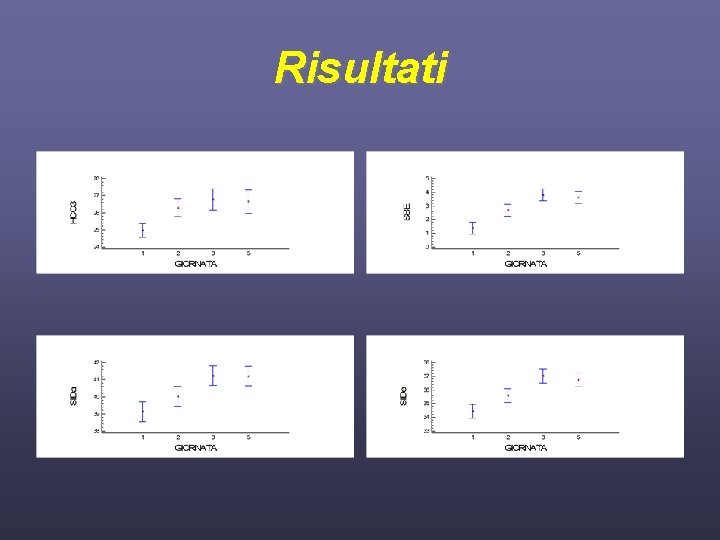
Risultati Giorno 1° 2° 3° 5° AG(m. Eq/L) 11. 7± 4. 7 10. 8± 4. 9 10. 8± 3. 3 11. 2± 4. 7 AGcorretto(m. Eq/L) 16. 6± 4. 5 15. 6± 5. 2 15. 6± 4. 0 15. 9. ± 4. 8 SBE 1. 3± 4. 0 2. 6± 3. 8 3. 7± 4. 2 3. 6± 4. 4 SIDa(m. Eq/L) 39. 0± 4. 2 39. 9± 4. 0 41. 1± 4. 4 SIDe(m. Eq/L) 34. 4± 4. 8 35. 5± 4. 2 36. 9± 5. 0 36. 7± 5. 0 SIG(m. Eq/L) 4. 6± 4. 2 4. 4± 5. 0 4. 2± 4. 2 4. 4± 4. 8

Risultati • • Sodio (P<0. 036) Potassio (P<0. 019) Acido Lattico (P<0. 001) p. H (P<0. 028) Bicarbonato (P<0. 001) SBE (P<0. 001) SIDa(P<0. 001) SIDe(P<0. 001)

Risultati • • • PCO 2 Cloro Calcio Magnesio Fosfati inorganici Albumina AG AG corretto per albumina SIG P>0. 05

Confrontare la differente capacità di BE, SIG e AG nel porre diagnosi di acidosi metabolica 114 100 sopravvissuti 14 Non sopravvissuti

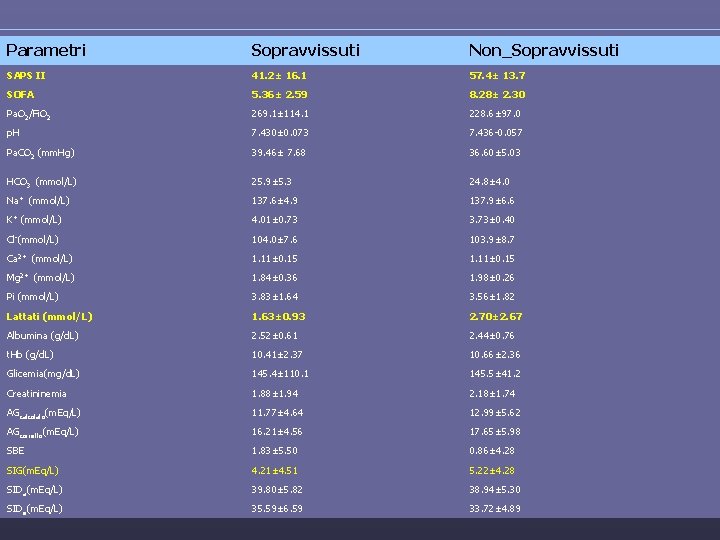
Parametri Sopravvissuti Non_Sopravvissuti SAPS II 41. 2± 16. 1 57. 4± 13. 7 SOFA 5. 36± 2. 59 8. 28± 2. 30 Pa. O 2/Fi. O 2 269. 1± 114. 1 228. 6± 97. 0 p. H 7. 430± 0. 073 7. 436 -0. 057 Pa. CO 2 (mm. Hg) 39. 46± 7. 68 36. 60± 5. 03 HCO 3 (mmol/L) 25. 9± 5. 3 24. 8± 4. 0 Na+ (mmol/L) 137. 6± 4. 9 137. 9± 6. 6 K+ (mmol/L) 4. 01± 0. 73 3. 73± 0. 40 Cl-(mmol/L) 104. 0± 7. 6 103. 9± 8. 7 Ca 2+ (mmol/L) 1. 11± 0. 15 Mg 2+ (mmol/L) 1. 84± 0. 36 1. 98± 0. 26 Pi (mmol/L) 3. 83± 1. 64 3. 56± 1. 82 Lattati (mmol/L) 1. 63± 0. 93 2. 70± 2. 67 Albumina (g/d. L) 2. 52± 0. 61 2. 44± 0. 76 t. Hb (g/d. L) 10. 41± 2. 37 10. 66± 2. 36 Glicemia(mg/d. L) 145. 4± 110. 1 145. 5± 41. 2 Creatininemia 1. 88± 1. 94 2. 18± 1. 74 AGcalcolato(m. Eq/L) 11. 77± 4. 64 12. 99± 5. 62 AGcorretto(m. Eq/L) 16. 21± 4. 56 17. 65± 5. 98 SBE 1. 83± 5. 50 0. 86± 4. 28 SIG(m. Eq/L) 4. 21± 4. 51 5. 22± 4. 28 SIDa(m. Eq/L) 39. 80± 5. 82 38. 94± 5. 30 SIDe(m. Eq/L) 35. 59± 6. 59 33. 72± 4. 89 Risultati

Risultati • Dal confronto tra i due gruppi emerge che ci sono differenze significative per quanto riguarda • SAPSII(p<0. 0005) • SOFA(p<0. 0001) • Gli altri parametri non mostrano una differenza significativa (p>0. 05) tra sopravvissuti e non sopravvissuti.

Risultati

Risultati Parametro R P SOFA 0. 42 <0. 0006 SAPSII 0. 36 <0. 0015

Discussione • Una caratteristica comune nel paziente critico è rappresentata dall’ipoalbuminemia, rilevata nel nostro studio in 108 pazienti su 114, ben il 95% dei casi. • Nel plasma con una bassa concentrazione sierica di albumina il SIG può essere elevato (indicando la presenza di anioni non misurati), anche se i valori di AG e SBE possono essere normali

Discussione • La correlazione molto forte ricavata tra AG corretto e SIG simile a quella rilevata da altri autori in casistiche più selezionate di pazienti, può indurre a usare l’AG corretto in sostituzione del SIG per la valutazioni delle acidosi metaboliche • Tuttavia nel singolo paziente la valutazione tramite l’approccio fisicochimico permette una migliore comprensione dei meccanismi che determinano l’acidosi, e quindi un più efficace trattamento terapeutico

Conclusioni • IL SIG e l’AGcorretto discriminano meglio dello SBE e dell’ AG l’acidosi metabolica • I parametri che rilevano la presenza di anioni non misurati come AG, AGcorretto , SBE E SIG non predicono la mortalità, che, invece, è ben evidenziata dagli indici di gravità tradizionalmente usati SAPSII e SOFA. • • i parametri esaminati nello studio sono quelli rilevati tra le 6 e le 8 del mattino e non all’ingresso del paziente il 40% dei pazienti esaminati erano post-chirurgici

Risultati

Risultati

Unmeasured identified by prognostic the Fencl-Stewart predict mortality The strong ionanions gap does not have value inmethod critically ill patients in a Diagnosis ofbase Metabolic Acid–Base Disturbances in Critically Ill Patients better. Saline than excess, anion gap, and lactate in. Acidosis patients the pediatric mixed medical/surgical adult ICU Rapid Infusion Produces Hyperchloremic inin. Patients intensive. FENCL, care unit VLADIMIR ANTONÍN Surgery JABOR, ANTONÍN KAZDA, and JAMES FIGGE Undergoing Gynecologic R. J. Cusack, A. Rhodes, P. Lochhead, B. Jordan, S. Perry, J. A. S. Ball, R. M. Grounds Am J E. Respir Crit Care Med Vol 162. pp. PL, 2246– 2251, 2000 and D. Bennett Stefan Scheingraber, M. D. ; Markus Rehm, M. D. ; Christiane Sehmisch; Udilo Finsterer, M. D. Balasubramanyan N. , Havens Hoffman GM ANESTHESIOLOGY Intensive Care Med 1999; 90: 1265 -1270 (2002) 28: 864 -869 Critical Care Medicine. 27(8): 1577 -81, 1999 Aug.

• Nelle unità di terapia intensiva, sono frequenti le alterazioni nell’omeostasi del cloro. Nel nostro studio presenti in 33 pazienti. Queste sono dovute in massima parte, all’infusione intravenosa di liquidi, all’ acidosi tubulare renale, alla terapia diuretica, alle perdite gastrointestinali, allo scambio ionico in corso di acidosi o alcalosi respiratoria, alla disidratazione. • . L’effetto delle variazioni della concentrazione del cloro sull’equilibrio acido-base è conosciuto da molti anni, inoltre, è stato dimostrato su modelli animali che l’infusione di soluzione fisiologica causa acidosi metabolica non “diluendo” il bicarbonato, ma a causa del suo apporto di ioni cloro. • Dal punto di vista fisicochimico questo è completamente previsto. Il bicarbonato è una variabile dipendente, quindi non può essere la causa dell’acidosi. Invece l’aumento del cloro diminuendo il SID (una variabile indipendente), determina un incremento nella dissociazione dell’acqua e, quindi, della concentrazione di idrogeno. In queste situazioni l’anion gap può essere normale e non evidenziare l’acidosi metabolica

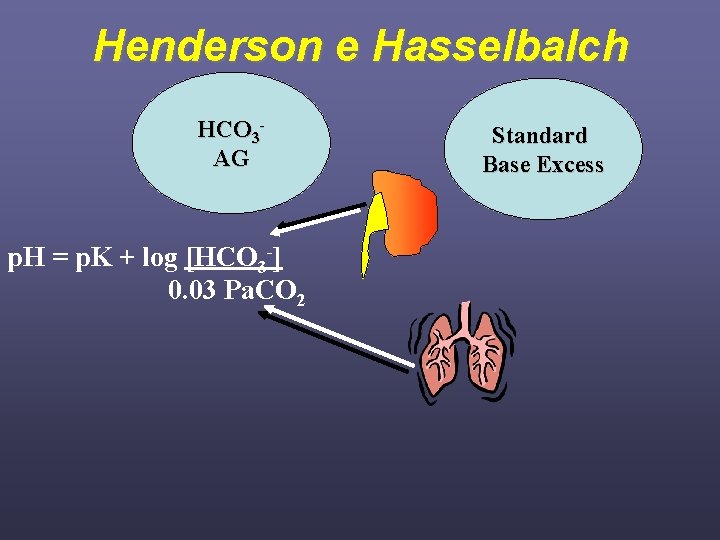
Henderson e Hasselbalch HCO 3 AG p. H = p. K + log [HCO 3 -] 0. 03 Pa. CO 2 Standard Base Excess
 Chimica piu capitolo 22 soluzioni
Chimica piu capitolo 22 soluzioni Legami idrogeno
Legami idrogeno 2-metilpropano
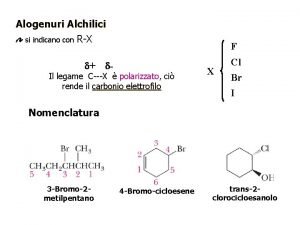
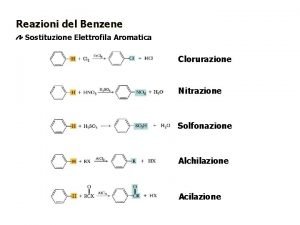
2-metilpropano Sostituzione elettrofila
Sostituzione elettrofila Indicatori di ph
Indicatori di ph Ione ammiduro
Ione ammiduro Sali poco solubili
Sali poco solubili Ione tropilio
Ione tropilio Ione esamminocobalto
Ione esamminocobalto Anidride ipoiodosa
Anidride ipoiodosa Effetto dello ione comune
Effetto dello ione comune Configurazione elettronica di ione k+
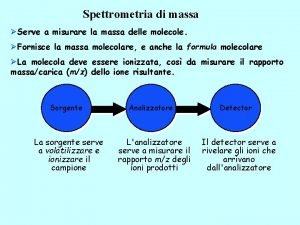
Configurazione elettronica di ione k+ Spettrometria di massa
Spettrometria di massa Ione formiato
Ione formiato Effetto dello ione comune
Effetto dello ione comune Ione idruro nad
Ione idruro nad H+ ione
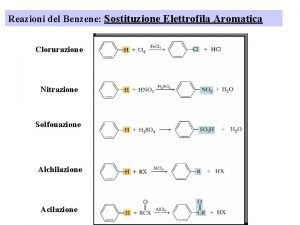
H+ ione Sostituzione elettrofila
Sostituzione elettrofila Ione bivalente esempio
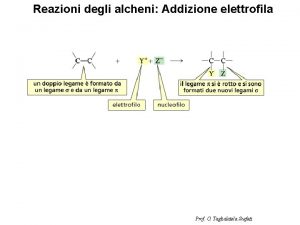
Ione bivalente esempio Effetto dello ione comune
Effetto dello ione comune