Nomenclatura Chimica Concetti a priori Valenza La valenza
































- Slides: 38

Nomenclatura Chimica

Concetti a priori: Valenza La valenza: il numero di elettroni che un atomo di un elemento acquista, cede o mette in comune quando si lega con atomi di altri elementi. Nei composti ionici il concetto di valenza coincide con quello di elettrovalenza Nei composti covalenti, la valenza o covalenza, è data dal numero di elettroni che può mettere in compartecipazione. La valenza è in stretto rapporto con la struttura elettronica Elettroni di valenza: gli elettroni del livello energetico più esterno Il concetto di valenza spiega bene i legami di tipo ionico ma non è esaustiva nel caso dei legami covalenti. 2

Concetti a priori: Numero di ossidazione Il numero di ossidazione consiste nella carica elettrica formale (apparente) che l’elemento assume in un composto se si pensa di associare gli elettroni di ciascun legame all’atomo considerato più elettronegativo. Il numero di ossidazione può quindi assumere valori sia positivi che negativi. Quando gli elettroni di legame vengono assegnati all’elemento più elettronegativo, esso si carica di tante cariche negative quanti sono gli elettroni acquistati. Grandezza CONVENZIONALE che prescinde dalla conoscenza dei tipi di legami NON SEMPRE IL NUMERO DI OSSIDAZIONE COINCIDE CON LA VALENZA Valenza N. ossidaz. CH 4 4 -4 C 2 H 6 C 2 H 4 C 2 H 2 C 3 H 8 4 4 -3 -2 -1 -8/3 3

Determinazione del numero di ossidazione degli elementi nei loro composti Il n. o. di un atomo in una molecola può essere determinato in base alle seguenti semplici regole Ø Il n. o. di un atomo allo stato elementare è sempre = zero. Ø Il n. o. dell’ossigeno O è sempre – 2, tranne in OF 2 (n. o. +2) nei perossidi (O-O-, n. o. – 1) e nei superossidi come KO 2(n. o. – 1/2). Ø Il n. o. dell’ H è sempre n. o. +1, tranne che negli idruri (composti binari con i metalli) in cui presenta n. o. – 1. Ø Nei composti ionici (catione / anione) il n. o. è uguale alla valenza ionica preceduta da +/- (corrisponde alla propria carica). Ø La somma algebrica dei n. o. deve essere =0 per le specie neutre o = alla sua carica per gli ioni molecolari Notazione di Stock: numeri romani in parentesi tonda Es: Fe(III)

Numeri di ossidazione positivi: elettroni ceduti Numeri di ossidazione negativi: elettroni acquistati Conoscere i numeri di ossidazione degli elementi dei composti coinvolti in una reazione consente di distinguere le reazioni di ossidoriduzione (REDOX) dalle normali reazioni di scambio (o spostamento): nelle prime i numeri di ossidazione degli elementi cambiano, nelle seconde no. Ca(SO 4) + 2 Na(OH) Cl 2 + Na. Br Ca(OH)2 + Na 2(SO 4) Na. Cl + Br 2 5

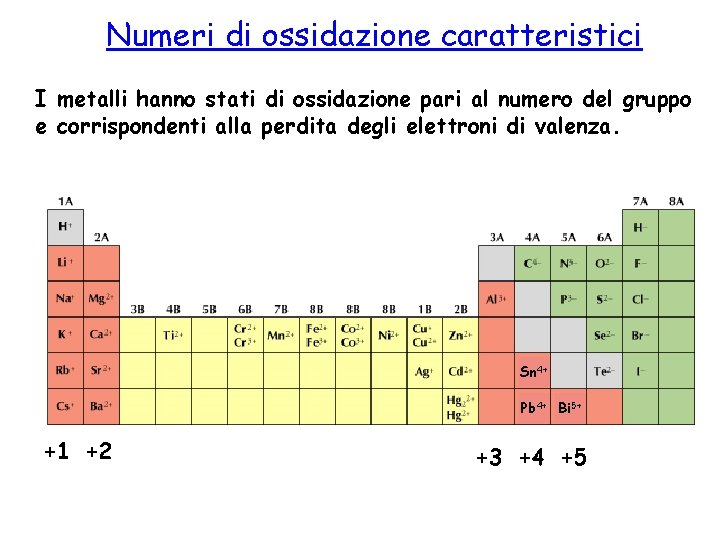
Numeri di ossidazione caratteristici I metalli hanno stati di ossidazione pari al numero del gruppo e corrispondenti alla perdita degli elettroni di valenza. Sn 4+ Pb 4+ Bi 5+ +1 +2 +3 +4 +5

Stati di ossidazione I metalli più pesanti (periodo 5 o 6) possono mantenere i due elettroni s di valenza e dare stati di ossidazione pari al numero del gruppo meno due. In+ Tl+ +1 +2 +3

I non-metalli (eccetto gli elementi più elettronegativi, come F e O) possono avere molti numeri di ossidazione, compresi tra: - il numero del gruppo (n° d’ossidazione più alto) tutti gli elettroni di valenza persi VII A da +7 a -1 VI A da +6 a -2 V A da +5 a -3

Terzo Gruppo Quarto Gruppo (terre) (sottogr. A del carbonio) B. Boro +3 (non metallo) C. Carbonio (+2), +4 (non metallo) Al. Alluminio +3 (anfotero) Si. Silicio (+2), +4 (non metallo) Ce. Cerio +3, + 4 (metallo) Sn. Stagno (+2), +4 (anfotero) Pb. Piombo (+2), +4 (metallo) Quinto Gruppo Sottogruppo A dell’azoto N. Azoto -3, (+1), (+2), (+3), (+4), + 5 (non metallo) P. Fosforo -3, (+1), (+3), + 5 (non metallo) As. Arsenico -3, (+1), (+3), + 5 (non metallo) Sb. Antimonio -3, (+3) (anf. ) , + 5 (non metallo) Bi. Bismuto -3, (+3) (met. ) , + 5 (non metallo) Sesto Gruppo Sottogruppo A Sottogruppo B (non-metalli, calcogeni) O. Ossigeno -2, (-1) Cr. Cromo +2 (metallo) S. Zolfo +2, +4, +6 +3 (anfotero) +6 (non metallo)9

Settimo Gruppo Sottogruppo A Sottogruppo B (Non metalli, alogeni) F. Fluoro -1 Mn. Manganese +2 (metallo) Cl. Cloro -1, +3, +5, +7 +3 (anfotero) Br. Bromo -1, +3, +5, +7 +6, +7 (non metallo) I. Iodio -1, +3, +5, +7 Ottavo Gruppo (metalli) Fe. Ferro +2, +3 Co. Cobalto +2, +3 Ni. Nichel +2, +3 Note Carbonio: solo composti inorganici Ossigeno: -1 nei perossocomposti Idrogeno: -1 negli idruri Tutti gli elementi, come sostanze semplici, hanno n. o. zero 10

Da ricordare …… • Il fluoro F ha sempre n. o. – 1. • Il cloro Cl ha sempre n. o. – 1, tranne nei legami con F e con O n. o. positivi. • Il Br ha sempre n. o. – 1 tranne nei legami con F, O e Cl n. o. positivi. • l’ H ha sempre n. o. positivo nei legami con i non metalli (che sono più elettronegativi di lui) e sempre negativo con i metalli (che sono meno elettronegativi di lui) • I metalli hanno sempre n. o. positivi; i metalli alcalini: n. o. +1 • I metalli alcalino terrosi, Zn e Cd: n. o. + 2. • Il B e l’Al: n. o. +3 • In una molecola la somma algebrica dei n. o. di tutti gli atomi deve essere zero. • In uno ione (positivo o negativo) la somma algebrica dei 11 n. o. deve essere uguale alla carica dello ione stesso.

Nomenclatura L’insieme delle convenzioni che assegnano un appellativo ad un composto chimico. Nomenclatura d’uso: NH 3 (ammoniaca), H 20 (acqua), NH 4 (ammonio) Nomenclatura tradizionale: si avvale di suffissi e prefissi Nomenclatura IUPAC: predilige il numero di atomi componenti una molecola in stretta correlazione con la formula bruta 12

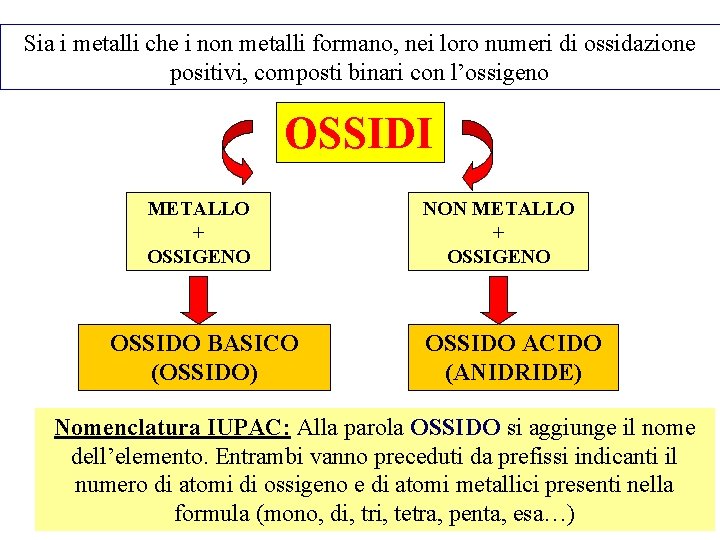
Sia i metalli che i non metalli formano, nei loro numeri di ossidazione positivi, composti binari con l’ossigeno OSSIDI METALLO + OSSIGENO OSSIDO BASICO (OSSIDO) NON METALLO + OSSIGENO OSSIDO ACIDO (ANIDRIDE) Nomenclatura IUPAC: Alla parola OSSIDO si aggiunge il nome dell’elemento. Entrambi vanno preceduti da prefissi indicanti il numero di atomi di ossigeno e di atomi metallici presenti nella 13 formula (mono, di, tri, tetra, penta, esa…)

OSSIDI BASICI (M + O): Mx. Oy Gli indici x e y dipendono dai rispettivi numeri di ossidazione: M+ + O 2 - M 2 O M 2+ + O 2 - MO M 3+ + O 2 - M 2 O 3 M 4+ + O 2 - MO 2 OSSIDI ACIDI (NM + O): Ex. Oy Gli indici x e y dipendono dai rispettivi numeri di ossidazione: E 1+ + O 2 - E 2 O E 2+ + O 2 - EO E 3+ + O 2 - E 2 O 3 E 4+ + O 2 - EO 2 E 5+ + O 2 - E 2 O 5 E 7+ + O 2 - E 2 O 7

Esempi di ossidi metallici • • • Na 2 O: Monossido di disodio Fe 2 O 3: Triossido di diferro Ba. O: Monossido di bario Li 2 O: Monossido di dilitio Sn. O 2: Diossido di stagno Al 2 O 3: Triossido di dialluminio

Esempi di ossidi di non metalli • • Cl 2 O: Monossido di dicloro Cl 2 O 3: Triossido di dicloro Cl 2 O 5: Pentossido di dicloro Cl 2 O 7: Eptossido di dicloro CO: Monossido di carbonio CO 2: Diossido di carbonio SO 2: Diossido di zolfo SO 3: Triossido di zolfo

Nomenclatura Tradizionale per ossidi metallici ü Se l’elemento ha un solo numero di ossidazione: Alla parola OSSIDO si fa seguire il nome dell’elemento; si può anche usare la proposizione di, seguita dal nome dell’elemento ü Se l’elemento ha due numeri di ossidazione: Alla parola OSSIDO si aggiunge un attributo costituito dalla radice del nome dell’elemento e da un suffisso: -OSO riferito al n. o. più basso -ICO riferito al n. o. più alto (anche usato per composti derivati da elementi con n. o. unico)

Nomenclatura Tradizionale per ossidi non metallici o anidridi Alcuni non metalli (soprattutto gli alogeni) presentano più di due n. o. positivi. Il loro nome si indica con la parola anidride seguita da un attributo al femminile con gli stessi suffissi OSA e ICA. +2 +4 CO anidride carboniosa CO 2 anidride carbonica Si utilizzano, oltre ai suffissi, anche i prefissi IPO- e PER- per distinguere i possibili composti: +1 +3 +5 +7 Cl 2 O 3 Cl 2 O 5 Cl 2 O 7 anidride ipoclorosa anidride clorica anidride perclorica

IDROSSIDI (M+O+H) Derivano formalmente dalla reazione di ossidi basici (ossidi metallici) con acqua: K 2 O + H 2 O 2 KOH Sono costituiti dallo ione METALLICO positivo Mn+ e da n IONI OSSIDRILI OH-. Valgono le stesse regole per la nomenclatura: Na. OH (Mono)Idrossido di sodio Fe(OH)2 Diidrossido di ferro Fe(OH)3 Triidrossido di ferro Ca(OH)2 Diidrossido di calcio Se l’elemento ha un solo numero di ossidazione si può utilizzare la sola preposizione di: Mg(OH)2: Idrossido di magnesio 19

Acidi ossigenati o acidi ternari • Derivano dalle anidridi per formale addizione di H 2 O. • Nella formula si scrive dapprima l’H, quindi il simbolo dell’elemento, ed infine l’ossigeno. • Al nome dell’acido si associano gli stessi prefissi e suffissi dell’anidride da cui deriva. (anidride solforosa) SO 2 + H 2 O H 2 SO 3 (acido solforoso) (anidride solforica) SO 3 + H 2 O H 2 SO 4 (acido solforico) (anidride nitrica) N 2 O 5 + H 2 O H 2 N 2 O 6 HNO 3 (acido nitrico) (anidride carbonica) CO 2 + H 2 O H 2 CO 3 (acido carbonico)

Acidi Ossigenati (Anidride ipoclorosa) Cl 2 O + H 2 O H 2 Cl 2 O 2 2 HCl. O (acido ipocloroso) (Anidride clorosa) Cl 2 O 3 + H 2 O H 2 Cl 2 O 4 2 HCl. O 2 (acido cloroso) (Anidride clorica) Cl 2 O 5 + H 2 O H 2 Cl 2 O 6 2 HCl. O 3 (acido clorico) (Anidride perclorica) Cl 2 O 7 + H 2 O H 2 Cl 2 O 8 2 HCl. O 4 (acido perclorico) (Anidride bromica) Br 2 O 5 + H 2 O H 2 Br 2 O 6 2 HBr. O 3 (acido bromico) (Anidride bromosa) Br 2 O 3 + H 2 O H 2 Br 2 O 4 2 HBr. O 2 (acido bromoso)

Acidi Ossigenati Alcuni non metalli, soprattutto del IV e del V gruppo formano acidi con formula corrispondente all’addizione di una quantità variabile di molecole di H 2 O all’anidride. Così per uno stesso numero di ossidazione possono esistere diversi acidi, distinguibili con appropriati prefissi, fermo restando il suffisso associato a quel n. o. All’aumentare del numero di molecole d’acqua si usano i seguenti suffissi: META-, PIRO- (o DI-), ORTO. P 2 O 5 + H 2 O HPO 3 P 2 O 5 + 2 H 2 O H 2 P 2 O 7 P 2 O 5 + 3 H 2 O H 3 PO 4 (acido metafosforico) (acido pirofosforico o difosforico) (acido ortofosforico)

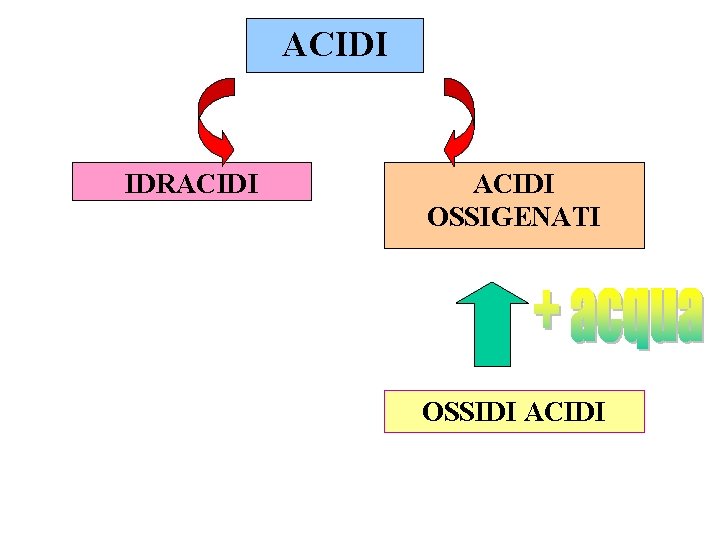
IDROGENO + + METALLO NON METALLO IDRURI IDRACIDI BINARI

IDRACIDI (NM+H) Gli alogeni e lo zolfo formano nei loro n. o. negativi, acidi binari con l’H. Si indicano col suffisso –IDRICO (essi fanno comunque parte di una classe più vasta, detta dei composti binari, il cui nome sistematico IUPAC si ottiene ponendo dapprima la radice del nome dell’alogeno, più elettronegativo dell’idrogeno, a cui va aggiunta la desinenza –URO, seguito dalla preposizione di e dal nome del primo costituente) HF HCl H 2 S HBr HI HCN acido fluoridrico (fluoruro di idrogeno) acido cloridrico (cloruro di idrogeno) acido solfidrico (solfuro di idrogeno) acido bromidrico (bromuro di idrogeno) acido iodidrico (ioduro di idrogeno) acido cianidrico (cianuro di idrogeno)

ACIDI IDRACIDI OSSIGENATI OSSIDI ACIDI

Composti binari con l’idrogeno Oltre agli IDRACIDI, esistono altri composti binari con l’idrogeno üI metalli si combinano con l’idrogeno avente n. o. – 1 formando composti comunemente detti IDRURI METALLICI: Al. H 3 idruro di alluminio Li. H idruro di litio Fe. H 3 idruro ferrico üL’ossigeno, come lo zolfo in H 2 S, forma l’acqua H 2 O üGli elementi del Vo gruppo si legano ad H nei loro n. o. negativi (-3): NH 3 ammoniaca PH 3 fosfina As. H 3 arsina Sb. H 3 stibina ü Il carbonio, il silicio e il boro formano i seguenti composti: CH 4 metano Si. H 4 silano BH borano

Composti binari tra Metalli e Non Metalli (M+NM): “SALI BINARI” I non metalli danno frequentemente tra loro composti binari covalenti. All’elemento più elettronegativo si dà il suffisso –URO: ICl cloruro di iodio Si 3 N 4 nitruro di silicio OF 2 fluoruro di ossigeno* Si. C carburo di silicio P 2 S 3 solfuro fosforoso * ATTENZIONE: OF 2 è l’unico composto in cui O ha n. o. +2

Ioni metallici positivi (cationi) nomenclatura IUPAC 1. Per uno ione monoatomico positivo, cioè un catione metallico, il nome del metallo è preceduto dalla parola “ione”. Esempio: Na+, ione sodio, Ca++ ione calcio. 2. Per i metalli di transizione, i quali possono avere più di uno ione positivo, si usa un numero romano per indicare la carica dello ione. Esempio: Fe 2+, ione ferro (II), Fe 3+, ione ferro (III), Hg 2+ ione mercurio (II), Hg 22+ ione mercurio (I).

Ioni negativi HC 4 N 3 Ione idruro carburo nitruro O 2 FIone ossido fluoruro P 3 S 2 Cl. Ione fosfuro solfuro cloruro Gli ioni monoatomici (costituiti da un solo atomo) fanno seguire alla radice dell’elemento la desinenza uro. Lo ione O 2 - fa eccezione e viene indicato con la parola ossido. Gli ioni F-, Cl-, Br-, I-, S 2 - possono essere considerati derivati dall’acido alogenidrico perdita di uno ione H+ (residuo alogenico) Br. Ione bromuro IIone ioduro

Ioni Poliatomici, ossoanioni v. Quello che resta di un acido ossigenato perdita di atomi di idrogeno si chiama radicale acido. Per ogni idrogeno tolto si aggiunge una carica negativa. ØIl numero delle cariche costituisce la valenza del radicale Si usano suffissi diversi da quelli dei corrispondenti acidi: -OSO -ITO -ICO -ATO CO 32 Ione carbonato Cl. OIone NO 2 Ione nitrito NO 3 Ione nitrato SO 32 Ione solfito SO 42 Ione solfato Cl. O 2 Ione Cl. O 3 Ione Cl. O 4 Ione Br. O 4 Ione ipoclorito clorato perclorato Br. OIone Br. O 2 Ione Br. O 3 Ione ipobromito bromato perbromato

Ioni Poliatomici, ossoanioni HCl. O acido ipocloroso HCl. O 2 acido cloroso HCl. O 3 acido clorico HCl. O 4 acido perclorico HBr. O acido ipobromoso HBr. O 2 acido bromoso HBr. O 3 acido bromico HBr. O 4 acido perbromico HNO 2 acido nitroso HNO 3 acido nitrico H 2 SO 3 acido solforoso H 2 SO 4 acido solforico H 3 PO 4 acido fosforico Cl. O 2 Cl. O 3 Cl. O 4 Br. O 2 Br. O 3 Br. O 4 NO 2 NO 3 SO 32 SO 42 PO 43 - ione ipoclorito ione clorato ione perclorato ione ipobromito ione bromato ione perbromato ione nitrito ione nitrato ione solfito ione solfato ione fosfato

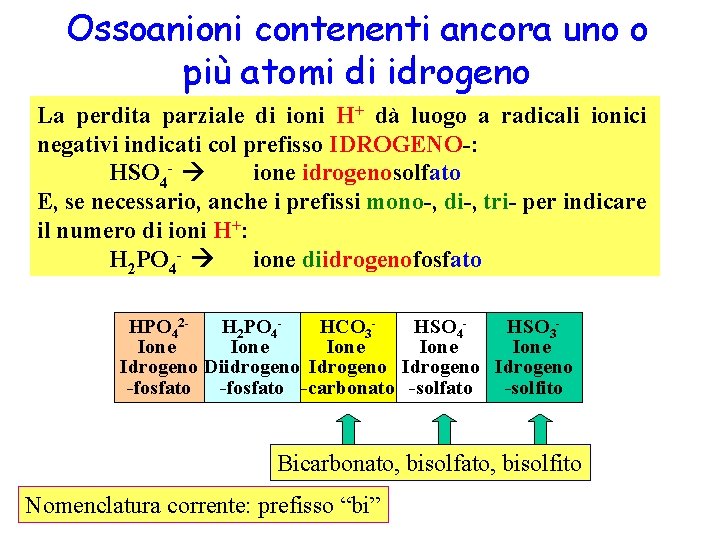
Ossoanioni contenenti ancora uno o più atomi di idrogeno La perdita parziale di ioni H+ dà luogo a radicali ionici negativi indicati col prefisso IDROGENO-: HSO 4 - ione idrogenosolfato E, se necessario, anche i prefissi mono-, di-, tri- per indicare il numero di ioni H+: H 2 PO 4 - ione diidrogenofosfato HPO 42 H 2 PO 4 HCO 3 HSO 4 HSO 3 Ione Ione Idrogeno Diidrogeno Idrogeno -fosfato -carbonato -solfito Bicarbonato, bisolfito Nomenclatura corrente: prefisso “bi”

Sali I sali si originano per reazione tra un composto derivato da un metallo (ossido basico, idrossido o il metallo stesso) e un composto derivato da un non metallo (anidride, acido o lo stesso non metallo) Un sale è costituito da una parte metallica (ione del metallo o altro catione tra quelli descritti) e da una parte non metallica (un radicale acido o altri anioni). Il NOME del sale è dato dall’attributo del corrispondente Radicale acido completo di suffissi e prefissi, seguito dal nome dello ione positivo con i suffissi –OSO e –ICO a seconda del n. o. La FORMULA di un sale si compone del simbolo del metallo (o dello ione positivo) seguito dal simbolo del radicale acido. Al primo diamo come indice la valenza del secondo e viceversa, poi, se è possibile, si semplificano gli indici dividendoli per uno stesso numero.

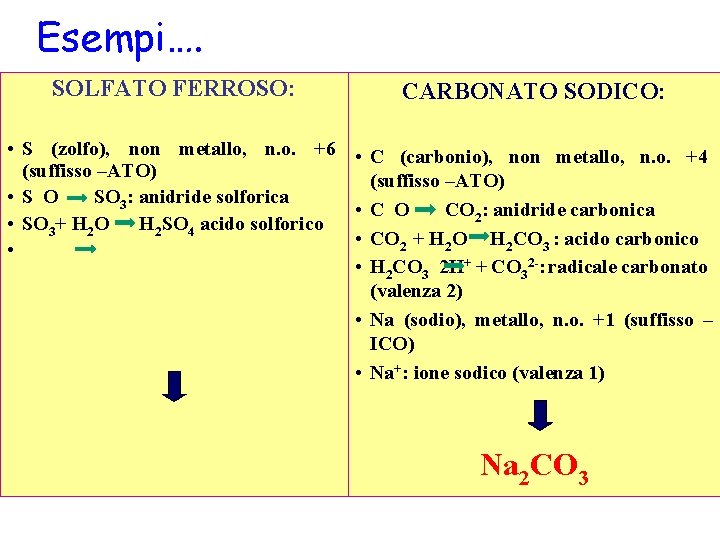
Esempi…. SOLFATO FERROSO: CARBONATO SODICO: • S (zolfo), non metallo, n. o. +6 • C (carbonio), non metallo, n. o. +4 (suffisso –ATO) • S O SO 3: anidride solforica • C O CO 2: anidride carbonica • SO 3+ H 2 O H 2 SO 4 acido solforico • CO 2 + H 2 O H 2 CO 3 : acido carbonico • • H 2 CO 3 2 H+ + CO 32 -: radicale carbonato (valenza 2) • Na (sodio), metallo, n. o. +1 (suffisso – ICO) • Na+: ione sodico (valenza 1) Na 2 CO 3

Esempi…. Perclorato di rame (Perclorato rameico): Ipoiodito di potassio ( ipoiodito potassico): • Cl (cloro), non metallo, n. o. +7 • I (iodio), non metallo, n. o. +1 (prefisso –PER e suffisso –ATO) (prefisso –IPO e suffisso –ITO) • Cl O • I O Cl 2 O 7: anidride perclorica • Cl 2 O 7 + H 2 O H 2 Cl 2 O 8 HCl. O 4 acido perclorico I 2 O: anidride ipoiodosa • I 2 O + H 2 O HIO: acido ipoiodoso • IO- : radicale ipoiodito (valenza 1) • Cl. O 4 -: ione perclorato (valenza 1) • K (potassio), metallo, n. o. +1 • Cu (rame), metallo, n. o. +2 (suffisso –ICO) • K+ : ione potassico (valenza 1) • Cu 2+ : ione rameico (valenza 2) Cu(Cl. O 4)2 KIO

Esempi • • • • K 2 CO 3: Cu(NO 3)2: Cu. Cl: Fe. Cl 3: Fe 2(SO 3)3: Na 2 SO 4: Ba. SO 4: Na 3 PO 4: Al 2 S 3: Al. PO 4: Mn. Cl 2: KMn. O 4: NH 4 Cl: carbonato potassico nitrato rameico cloruro rameoso cloruro ferrico solfito ferrico solfato sodico solfato di bario fosfato sodico solfuro di alluminio fosfato di alluminio cloruro di manganese permanganato di potassio cloruro di ammonio

Sali acidi (derivanti da ossoanioni acidi) I sali formati dai derivati dagli acidi per parziale perdita di ioni H+ sono detti SALI ACIDI. Ad esempio da H 2 SO 4 si possono formare sia SO 42 - (valenza 2) sia HSO 4 - (valenza 1). I sali che derivano da questi nuovi acidi sono genericamente indicati come sali acidi oppure vengono chiamati col prefisso IDROGENO-. Quindi lo ione HSO 4 - verrà denominato solfato acido oppure idrogenosolfato. • Nel caso di acidi con più di due H, i radicali acidi che si possono formare sono più di due. Si useranno allora appropriati prefissi. S (zolfo), non metallo, n. o. +6 (suffisso – ESEMPIO: H 3 PO 4 acido ortofosforico da cui derivano i seguenti radicali acidi: ATO) • H 2 PO 4 - ione fosfato biacido o diidrogenofosfato SO 3: anidride solforica Ca(H 2 PO 4)2 diidrogenofosfato calcico (o di calcio) H 2 SO 4: acido solforico (anche fosfato monocalcico) 2 HSO 4 : radicale idrogenosolfato (valenza • HPO 2 - ione fosfato monoacido oppure ione 4 1) monoidrogenofosfato Mn (manganese), metallo, n. o. +2 (suffisso Ca. HPO 4 monoidrogenofosfato calcico (o di calcio) –OSO) (anche fosfato bicalcico) • PO 43 - ione fosfato Mn 2+ : ione manganoso (valenza 2) Ca 3(PO 4)2 fosfato calcico (o di calcio) 37 Mn(HSO 4)2 (anche fosfato tricalcico) SOLFATO ACIDO MANGANOSO • • •

+ acqua ACIDI OSSIGENATI
 La valenza chimica
La valenza chimica Valenza chimica
Valenza chimica Carica formale
Carica formale La valenza chimica
La valenza chimica Classificazione e nomenclatura dei composti riassunto
Classificazione e nomenclatura dei composti riassunto Chimica più dalla mole alla nomenclatura soluzioni
Chimica più dalla mole alla nomenclatura soluzioni Chimica organica mappa concettuale
Chimica organica mappa concettuale Posca soluzioni
Posca soluzioni Numeri ossidazione cromo
Numeri ossidazione cromo Mappa concettuale nomenclatura chimica
Mappa concettuale nomenclatura chimica Mappa concettuale nomenclatura chimica
Mappa concettuale nomenclatura chimica Classificazione dei composti chimici mappa concettuale
Classificazione dei composti chimici mappa concettuale Vito posca
Vito posca Schema nomenclatura chimica
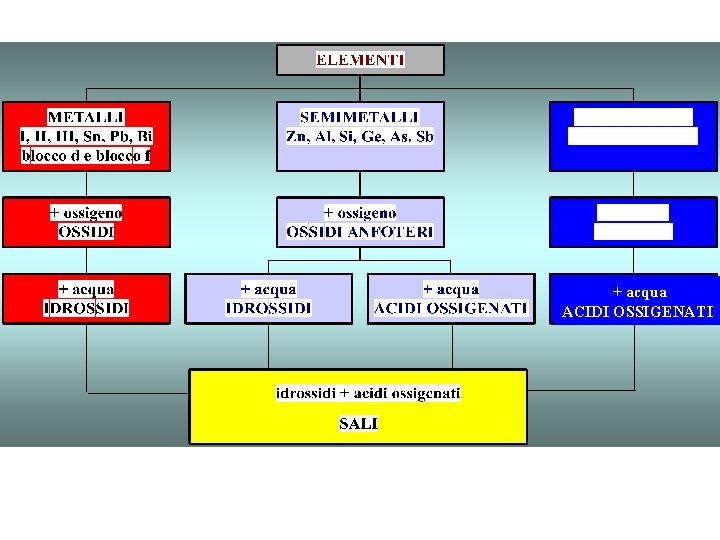
Schema nomenclatura chimica I 14 bisogni della henderson
I 14 bisogni della henderson Concetti indicatori e variabili esempi
Concetti indicatori e variabili esempi Concetti chiave pirandello
Concetti chiave pirandello Concetti primitivi geometria
Concetti primitivi geometria Teoria del legame di valenza
Teoria del legame di valenza Robin valenza
Robin valenza Elettroni di valenza
Elettroni di valenza Frasi di analisi grammaticale
Frasi di analisi grammaticale Ibridazioni
Ibridazioni Fungsi anggaran laba
Fungsi anggaran laba Kant sensibilidad
Kant sensibilidad Lex posterior derogat legi priori
Lex posterior derogat legi priori A priori
A priori A priori algorithm
A priori algorithm Metodo dialectico
Metodo dialectico Luka tetyczna
Luka tetyczna Slot filler
Slot filler Cual es el origen del conocimiento
Cual es el origen del conocimiento Cartoon married couple
Cartoon married couple Differenza tra certezza e verità
Differenza tra certezza e verità A priori and post hoc comparisons
A priori and post hoc comparisons Niezgodność prakseologiczna
Niezgodność prakseologiczna Examples of priori codes
Examples of priori codes Systematyzacja pionowa
Systematyzacja pionowa Priori and posteriori knowledge
Priori and posteriori knowledge