Kemk a spol Historie Kemen Si O 2








![Silany (Hydridy křemíku) • Příprava – Si. Cl 2 n+2 + Li[Al. H 4] Silany (Hydridy křemíku) • Příprava – Si. Cl 2 n+2 + Li[Al. H 4]](https://slidetodoc.com/presentation_image_h/17461ccd00efa6d38cdb8f22045c2087/image-10.jpg)



















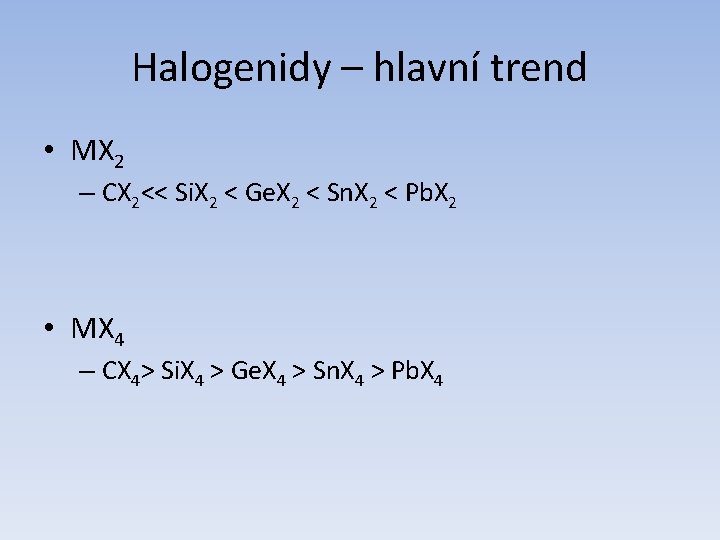









- Slides: 40

Křemík a spol.

Historie • Křemen Si. O 2 • silex – pazourek, 40 000 př. Kr • silicon – -on (carbon, boron), Thomson 1831 • Si • 1823 Berzelius redukce K 2[Si. F 6] roztaveným draslíkem • 1858 příprava Si. H 4 Wöhler • 1863 příprava Si. Et 4 Friedel Crafts

Výskyt křemíku • 2. nejzastoupenější prvek v zemské kůře (27, 2% hm. ), po kyslíku (45, 5%) hm. • Ve vesmíru až 7. místo, nerovnoměrné rozložení prvků při vzniku sluneční soustavy • V minerálech zpravidla s kyslíkem – olivín (Mg, Fe)2 Si. O 4, M 2 Si. O 4 olivín, M 2 Si 2 O 6 pyroxen, M 7{(Al, Si)4 O 11}(OH)2 amfibol, (K, H)2(Mg, Fe)2(Al, Fe)(Si. O 4)3 biotit, KAl. Si 3 O 8 orthoklas, křemen Si. O 2 … – Obrovská diverzita – Eventuálně přítomnost OH- a F- ve struktuře, – Většinou koordinační číslo 4, jednotka {Si. O 4}

Výroba • Redukce křemene (písku) koksem v elektrické obloukové peci Si. O 2 + 2 C → Si + 2 CO 2 Si. C + Si. O 2 Si → 3 Si + 2 CO - dočištění loužením vodou, čistota 96 -99% • V přítomnosti železa – ferrosilicium Fe. Si • Do polovodičů - obsah nečistot pod 10 -9 i 10 -12 % • • Chlorace na Si. Cl 4, či Si. HCl 3 – frakční destilace) Redukce velmi čistým Zn či Mg Houbovitý Si se roztaví, nechá narůst do válcového monokrystalu Zonální tavení • Alternativy • • redukce Na 2[Si. F 6] sodíkem Rozklad Si. I 4 na rozžhaveném wolframovém vlákně…

Atomové a fyzikální vlastnosti Vlastnost C Si Ge Sn Pb Atomové číslo 6 14 32 50 82 Atomová hmotnost 12, 011 28, 085 72, 59 118, 69 207, 2 Počet stabilních izotopů 2+1 3 5 10 4 Ionizační energie I. (k. J/mol) 1086, 1 786, 3 761, 2 708, 4 715, 4 II. 2351, 9 1576, 5 1537, 0 1411, 4 1450, 0 III. 4618, 8 3228, 3 3301, 2 2942, 2 3080, 7 IV. 6221, 0 4354, 4 4409, 4 3929, 3 4082, 3 r. II/pm (iontový) - - 73 118 119 r. IV/pm (iontový) (15) 40 53 69 78 Teplota tání (°C) 4100 1420 945 232 327 Tepltota varu (°C) - ~3280 2850 2623 1751 Hustota (gcm-1) 3, 514 2, 336 5, 323 α 5, 769 β 7, 265 11, 342 elektrická rezistivita (20°C) (Ωcm) 1014 -1016 ~48 ~47 β 11∙ 10 -6 20∙ 10 -6 Zakázaný pás Eg (k. J/mol) ~580 106, 8 64, 2 α 7, 7 β 0 0

Chemické vlastnosti • Odolný – pasivace tenkou vrstvou Si. O 2 – Při vyšších teplotách: • • 600 °C + S 950 -1160 °C → Si. O 2 1000 °C + P 1400 °C → Si. N + Si 3 N 4 • S kyselinami pouze HF a HNO 3 • Horké vodné roztoky alkalických hydroxidů – Si + 4 OH → Si. O 44 - + 2 H 2 • S halogeny reaguje – F 2 normální teplota – Cl 2 300°C – Br 2 + I 2 500 °C • S alkylhalogenidy (katalýza Cu) • Roztavený rychle oxiduje, redukuje většinu kovových oxidů (slitiny, silicidy) – Žáruvzdorné nádoby – boridy, Zr. O 2

Karbid křemíku • 1891 E. G. Acheson – Carbon (10) + Corundum (9) = Carborundum (9, 5) • Si. C – 70 krystalových modifikací – α – hexagonální wurzitový typ Zn. S – β – kubický diamantový, nebo sfaleritový typ Si. O 2 + 2 C (koks, antracit)→ Si + 2 CO Si + C → Si. C • Fyzikální a chemická odolnost – – rozklad až při 2700 °C odolává i HF (ale ne H 3 PO 4 !) oxidace hydroxidy Si. C + 2 Na. OH + 2 O 2 → Na 2 Si. O 3 + H 2 O + CO 2 reakce s chlorem (100 °C)→ Si. Cl 4 + C • Brusiva, žáruvzdorné materiály s nízkým koeficientem roztažnosti, polovodiče (β-vysokoteplotní), elektrické topné prvky, elektroluminiscenční diody…

Silicidy • Celá řada sloučenin s většinou kovů • Podobné spíše boridům, než karbidům (ale Si má větší kovalentní poloměr, nejsou tedy isodtrukturní Si (118 pm) > B (88 pm) • proměnlivé složení – vazba: kovová → kovalentní → iontová • M 6 Si, M 5 Si, M 4 Si, M 15 Si 4, M 3 Si, M 5 Si 2, M 2 Si M 5 Si 3, M 3 Si 2, MSi, M 2 Si 3, MSi 2, MSi 3, MSi 6 … • příprava , – přímým tavením směsi prvků – společná redukce Si. O 2 s Mx. Oy uhlíkem či hliníkem • Silicidy kovů I a IIA sk. mnohem reaktivnější, hydrolyzují – Na. Si 2 + H 2 O → Na 2 Si. O 3 + H 2 – Mg. Si + 2 H 2 SO 4 (aq) → Mg. SO 4 + Si. H 4 – záleží i na povaze silicidu, hydrolýza Ca 2 Si, Ca. Si a Ca. Si 2 poskytuje zcela odlišné produkty

Silany (Hydridy křemíku) • • • 1857 připraveno Si. H 4 a Si. HCl 3 1863 Fridel, Crafts Si. Et 4 1902 H. Moissan, S. Smiles Si 2 H 6 1916 A. Stock, název silany obecný vzorec Sin. H 2 n+2, rozvětvené i nerozvětvené (až n = 8), i cyklické hexamery –preference lineárních řetězců větší iontový průměr (napadání nukleofily), větší polarita vazeb Si-X, přítomnost energeticky nízkoležících orbitalů d - tvorba aduktů 1: 1 a 1: 2 – snižuje aktivační energii reakce energie vazby: Si –Si < Si-C < C-C … Si-H < C-H … C-X < Si-X bezbarvé plyny nebo těkavé kapaliny velmi reaktivní (samovzněcování na vzduchu apod. ) s délkou řetězce stálost klesá snaha o přípravu silenů nakonec úspěšná: Mes 2 Si. Cl 2 (+Li) → (Mes 2 Si)3 (+hν) → Mes 2 Si=Si. Mes 2 (stálý až do 176 °C)
![Silany Hydridy křemíku Příprava Si Cl 2 n2 LiAl H 4 Silany (Hydridy křemíku) • Příprava – Si. Cl 2 n+2 + Li[Al. H 4]](https://slidetodoc.com/presentation_image_h/17461ccd00efa6d38cdb8f22045c2087/image-10.jpg)
Silany (Hydridy křemíku) • Příprava – Si. Cl 2 n+2 + Li[Al. H 4] → Si. H 4, Si 2 H 6, Si 3 H 8 – Me 2 Si. Cl 2 + Li[Al. H 4] → Me 2 Si. H 2 eventuálně přímo z křemíku – Si + 3 HCl → Si. HCl 3 + HCl (350 °C) – Si + Me. Cl → Me. Si. HCl 2 + H 2 + C (Cu, 300 °C) • • Pyrolýzou vznikají polymerní látky (Si. H 2)n a následně Si + H 2 (příprava ultračistého Si) neprobíhá radikálově (H 3 C·), ale dochází k eliminiaci silenů (: Si. H 2 či : Si. HR) – mimořádně reaktivní částice, viz organoprvky Čisté silany s vodou ani se zředěnými kyselnami nereagují, ale přítomnost alkalických látek vede k totální hydrolýze na Si. O 2 a H 2 solvolýza – – • • Si. H 4 + Me. OH → Si. H 4 -n(OMe)n Si. H 4 + Me 2 CO → C 3 H 7 OSi. H 3 ( 400°C) V přítomnosti Cl 2 či Br 2 reaguje Si. H 4 explozivně (u Br 2 to lze regulovat snížením teploty na -78°C) Dva důležité prekurzory pro syntézu dalších silanů – – : Si. Me 2 + Me. I → Si. H 3 I Si. H 4 + 2 K → Si. KH 3 + KH

Silany (Hydridy křemíku) • „Je namístě plísnit chemika, který se pokouší aplikovat úspěch organické chmie také na studium polysilanů, neboť se chová jako ten, kdo dojí koně, a přitom rajtuje krávu“ Grant Urry

Halogenidy křemičité (a jemu podobné) • Si. X 4 • Nejen důležitý krok pro přípravu polovodičivě čistého Si • smíšené halogenidy • n. Si. H 4 + (4 -n)Si. Y 4 ↔ 4 Si. Xn. Y 4 -n • připraveny perhalogenované vyšší homology – připraveny až Si 16 F 34 , Si 6 Cl 14 , Si 4 Br 10 – řetězení častější než u hydridů • zpětná dativní vazba ze zaplněných pπ(X) do dπ(Si), která synergicky kompenzuje snížení elektronové hustoty vznikající vazby σ • možnost částečné hydrolýzy, Cl 3 Si(OSi. Cl 2)n. OSi. Cl 3

oxid křemičitý. . . přenecháme jiným

Sloučeniny se sírou • sulfidy • Si + S → Si. S 2 (100 °C) – Struktura asbestu – nekonečné řetězce tvořené tetraedry sdílející společné hrany – Dlouhá bílá ohebná vlákna, teplota tání 1090 °C – Není moc chemicky stálý • Hydrolýza Si. S 2 + 2 H 2 O → Si. O 2 + 2 H 2 S • Amonolýza Si. S 2 + 4 NH 3 → Si(NH)2 + NH 4 SH • Alkoholýza Si. S 2 + 4 Et. OH → Si(OEt)4 + H 2 S

Sloučeniny s dusíkem • Nitridy • Si 3 N 4 • Si + N 2 → Si 3 N 4 (1300 °C) • Si. O 2 + C (koks) + N 2 → Si 3 N 4 + CO 2 – Velmi chemicky stálá a tvrdá (9), izolant – Zachovává tvar, pevnost i odolnost i při 1000 °C • Si 2 N 2 O – Si + Si. O 2 + proud Argonu s 5% N 2, 1450 °C • Zprohýbané hexagonální sítě se střídáním Si-N • Vrstvy spojené přes kyslík (úhel na O: 148° )

Organokřemičité sloučeniny • Stálé a netečné • Pevná vazba Si-C (dvojné Si=C ne moc stálé) • Silikonové materiály – – Vazby Si-C a Si-O-Si Hydrofobní, tepelně i chemicky odolné Oleje, mazadla, kaučuky a pryskyřice -OSi(R)2 O- (R = organický zbytek – Me, Ph…) • Polykondenzace • síťování – Zavedení RSi. Cl 3 do reakční směsi(R 3 Si. Cl – terminace) – Dodatečně, radikálově

Germanium Cín Olovo

Historie • Germanium – 1864 J. A. R. Newlands předpověděl – 1886 C. A. Winkler – argyrodit Ag 8 Ge. S 6 • Cín – Součást bronzu Cu (85%) + Sn (15%) 3000 př. Kr • Olovo – Glazování keramiky 7000 -5000 př. Kr. – Řím – olověné trubky

Výskyt a rozšíření • Ge – 1, 5 ppm, 53. místo – V minerálech velkmi vzácně, argyrodit Ag 8 Ge. S 6 – Izolace z uhelného popela, resp. z popílku uvolněném při zpracování zinečnatých rud • Sn - 2, 1 ppm, 48. místo – Sn. O 2 cínovec (kassiterit) • Pb – 13 ppm produkt rozpadu těžkých radioaktivních prvků (204 Pb nikoliv), diverzita atomové hmotnosti – Galenit Pb. S, anglesit Pb. SO 4, cerussit Pb. CO 3, pyromorfit Pb 5(PO 4)3 Cl… – 206 Pb, 207 Pb, 208 Pb

Výroba a použití Ge • • Loužení popílků H 2 SO 4 a následná alkalizace (současně se sráží Zn) Zahřívání s HCl/Cl a frakční destilace → Ge. Cl 4 83, 1°C (Zn. Cl 2 756 °C) Hydrolýza (na Ge. O 2), redukce H 2 (při 500 °C) Zonální tavení Polovodiče Optická zařízení (propustnost v IR) – okénka, čočky… Speciální slitiny, supravodiče, luminofory (Mg. Ge. O 3)

Výroba a použití Sn • • • Relativně snadná příprava redukcí Sn. O 2 uhlím (koksem 1200 °C) Přítomnost Fe v rudě způsobuje tvrdost vzniklé slitiny – proces v dostatečném tlaku O 2 (aby železo zůstávalo jako Fe. O, nikoliv jako Fe) – polování (míchání taveniny hranoly ze syrového dřeva) či vhánění horké páry či stlačeného vzduchu 40 % – pocínování plechu, elektrolyticky Balení potravin – konzervy, plechovky od piva Slitiny – Pájka Sn/Pb (typicky 33% Sn), přídavek Cd, Ga, In či Bi – Bronz Sn/Cu (5 -10% Sn) – Ložiskový kov (80 -90% Sn), Pb, Cu, nebo 75% Pb, 12% Sn, 13% Sb • Uložení tvrdých materiálů v měklé matrici – ložiska vagonů, lokomotiv, těžkých strojů – Cínová slitina (90 -95% Sn), Sb, Cu • Dekorativní užitková slitina, dobrá obrabitelnost – čajové misky, podnosy, svícny… • (90 -95% )Sn + Pb – výroba varhanních píšťal (Royal Albert Hall – 4 manuály, 111 rejstříků, 10 000 píšťal = 150 t Sn) – Liteřina Pb/Sn/Sb přibližně 2: 1: 1 • S růstem obsahu Sn a Sb roste tvdrost a odolnost k opotřebení • – Supravodivé magnety Nb 3 Sn 8% ve sloučeninách

Výroba a použití Pb • • • Pb. S – flotace (zakoncentrování chudé rudy) Pražení za omezeného přístupu vduchu → Pb. O Redukce koksem s tavidlem (Ca. CO 3) Pb. S + 1, 5 O 2 → Pb. O + SO 2 Pb. O + C → Pb + CO Pb. O + CO → Pb + CO 2 – Eventuálně Pb. S + 2 Pb. O → 3 Pb + SO 2 Surové Pb obsahuje ještě Cu, Ag, Au, Zn, Sn, As a Sb, které je nutno odstranit (do nejlepší čistoty elektrolýzou) Polovina vyrobeného olova – akumulátory Slitiny (pájka, ložiskové kovy, liteřina, nízkotající slitiny) Broky, munice, závaží, zátěže Pigmenty – antikorozí nátěrové hmoty: Pb 3 O 4 minium , Pb. Mo. O 4 (červenooranžový), 2 Pb. CO 3∙Pb(OH)2 olovnatá běloba, Pb. Cr. O 4 – žlutý pigment = značení silnic Organanické sloučeniny olova – antidetonanční přísady (Pb. Et 4 a Pb. Me 4)

Atomové a fyzikální vlastnosti Vlastnost C Si Ge Sn Pb Atomové číslo 6 14 32 50 82 Atomová hmotnost 12, 011 28, 085 72, 59 118, 69 207, 2 Počet stabilních izotopů 2+1 3 5 10 4 Ionizační energie I. (k. J/mol) 1086, 1 786, 3 761, 2 708, 4 715, 4 II. 2351, 9 1576, 5 1537, 0 1411, 4 1450, 0 III. 4618, 8 3228, 3 3301, 2 2942, 2 3080, 7 IV. 6221, 0 4354, 4 4409, 4 3929, 3 4082, 3 r. II/pm (iontový) - - 73 118 119 r. IV/pm (iontový) (15) 40 53 69 78 Teplota tání (°C) 4100 1420 945 232 327 Tepltota varu (°C) - ~3280 2850 2623 1751 Hustota (gcm-1) 3, 514 2, 336 5, 323 α 5, 769 β 7, 265 11, 342 elektrická rezistivita (20°C) (Ωcm) 1014 -1016 ~48 ~47 β 11∙ 10 -6 20∙ 10 -6 Zakázaný pás Eg (k. J/mol) ~580 106, 8 64, 2 α 7, 7 β 0 0

Vlastnosti prvků • Podobnost Si/Ge (zaplňování 3 d 10) • Podobnost Sn/Pb (zaplňování 4 f 14) • Ge – křehké, šedobílé krystaly, struktura diamantu – Podobná elektrická rezistivita k Si, ale menší šířka zakázaného pásu • Sn – – • Pb nejvíce stabilních izotopů – 10 - (119 Sn NMR, Mössbauer) β-Sn bílý, tetragonální α-Sn šedý, kubický, diamantová struktura teplota transformace 13, 2 °C, vyžaduje dlouhou expozici, tzv. cínový mor, změna hustoty o 26 %, distorze podel osy c (Ge a Si vykazují podobnou vlastnost, ale až při tlacích 20 Gpa, změna hustoty od 25%) – modrošedý kujný kov

Chemická reaktivita • Ge – – – reaktivnější (elektropozitivnější) než Si, pasivace Ge. O 2 rozpouští se pomalu v horké koncentrované H 2 SO 4 a HNO 3 s vodou ani hydroxidy (v přítomnosti oxidačních činidel ano) při 250 °C se pomalu oxiduje na Ge. O 2 (v parách síry → Ge. S 2)) mírné zahřívání • Cl 2, Br 2 → Ge. X 4 • HCl → Ge. Cl 4, Ce. HCl 3 (+ H 2) • alkylhalogenidy → organogermaničité sl.

Chemická reaktivita • Sn – – – za normální teploty stálý (vzduch i voda) s horkou vodní parou se oxiduje → Sn. O 2 (+ H 2) se zředěnými HCl či H 2 SO 4 nereaguje Sn + HNO 3 →Sn(NO 3)2 + NH 4 NO 3 s horkou HCl → Sn. Cl 2 (+H 2) s horkou H 2 SO 4 →Sn. SO 4 +Sn. O 2 s horými alkalickými hydroxidy nikoliv Sn. II, ale Sn. IV Sn + 2 KOH + 4 H 2 O → K 2[Sn(OH)6] + 2 H 2 s halogenidy Sn. X 4 se S či Se vzniká Sn. II či Sn. IV, podle stechiometrie s alkylhalogenidy: Sn + 2 RX → R 2 Sn. X 2 (+ Rn. Sn. X 4 -n) organocíničité sl.

Chemická reaktivita • Pb – poměrně chemicky stálé (pasivace vrstvou oxidu uhličitanu síranu či chloridu), jemný prach pyroforický – na vzduchu: 600 až 800°C → Pb. O – s H 2 SO 4 nereaguje (skladovací nádoby) – s HCl → Pb. Cl 2 (málo rozpoustný- pod 1%, probíhá pomalu) – s HNO 3 → Pb(NO 3)2 (velmi rozpustný 50 g na 100 ml , probíhá rychle) – halogeny • F 2 → Pb. F 2 (normální teplota) • Cl 2 → Pb. Cl 2 nutno zahřát

Chemická reaktivita • přechod od MIV k MII – účinek inertního páru – organoprvkové sl. výhradě Sn. IV a Pb. IV (jinak spíš kuriozity) • řetězení ve struktuře (viz Si) • nižší stabilita (MO 2) Ge-O-Ge, nejsou analoga silikonových polymerů • stereochemie – dvojmocné - přítonost volného el. páru – Sn. IV, sloučeniny s k. č. 5 či 6 – Sn, Pb – polyatomové klastrové anionty M 52 -, M 94 -

Hydridy • Ge germany Gen. H 2 n+2 (n= 1 -5) bezbervé těkavé kapaliny eventuálně plyny Ge. O 2 + Na. BH 4 event. Ge. Cl 4 + Li. Al. H 4 v reaktivitě podobné silanům (méně těkavé, méně aktivní, Ge. H 4 na vzduchu „ani“ nevzplane (na rozdíl od Si. H 4 či Sn. H 4), nereaguje asi se zřeď. kys. ani 30% hydroxdy – Lewisova kyselina Ge. H 4 + NH 3 → NH 4 -Ge. H 3+ – NH 4 -Ge. H 3+ + M(alk. ) → MGe. H 3 (bílé, kryst. , pro další syntézy) – vyšší germany – tichý elektrický výboj v Ge. H 4 (Si. H 4+ Ge. H 4 → Si. H 3 Ge. H 3) – cyklické ani nenasycené nepřipraveny – Halogengermany – Ge (Ge. X 2, Ge. H 4) + HX → Ge. Hn. X 4 -n (X= Cl, Br, I) (další synt. ) – fosfinogermany Rn. Ge(PH 2)4 -n – – –

Hydridy • Sn – – – – • Pb – – – méně stálé binární hydridy Sn. Cl 4 + Li. Al. H 4 → Sn. H 4 Sn. Cl 2 + Na. BH 4 → Sn. H 4, plyn, rozkládá se pomalu na Sn a H 2 Sn 2 H 6, distannan, nejvyšší, ještě méně stálý alkylované stannany, mnohem stabilnější termolýza Ph 2 Sn. H 2 → H(Ph 2 Sn)6 H příprava alkylstannanů redukcí odpovídajícího organocíničitého chloridu pomocí Li. Al. H 4 Pb. H 4 plumban, hypotetická záležitost, nebyl detekován alkylderiváty stálejší, příprava redukcí odpovídajících halogenidů pomocí Li. Al. H 4 eventuálně výměnou s organocíničitými sl. Bun 3 Pb. X + Ph 3 Sn. H → Bun 3 Pb. H + Pb 3 Sn. X Me 3 Pb. H (t. r. -30°C) a Et 3 Pb. H (t. r. -20°C) se snadno adují na alkeny (alkyny) za vzniku stabilních tetraalkylolovičitých sl. (hydroplumbace)
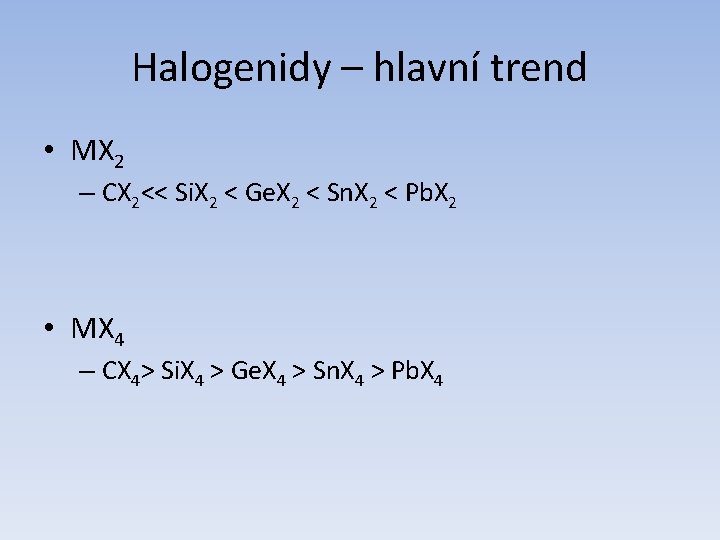
Halogenidy – hlavní trend • MX 2 – CX 2<< Si. X 2 < Ge. X 2 < Sn. X 2 < Pb. X 2 • MX 4 – CX 4> Si. X 4 > Ge. X 4 > Sn. X 4 > Pb. X 4

Halogenidy Ge • Ge. X 2 – Ge. F 4 + Ge → 2 Ge. F 2 (150 – 300 °C) – Si. HCl 3 → Ge. Cl 2 /světle žlutý/ + HCl (70°C) • • Ge. Cl 2 1000°C vak, disproporcionace (Ge. Cl 4 + Ge) + Br 2 (20 °C) → Ge. Br 2 Cl 2 + Cl 2 (20 °C) → Ge. Cl 4 (+ H 2, 800°C → Ge. Cl 2) + H 2 O → Ge(OH)2 /žlutý/ (+teplo)→ Ge. O /hnědý/ – Ge. Br 2 – analogické – Ge. I 4 + H 3 PO 2 (+HI) → Ge. I 2 /jasně oranžový/ – Zajímavé koordinační vlastnosti (organoprvky) • Ge. X 4 • Ge. I 2+ Hacac → [Ge(acac)I] + HI (k. č. 3, Ge lomená molekula) • Ge. I 2 + C 2 H 2 → dimer – šestičetný dienový heterocyklus – HX (aq) + Ge. O 2 → Ge. X 4 (bezbarvé, těkavé kapaliny, Ge. I 4 pevná, oranžová látka) – Všechny hydrolyzují – Ge. Cl 4 – prekurzor organogermaničitých sl.

Halogenidy Sn • Sn. X 2 – Sn. II stereochemie značně složitá • • Zvyšování k. č. Sn. II polymerací do cyklů či řetězců přítomnost nevazebného elektronového páru asymetrické ionty Deformace 5 s 2 orbitalu volným el. párem Lewisovské adukty Sn. X 2∙NMe 3 (X = Cl, Br, I) Dvojité adukty BF 3 { Sn. X 2( NMe 3)} Ve vodných roztocích pyramidální [Sn. X 3]- polyanionty X = F, Cl, Br Polyanionty [Sn. X 3]∞∞- - tetragonální pyramidy (vrchol – volný el. pár Sn) spojené do lineárního řetězce přes dva protilehlé atomy fluoru v základně – Sn. O + HF (40% aq) → Sn. F 2 (tetramery Sn 4 F 8, velmi deformované oktaedry{Sn. F 6}) Fluoristan™ – zubní pasty – Sn. X 2 - stálé, krystalické látky (body tání v rozmezí 200 -300 °C) – Tvorba aduktů, hydrátů… • Sn. X 4 – Jednodušší struktury – Sn. Cl 4 + HF (bezvodý) → Sn. F 4 (krystalický, silně hygroskopický) • Polymerní struktura, planární vrstvy – sdílení ekvatoriálních F v oktaedru “Sn. F 6“ – Sn. X 4 (X = Cl, Br, I) “nezajímavé“ těkavé kapaliny, hydrolyzují – Komplexy [LSn. X 4] k. č. 5 a [L 2 Sn. X 4] k. č. 6

Halogenidy Pb • Pb. X 2 – – Stabilní, ve vodě krystalické nerozpustné látky Příprava vysrážením z vodných roztoků Pb. II pomocí HX Pb. Cl 2 a Pb. Br 2 fotolyzují (UV-vis), vyluřuje se Pb 0 Halogenkomplexy M 4[Pb. Cl 6] • Pb. X 4 – Jediným stálým Pb. F 4 – Pb. Cl 4 se rozkládá při 50 °C – Stabilizace koordinací M 2[Pb. Cl 6] M= Na, K, Rb, Cs, NH 4

Oxidy a hydroxidy • Ge – – – Ge + Ge. O 2 → 2 Ge. O (1000 °C) /žlutý/ Ge(OH)2 → Ge. O + H 2 O Zahříváním lze připravit hnědý Ge. O – redukční vlastnosti, nad 700 °C tendence disproporcionovat Ge. O 2 nápadná podobnost Si. O 2 • K. č. 4 analoga β-křemene, skelný Ge. O 2 – tavené sklo • Ge-analogy křemičitanů a hlinitokřemičitanů

Oxidy a hydroxidy • Sn – Sn. O – nejběžnější modročerná tetragonální modifikace - příprava alkalickou hydrolýzou cínatých solí – Červený Sn. O – zahřátí bílého, hydratovaného oxidu – Při 300°C obě oxidují na Sn. O 2 (bez přítomnosti vzduchu disproporcionují) – Amfoterní vlastnosti • v kyslinách → cínaté sole • v hydroxidech → pyramidální anionty [Sn(OH)3]- → klastrové struktury [Sn 6 O 8 H 4] – Me 3 Sn. OH + Sn. Cl 2 → Sn(OH)2 + Me 3 Sn. Cl – Sn. O 2 – hlavní cínová ruda v kyselinách a zřeď. hydroxidech se nerozpouští v roztavených hydroxidech M 2[Sn(OH)6] tepelnou dehydratací cíničitany (K 2 Sn. O 3 ∙ 3 H 2 O → K 2 Sn. O 3, K 4 Sn. O 4, K 2 Sn 3 O 7) K 2 Sn. O 3 Sn. IV k. č. 5, sdílení hran tetragonáních pyramid součást pigmentů, glazur a emailů, tvrzení skla (potahování Sn. Cl 4, které vytvoří transparentní film Sn. O 2), izolace oken (propouští vis, odráží IR…) • heterogenní katalyzátory Sn – V (event Sn – Sb) • • • – Sn(OH)2 přirpaven, Sn(OH)4 nikoliv

Oxidy a hydroxidy • Pb. O – – – • červený, tetragonální „klejt“ žlutý, stálý nad 488 °C, orthorombický „masikot“ 2 Pb (l) + O 2 → Pb. O (600 °C) rozpouští se v kyselinách i hydroxidech alk. kovů výroba skla (vysoký obsah Pb) – lesk, odolnost, tvrdost akumulátory (černý oxid Pb + Pb. O) Pb 3 O 4 – směsný oxid Pb. O∙Pb. O 2, „suřík“, „minium“ – Pb. O + O 2 → Pb. O 2 – antikorozní základová nátěrová hmota, pigment • Pb. O 2 černý, hnědý – Pb. O 2 → (293 °C) Pb 12 O 19 → (351 °C) Pb 12 O 17 → (374 °C) Pb 3 O 4 → (605 °C) Pb. O + H 2 SO 4 → Pb. SO 4 + HNO 3 → Pb(NO 3)2 + HCl → Pb. Cl 4 – silné oxidační činidlo (in situ v akumulátorech) – zápalky, pyrotechnika – vytvrzovací činidlo (kaučuky a plasty) • hydroxid Pb(OH)2 netvoří – hydroxykomplexy [Pb 6 O(OH)6]4+, klastr 3 tetraedrusdílejících stěny

Deriváty oxokyselin • • soli Ge většinou nestálé – Ge(OAc)4, Ge(SO 4)2 Sn. II – Sn 3(PO)4, Sn. HPO 4, Sn 2 P 2 O 7, Sn(PO 3)2… – Cu. SO 4 + Sn → Sn. SO 4 + Cu Sn. IV – Sn 2 O(PO 4)2, Sn 2 O(PO 4)2∙ 10 H 2 O, Sn. P 4 O 7, KSn(PO 4)3… – Sn(NO 3)4, Sn(SO 4)2∙ 2 H 2 O Pb – většinou Pb. II, ale známé i Pb. IV – – • Pb(OAc)4 ox. činidlo • Pb(SO 4)2 Pb. SO 4 – prakticky nerozpustný /vážkové stanovení Pb/ Pb. CO 3 – nerozpustný (minerál cerussit) Pb(NO 3)2 – velmi rozpustný Pb(OAc)2 doslazování vína

Další anorganické sloučeniny • • pseudohalogenidy chalkogenidy- S, Se, Te – Pb. II, Sn. II – kubická strutkura Na. Cl • Pb. S – fotoelektrická vodivost – vynikající detektor infračerveného záření – fotočlánky • klastry – kov-kov: především Sn, v omezené míře i Pb – aniontové klastry připravené s kryptandy (Ge, Sn, Pb) • KGe + kryptand → [K(crypt)]66+[Ge 9]2 -[Ge 9]4 - – oxopolyanionty [Pb 6 O(OH)6]4+ • organokovy – organociničité sl. • Stilleho reakce – organoolovičité sl. • Antidetonační aditiva

• Děkuji za pozornost