KELIMPAHAN UNSUR DAN SIFATNYA Download file ppt yang












- Slides: 20

KELIMPAHAN UNSUR DAN SIFATNYA Download file ppt yang lainnya di: http: //materikimia. com/category/ebooks/

Unsur-unsur golongan utama dan transisi

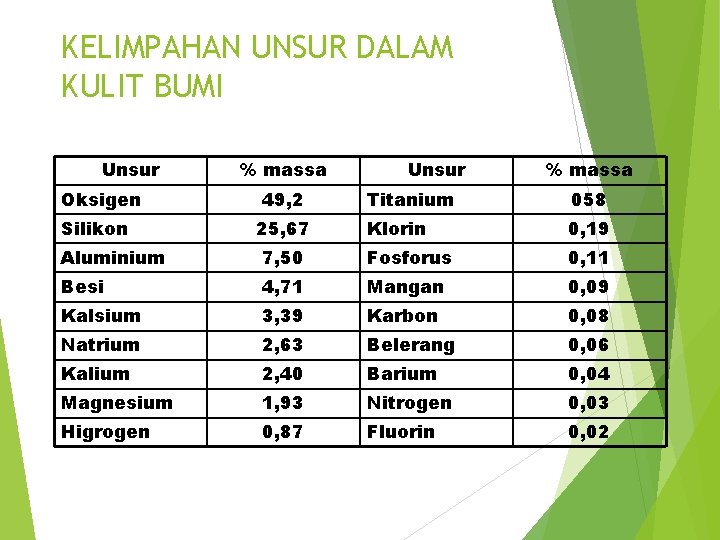
KELIMPAHAN UNSUR DALAM KULIT BUMI Unsur Oksigen Silikon % massa 49, 2 25, 67 Unsur % massa Titanium 058 Klorin 0, 19 Aluminium 7, 50 Fosforus 0, 11 Besi 4, 71 Mangan 0, 09 Kalsium 3, 39 Karbon 0, 08 Natrium 2, 63 Belerang 0, 06 Kalium 2, 40 Barium 0, 04 Magnesium 1, 93 Nitrogen 0, 03 Higrogen 0, 87 Fluorin 0, 02

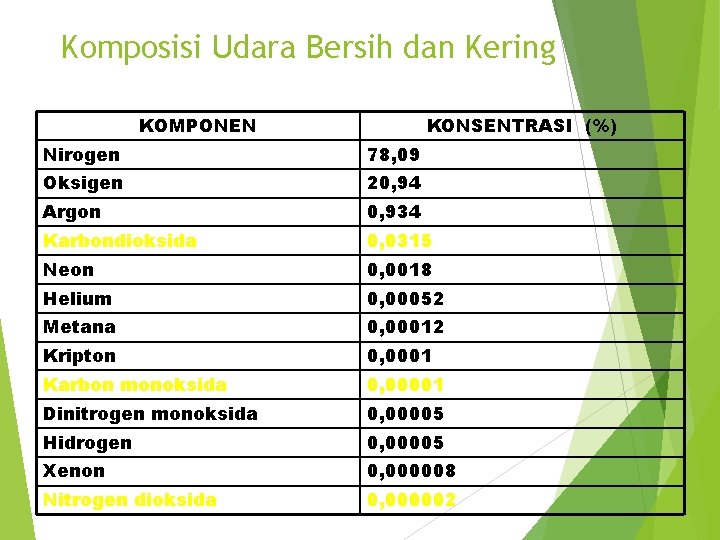
Komposisi Udara Bersih dan Kering KOMPONEN KONSENTRASI (%) Nirogen 78, 09 Oksigen 20, 94 Argon 0, 934 Karbondioksida 0, 0315 Neon 0, 0018 Helium 0, 00052 Metana 0, 00012 Kripton 0, 0001 Karbon monoksida 0, 00001 Dinitrogen monoksida 0, 00005 Hidrogen 0, 00005 Xenon 0, 000008 Nitrogen dioksida 0, 000002

SEBAGIAN BESAR UNSUR DI ALAM BERADA DALAM BENTUK SENYAWA OKSIDA, SULFAT, POSPAT, KARBONAT, HALIDA DAN SILIKAT DAN SEBAGIAN KECIL BERADA DI ALAM DALAM KEADAAN BEBAS


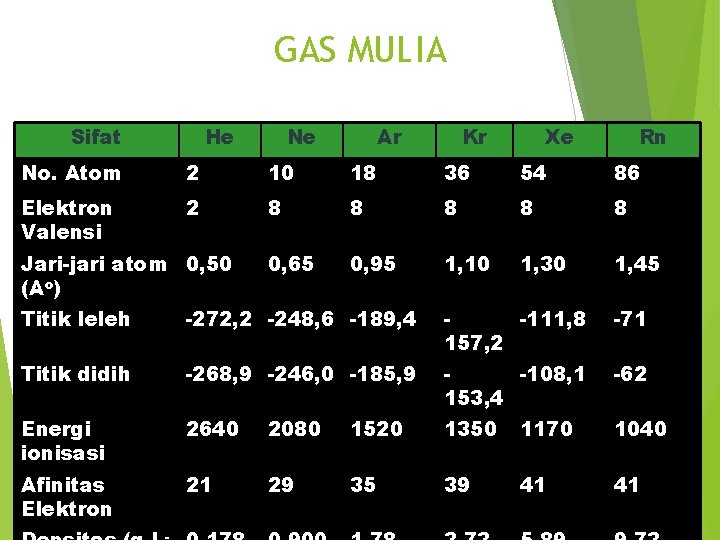
GAS MULIA Sifat He Ne Ar Kr Xe Rn No. Atom 2 10 18 36 54 86 Elektron Valensi 2 8 8 8 0, 65 0, 95 1, 10 1, 30 1, 45 Jari-jari atom 0, 50 (Ao) Titik leleh -272, 2 -248, 6 -189, 4 -111, 8 157, 2 -71 Titik didih -268, 9 -246, 0 -185, 9 -108, 1 153, 4 -62 Energi ionisasi 2640 2080 1520 1350 1170 1040 Afinitas Elektron 21 29 35 39 41 41

Gas Mulia Mengapa gas Mulia sukar bereaksi (stabil) ? Mengapa titik leleh dan titik didih gas mulia sangat rendah ? Berdasarkan literatur, mengapa hanya Kr dan Xe saja yang dapat disintesa senyawanya ? , dan sebutkan contoh senyawanya ! Tentukan jenis hibridisasi dan bentuk geometri molekul dari senyawa, Xe. F 4 Xe. O 2

HALOGEN F F Cl Cl Br Br I I


Daya Oksidasi Halogen dan Daya Reduksi Ion Halida Berdasarkan Harga Eo nya urutan daya oksidasi gas halogen F 2 > Cl 2 > Br 2 > I 2 Daya reduksi ion halidanya F- < Cl- < Br-< IDapatkah reaksi berikut berlangsung: Cl 2 + KBr Br- + I 2 F- + Cl 2

F 2 + + Cl 2 + Br 2 + I 2 Struktur molekul Halogen Bagaimana anda dapat menjelaskan kereaktifan gas-gas halogen berdasarkan harga energi ikatannya ? + +

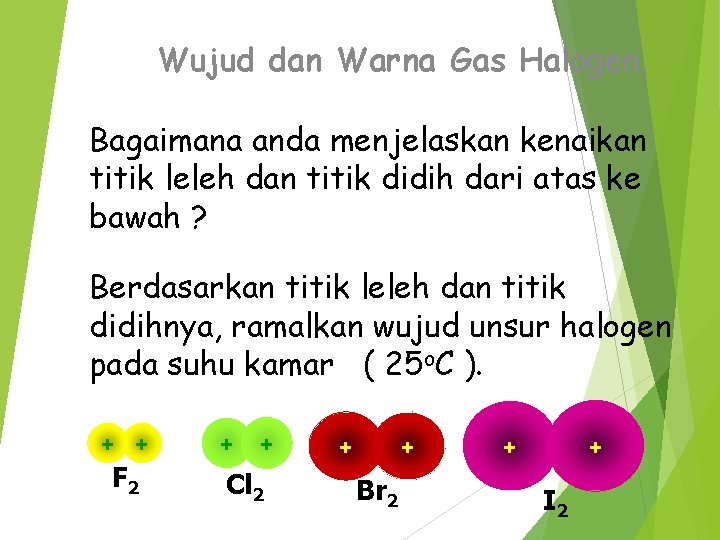
Wujud dan Warna Gas Halogen. Bagaimana anda menjelaskan kenaikan titik leleh dan titik didih dari atas ke bawah ? Berdasarkan titik leleh dan titik didihnya, ramalkan wujud unsur halogen pada suhu kamar ( 25 o. C ). + + F 2 + + Cl 2 + + Br 2 + + I 2

Kelarutan Halogen dalam air Halogen adalah senyawa non polar yang berarti tidak larut dalam air. Berarti hanya larut dalam pelarut Organik/ non polar. (CCl 4) Bila halogen laru tdalam air, itu karena halogen bereaksi dengan air. 2 F 2 + 2 H 2 O 4 HF + O 2 Cl 2 , Br 2 dan I 2 sukar larut dalam air. I 2 mudah larut dalam larutan KI, karena akan membentuk ion poli iodida. I 2 + I - I 3 -

Kereaktifan unsur Halogen Keraktifan unsur halogen (non logam) dapat dilihat dari harga Avinitas elektron atau keelektronegatifannya. Halogen hampir dapat bereaksi dengan semua unsur. a. Dengan Gas Hidrogen. H 2 + X 2 2 HX b. Dengan unsur logam. 2 M + n. X 2 2 MXn

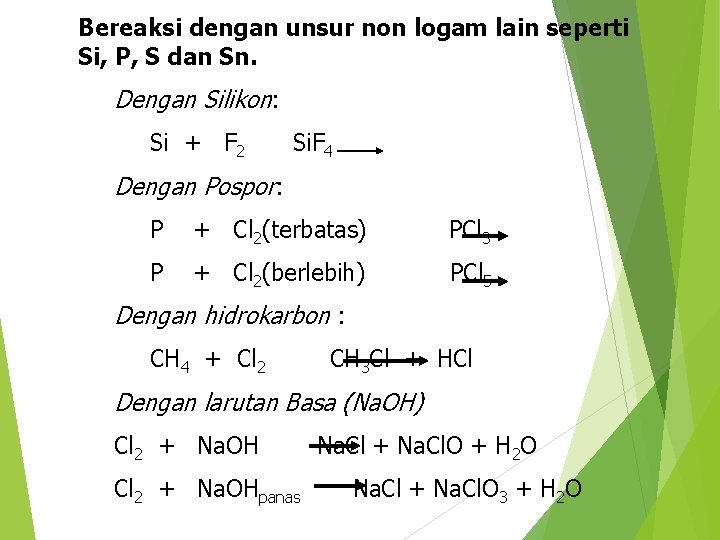
Bereaksi dengan unsur non logam lain seperti Si, P, S dan Sn. Dengan Silikon: Si + F 2 Si. F 4 Dengan Pospor: P + Cl 2(terbatas) PCl 3 P + Cl 2(berlebih) PCl 5 Dengan hidrokarbon : CH 4 + Cl 2 CH 3 Cl + HCl Dengan larutan Basa (Na. OH) Cl 2 + Na. OHpanas Na. Cl + Na. Cl. O + H 2 O Na. Cl + Na. Cl. O 3 + H 2 O

Halogen dapat memiliki bil. Oksidasi -1 s/d +7 Bilok Nama Fluor Clor Brom Iod -1 Halida HF HCl HBr HI 0 Unsur F 2 Cl 2 Br 2 I 2 +1 Hipoha lit - Cl. O- Br. O- IO- +3 Halit - Cl. O 2 - Br. O 2 - IO 2 - +5 Halat - Cl. O 3 - Br. O 3 - IO 3 - +7 Perhal at - Cl. O 4 - Br. O 4 - IO 4 -

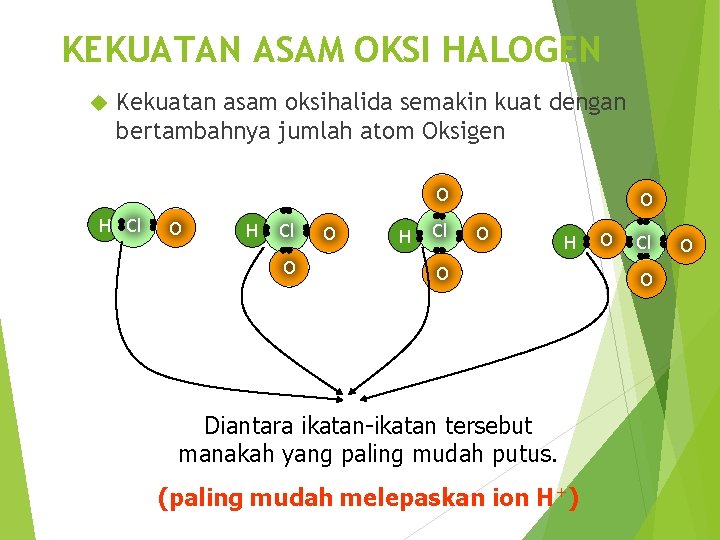
KEKUATAN ASAM OKSI HALOGEN Kekuatan asam oksihalida semakin kuat dengan bertambahnya jumlah atom Oksigen O H ׃ Cl O H ׃ Cl O O H ׃ O O Diantara ikatan-ikatan tersebut manakah yang paling mudah putus. (paling mudah melepaskan ion H+) Cl O O

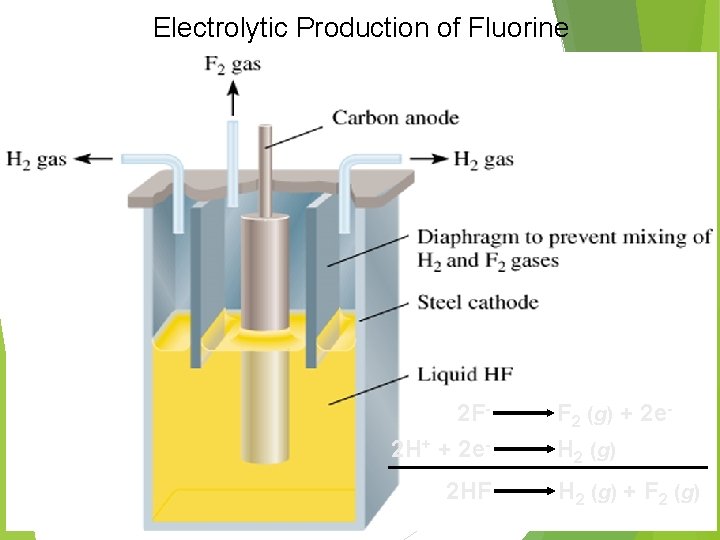
Electrolytic Production of Fluorine 2 F 2 H+ + 2 e 2 HF F 2 (g) + 2 e. H 2 (g) + F 2 (g)

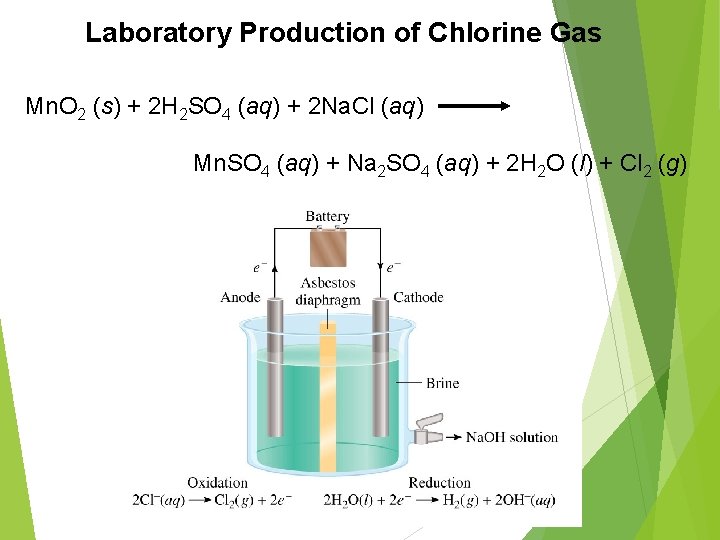
Laboratory Production of Chlorine Gas Mn. O 2 (s) + 2 H 2 SO 4 (aq) + 2 Na. Cl (aq) Mn. SO 4 (aq) + Na 2 SO 4 (aq) + 2 H 2 O (l) + Cl 2 (g)
 Lambang gas mulia
Lambang gas mulia Kelimpahan unsur di kulit bumi
Kelimpahan unsur di kulit bumi File-file yang dibuat oleh user pada jenis file di linux
File-file yang dibuat oleh user pada jenis file di linux Manfaat membangun tim yang dinamis
Manfaat membangun tim yang dinamis Pengertian cahaya dan optik
Pengertian cahaya dan optik Unsur penunjang kenaikan pangkat guru
Unsur penunjang kenaikan pangkat guru Sisi sisi pada balok dibatasi oleh
Sisi sisi pada balok dibatasi oleh Unsur-unsur dan ciri-ciri pertanian
Unsur-unsur dan ciri-ciri pertanian Sifat-sifat bangun ruang sisi datar
Sifat-sifat bangun ruang sisi datar Bagian bagian lingkaran
Bagian bagian lingkaran Suatu unsur netral memiliki 2 elektron dalam kulit pertama
Suatu unsur netral memiliki 2 elektron dalam kulit pertama Gambar yang sifatnya menerangkan
Gambar yang sifatnya menerangkan Komputer analog digunakan untuk data yang sifatnya
Komputer analog digunakan untuk data yang sifatnya Tujuan pemasangan poster di tempat umum adalah
Tujuan pemasangan poster di tempat umum adalah Untuk menarik simpati para tamunya rumah makan
Untuk menarik simpati para tamunya rumah makan Apakah pengertian wawasan nusantara
Apakah pengertian wawasan nusantara Unsur unsur negara secara klasik
Unsur unsur negara secara klasik Do re mi fa sol la si do c d e f
Do re mi fa sol la si do c d e f Unsur unsur logam
Unsur unsur logam Cengkorongan teks pranatacara
Cengkorongan teks pranatacara Tingkatan manajemen adalah
Tingkatan manajemen adalah