IV ENZMLERN ZELLKLER 1 Enzimler protein yapsnda maddelerdir






















- Slides: 34

IV. ENZİMLERİN ÖZELLİKLERİ 1. Enzimler protein yapısında maddelerdir: • Protein yapısına istisna olarak bazı RNA tipleri gösterilebilir. • Bunlar, fosfodiester bağlarının yıkımı ve sentezi esnasında enzim gibi davranabilirler. Katalitik etkiye sahip RNA’ya Ribozim denir. ØEnzimler kolaylıkla denatürasyona uğrarlar: Denatürasyon, proteinlerin doğal yapılarının bozulması sonucunda aktivitelerinin kaybolmasıdır. Enzim denatüre olduğunda aktif bölgesi de denatürasyona uğrayarak substratını bağlayamaz, bundan dolayı da etkili olamaz.

Başlıca denatürasyona yol açan faktörler: § Isı § § § Işınlar (X ışınları, UV ışınları, vs) Çalkalama Dondurup eritme Derişik asid ve baz Alkol, eter, benzen, vs gibi organik çözücüler Üre, guanidin çözeltileri

2. Enzimler özgül moleküllerdir. Enzimler yalnız belirli reaksiyonları katalizledikleri ve sadece substratları ile etkileştiklerinden dolayı spesifik (özgül) maddelerdir. 3. Enzimler katalitik etkinliğe sahiptir. §Enzimle katalizlenen reaksiyonların çoğu katalizlenmeyen reaksiyonlara göre 103 – 108 kere daha hızlı olarak gerçekleşmektedir. §Bir enzim molekülü saniyede ortalama 100 -1000 substrat molekülünün ürüne dönüşümünü sağlamaktadır.

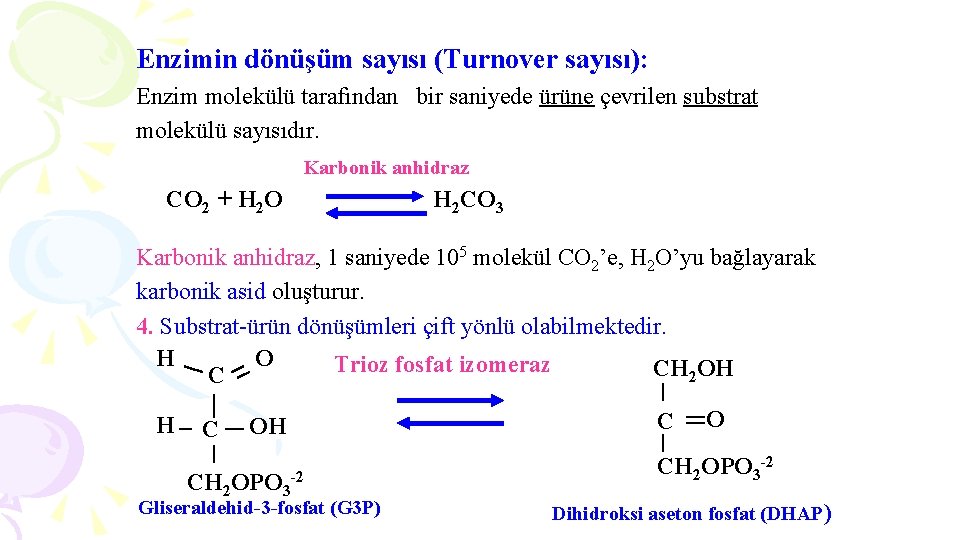
Enzimin dönüşüm sayısı (Turnover sayısı): Enzim molekülü tarafından bir saniyede ürüne çevrilen substrat molekülü sayısıdır. Karbonik anhidraz CO 2 + H 2 O H 2 CO 3 Karbonik anhidraz, 1 saniyede 105 molekül CO 2’e, H 2 O’yu bağlayarak karbonik asid oluşturur. 4. Substrat-ürün dönüşümleri çift yönlü olabilmektedir. H O Trioz fosfat izomeraz CH 2 OH CH 2 OPO 3 -2 Gliseraldehid-3 -fosfat (G 3 P) C O CH 2 OPO 3 -2 Dihidroksi aseton fosfat (DHAP)

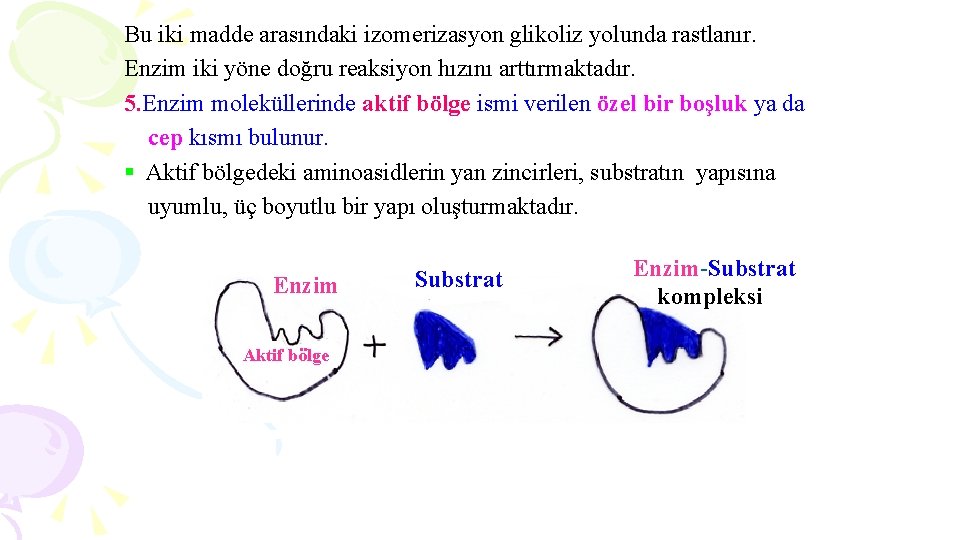
Bu iki madde arasındaki izomerizasyon glikoliz yolunda rastlanır. Enzim iki yöne doğru reaksiyon hızını arttırmaktadır. 5. Enzim moleküllerinde aktif bölge ismi verilen özel bir boşluk ya da cep kısmı bulunur. § Aktif bölgedeki aminoasidlerin yan zincirleri, substratın yapısına uyumlu, üç boyutlu bir yapı oluşturmaktadır. Enzim Aktif bölge Substrat Enzim-Substrat kompleksi

§Aktif bölgenin substratı bağlamasıyla oluşan enzim-substrat kompleksi (ES), önce enzim-ürün kompleksine, daha sonra ise serbest enzim ve ürüne dönüşmektedir. E+S ES EÜ E+Ü §Enzim ile substrat biribirlerine hidrojen, elektrostatik ve Van der Waals bağları gibi non kovalent (zayıf) bağlarla bağlanır. §Zayıf bağlar ve bazı kuvvetli bağlar, aktif bölgelerin aminoasidlerini biribirlerine yanaştırmada önemli rol oynarlar.

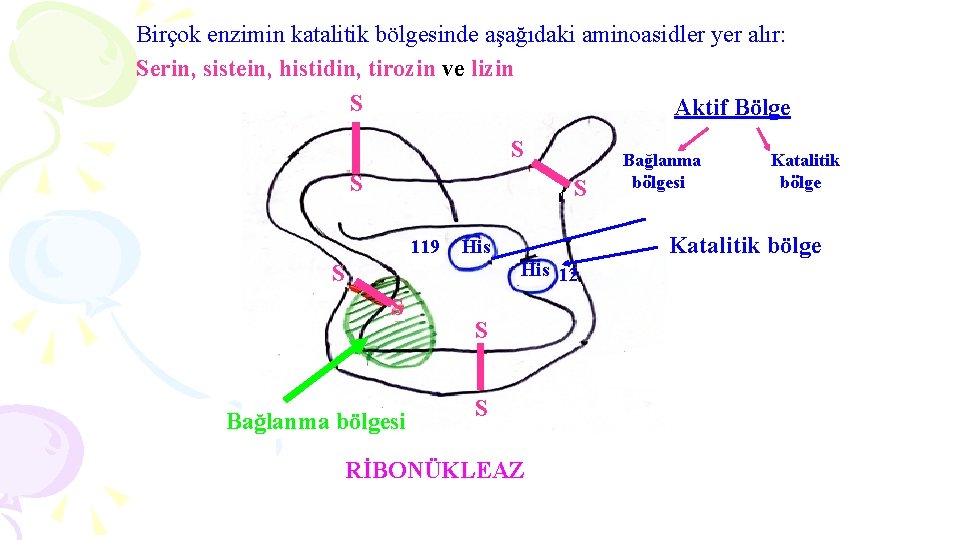
Birçok enzimin katalitik bölgesinde aşağıdaki aminoasidler yer alır: Serin, sistein, histidin, tirozin ve lizin S Aktif Bölge S S S 119 His 12 S S Bağlanma bölgesi S S RİBONÜKLEAZ Bağlanma bölgesi Katalitik bölge

RİBONÜKLEAZ: § Bu enzim RNA molekülündeki nukleotidleri hidroliz yapar. § Yapısı 4 disülfür bağı ile sağlamlaşmıştır. § Katalitik bölgede 2 histidin kalıntısı yer alır. Histidin 12 ve Histidin 119 § His 12, ribozun hidroksil grubu üzerine etki eder. § His 119, ise fosforil kısmına etkilidir. § Böylece molekülün 2 kısmından kırılma gerçekleşir. § Molekülün taranmış kısmı ise 5 aminoasidin yer aldığı bazik bir bölgedir. § Bu bölge RNA‘yı bağlar.

§ Enzimlerin substrat bağlama yeri olan aktif bölgedeki aminoasidler, substratın ürüne dönüşmesini sağlayan pek çok kimyasal mekanizmayı kullanır. § Bu aminoasidlerden bazıları substratın aktif merkeze bağlanmasını, bazıları ise kataliz olayını sağlamaktadır. § Aktif merkezde yer alan iki bölgeden birincisi bağlanma bölgesi, diğeri ise katalitik bölgeyi oluşturur.

Enzim ile substrat bağlanmasında iki model ileri sürülmektedir. 1. Model: Anahtar-kilit modeli 2. Model: Katalitik bölgenin “uyum oluşturma modeli”

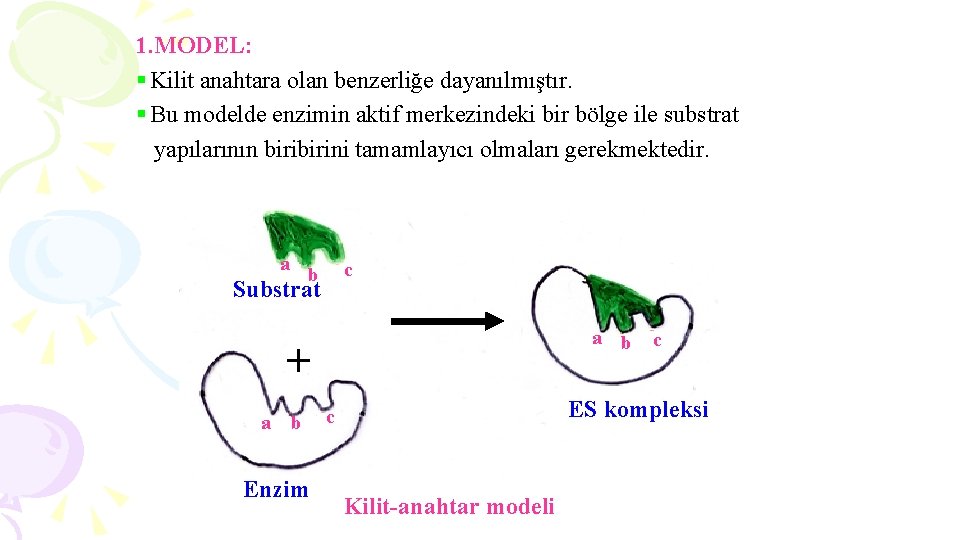
1. MODEL: § Kilit anahtara olan benzerliğe dayanılmıştır. § Bu modelde enzimin aktif merkezindeki bir bölge ile substrat yapılarının birini tamamlayıcı olmaları gerekmektedir. a c b Substrat a b + a b Enzim c ES kompleksi c Kilit-anahtar modeli

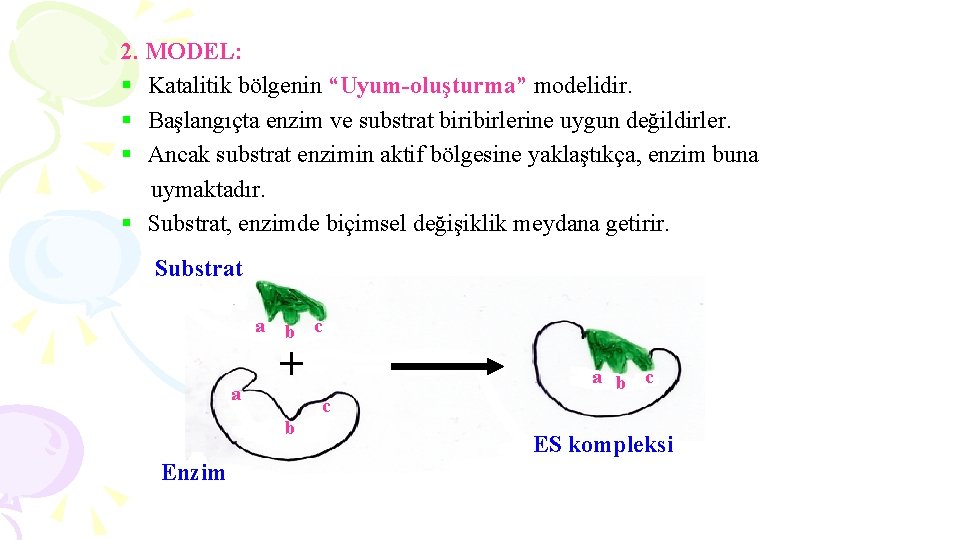
2. MODEL: § Katalitik bölgenin “Uyum-oluşturma” modelidir. § Başlangıçta enzim ve substrat biribirlerine uygun değildirler. § Ancak substrat enzimin aktif bölgesine yaklaştıkça, enzim buna uymaktadır. § Substrat, enzimde biçimsel değişiklik meydana getirir. Substrat a b c a + c b Enzim a b c ES kompleksi

6. Bazı enzimler, enzimatik reaksiyon için gerekli olan bir non-protein Prostetik grup ile birleşirler. § Sıklıkla karşılan prostetik gruplar arasında metal iyonlarına (Zn 2+, Fe 2+, Cu 2+, Mn+2 …vs) kofaktörler ve organik moleküllere ise koenzim adı verilir. § Genellikle vitamin türevleri (NAD+, FAD, Co. A. . gibi) yer alır. § Koenzimlerin pek çoğu genellikle B grubu vitaminlerden türevlenmektedir. § Kofaktörle birleşik durumda olan ve katalitik aktivite gösteren enzim holoenzim olarak bilinmektedir. § Holoenzimin protein kısmına apoenzim adı verilir. § Apoenzim kofaktörün yokluğunda biyolojik aktivite gösteremez.

Kofaktörlü bazı enzimler (metaloenzimler): Kofaktör Fe 2+ Cu 2+ Mg 2+ Mn 2+ Zn 2+ Mo 2+ Enzim Katalaz, peroksidaz Sitokrom oksidaz, tirozinaz Fosfohidrolaz, fosfotransferaz Arginaz Alkol dehidrogenaz Ksantin oksidaz

§ Metal iyonları substrat bağlanmasını ve katalizi kolaylaştırır. § Aşağıdaki 4 form da, metal iyonları ile katalizlenen enzimatik reaksiyonlar için geçerlidir. Enz S M Substrat-köprü kompleksi M Enz S Enzim-köprü kompleksi M Enz M S Metal-köprü kompleksi Enz S Siklik metal-köprü kompleksi

KOENZİMİ VİTAMİN OLAN BAZI ENZİMLER: Enzim Dekarboksilaz Vitamin B 1 vitamini (Tiamin) Koenzim Katalizlenen reaksiyon TPP (Tiamin pirofosfat) ………………. . . R-CO-COOH RCHO + CO 2 (Dekarboksilasyon) FMN(Flavin mononukleotid ve…………. . Hidrojen FAD Flavin adenin dinükleotid) transferi Dehidrogenaz B 2 vitamini (Riboflavin) Transaminaz B 6 vitamini (Pridoksal) Pridoksal fosfat Karboksilaz Biotin Transformilaz Folik asid THF……………… -CHO, -CH 2 OH, -CH 3 (Tetrahidrofolat) gruplarının transferi Transmetilaz İzomeraz B 12 vitamini Kobamid……………-CH 3 grubu transferi koenzim ………………. Amino asidlerden aldığı -NH 2 grubunu α-keto asidlere transfer eder. ……………α-keto asidlere CO 2 ‘i bağlar(Karboksilasyon)

7. Enzimler hücrenin metabolik gereksinimlerine uygun şekilde aktive veya inhibe edilerek ürün oluşum hızı kontrol edilebilir. Bu olaya enzim aktivitesinin düzenlenmesi denir. 8. Enzimler enerji türlerini birine dönüştürürler. § Mitokondrideki küçük moleküller içinde bulunan serbest enerji, ATP enerjisi şekline dönüşür. § Kasta ise ATP enerjisi, kasılma esnasında mekanik enerjiye dönüşür. 9. Enzimler tranzisyon (geçiş) durumunu stabilize ederek reaksiyonları hızlandırırlar. § Moleküllerin reaksiyona girebilmeleri için enerji tüketilmektedir. § Substrat ürüne dönüşürken tranzisyon (geçiş) durumundan geçer. S T* Ü

§ Tranzisyon durumu, S ve Ü’nün serbest enerjisinden çok daha yüksek enerjiye sahiptir. § Reaksiyon tranzisyon durumundan itibaren başlar. § Enerji düzeyinin tepe noktasında bulunan yüksek enerjili geçiş ürünleri daha sonra son ürüne dönüşmektedir. § Enzimlerin yokluğunda, tranzisyon durumuna ulaşabilen çok az sayıda molekül, ürüne dönüşebilmektedir. § Reaksiyon hızı ise, bu yüksek enerjiye sahip moleküllerin sayısı tarafından belirlenmektedir.

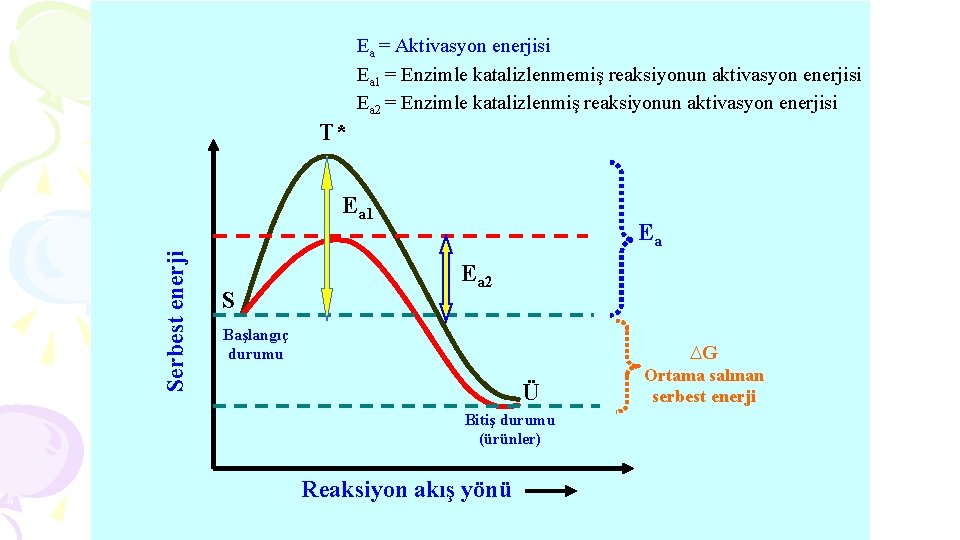
Ea = Aktivasyon enerjisi Ea 1 = Enzimle katalizlenmemiş reaksiyonun aktivasyon enerjisi Ea 2 = Enzimle katalizlenmiş reaksiyonun aktivasyon enerjisi T* Serbest enerji Ea 1 S Ea Ea 2 Başlangıç durumu ∆G Ü Bitiş durumu (ürünler) Reaksiyon akış yönü Ortama salınan serbest enerji

§ Bir kimyasal reaksiyon ortama enerji salıyor ise, tranzisyon durumuna geçebilmesi için, önce aktivasyon enerjisinden enerji borç alır, sonra bu enerjiyi sarfeder. § Sarfedilen enerjiden geri kalanı ise ortama serbest enerji şeklinde salınır. Ea= Tranzisyon durumu serbest enerjisi – substrat serbest enerjisi § Aktivasyon enerjisi düşük olan reaksiyonların hızı yüksek olmaktadır.

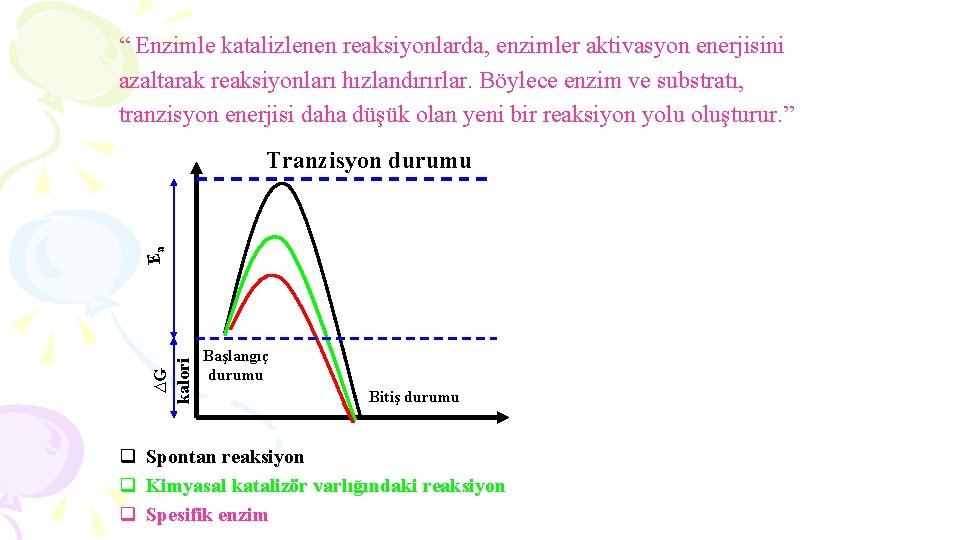
“ Enzimle katalizlenen reaksiyonlarda, enzimler aktivasyon enerjisini azaltarak reaksiyonları hızlandırırlar. Böylece enzim ve substratı, tranzisyon enerjisi daha düşük olan yeni bir reaksiyon yolu oluşturur. ” ∆G kalori Ea Tranzisyon durumu Başlangıç durumu Bitiş durumu q Spontan reaksiyon q Kimyasal katalizör varlığındaki reaksiyon q Spesifik enzim

V. ENZİMLERİN KATALİZ HIZINA ETKİ EDEN FAKTÖRLER Kataliz Hızı, birim zamanda oluşan ürün ya da kaybolan substrat miktarıdır. Enzimle katalizlenen reaksiyonların hızını etkileyen faktörler: 1. Enzim Konsantrasyonu 2. Substrat Konsantrasyonu 3. Sıcaklık 4. p. H

1. ENZİM KONSANTRASYONU Reaksiyon hızı § Enzimle katalizlenen reaksiyonlarda substrat konsantrasyonu yüksek miktarlarda ise, reaksiyonun başlangıç hızı (Vİ), enzim konsantrasyonu ile doğru orantılı olarak artmaktadır. Vİ Enzim konsantrasyonu

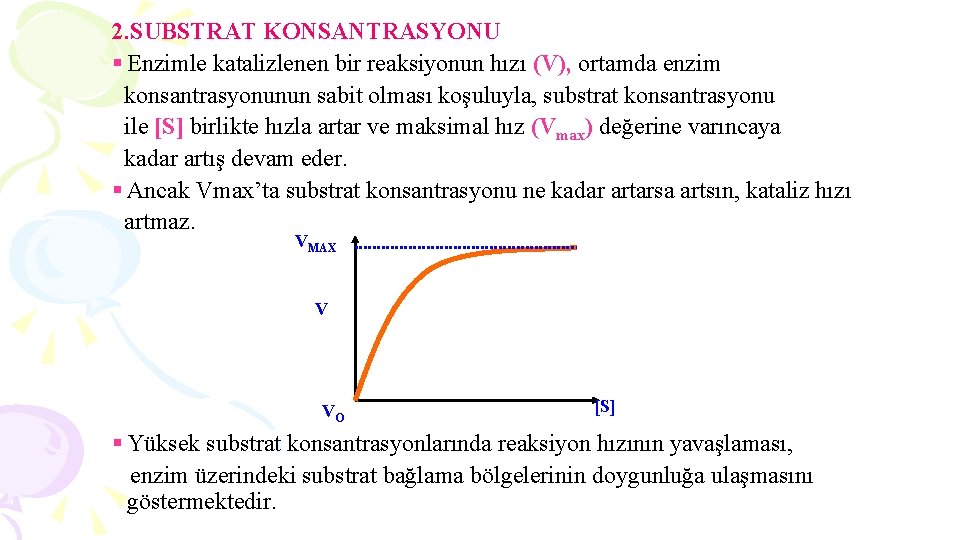
2. SUBSTRAT KONSANTRASYONU § Enzimle katalizlenen bir reaksiyonun hızı (V), ortamda enzim konsantrasyonunun sabit olması koşuluyla, substrat konsantrasyonu ile [S] birlikte hızla artar ve maksimal hız (Vmax) değerine varıncaya kadar artış devam eder. § Ancak Vmax’ta substrat konsantrasyonu ne kadar artarsa artsın, kataliz hızı artmaz. VMAX V VO [S] § Yüksek substrat konsantrasyonlarında reaksiyon hızının yavaşlaması, enzim üzerindeki substrat bağlama bölgelerinin doygunluğa ulaşmasını göstermektedir.

§ Enzimlerin çoğu Michaelis-Menten Kinetiği gösterirler. § Belli sıcaklıkta ve sabit enzim konsantrasyonunda, bu kinetiğe uyan enzimler, değişen substrat konsantrasyonu ile başlangıç hızı (VO) arasında hiperbolik bir eğri çizerler (A). § Buna karşılık allosterik enzimlerde, bu eğri sigmoidal özellik taşımaktadır (B). VMAX A B VO [S]

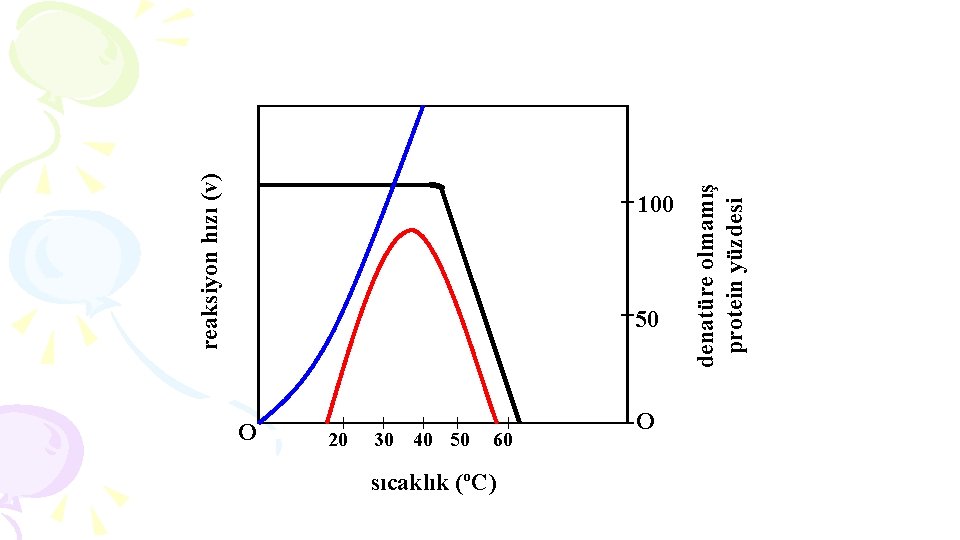
3. SICAKLIK § Kimyasal reaksiyonlarda ısının artması moleküllerin hareketini arttırarak reaksiyon hızının da artmasına yol açar. § Reaksiyon hızının sıcaklık ile artışı, belli bir enerji düzeyini aşabilecek molekül sayısı ile ilgilidir. § Bu durum, enzimlerle katalizlenen reaksiyonlar için de geçerlidir. “Enzimle katalizlenen bir reaksiyonda sıcaklığın yükselmesi reaksiyon hızını arttırmaktadır. ” Ancak enzimler protein yapısında maddeler olduklarından, belirli bir ısı derecesinden itibaren (genelde 45ºC) enzimin denatürasyonu söz konusu olacağından, reaksiyon hızında da bir azalma meydana gelecektir.

Optimum Temperatür (Sıcaklık): § Enzimin en yüksek aktivite gösterdiği sıcaklık derecesidir. § Bu sıcaklık derecesi, reaksiyon hızını maksimal arttırırken, daha ilerisinde enzimin denatürasyonuna yol açar. “Enzim etkinliği düşük ısıda az, tepe noktasında en fazla, sıcaklık arttığında ise hızla düşer. ” Genellikle, başlangıçta sıcaklığın her 10 ºC artışı, reaksiyon hızının iki katına çıkmasını sağlamaktadır.

reaksiyon hızı (v) 50 O 20 30 40 50 60 sıcaklık (ºC) O denatüre olmamış protein yüzdesi 100

Enzim aktivitesinde, optimum temperatür 2 faktörle belirlenmektedir (Kırmızı eğri). § Reaksiyon hızı, gerek spontan gerekse katalizör varlığında, sürekli olarak artar (mavi eğri). § Belirli bir ısı derecesinden sonra, enzim proteini denatüre olur (siyah eğri).

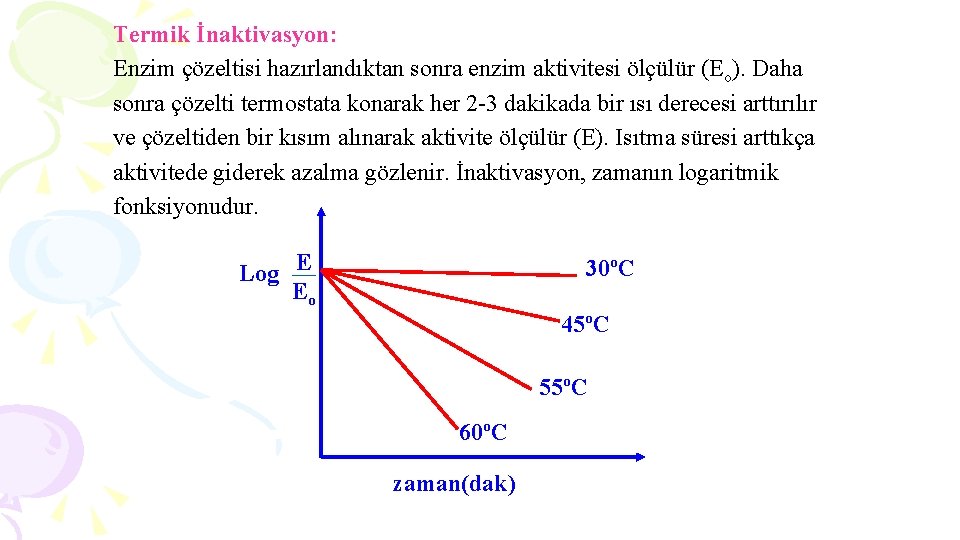
Termik İnaktivasyon: Enzim çözeltisi hazırlandıktan sonra enzim aktivitesi ölçülür (Eo). Daha sonra çözelti termostata konarak her 2 -3 dakikada bir ısı derecesi arttırılır ve çözeltiden bir kısım alınarak aktivite ölçülür (E). Isıtma süresi arttıkça aktivitede giderek azalma gözlenir. İnaktivasyon, zamanın logaritmik fonksiyonudur. Log E Eo 30ºC 45ºC 55ºC 60ºC zaman(dak)

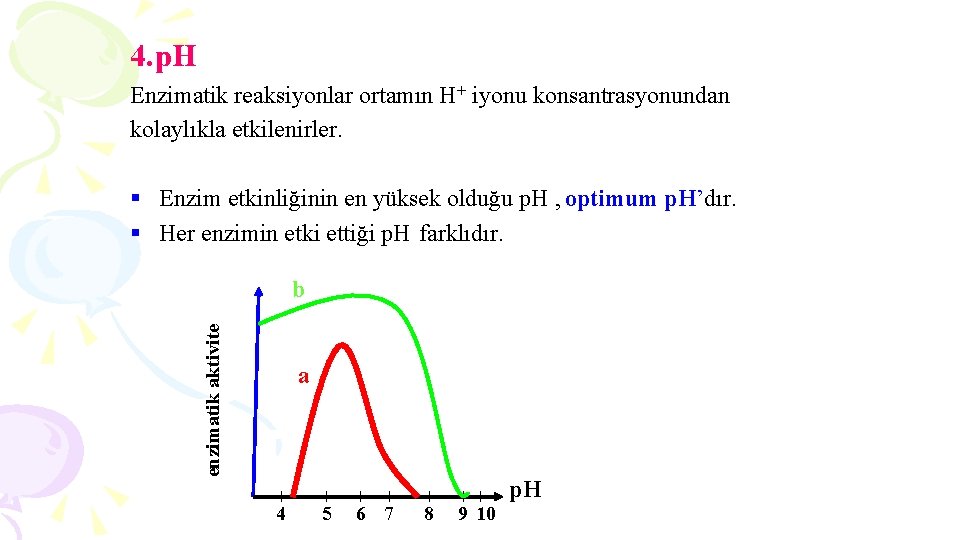
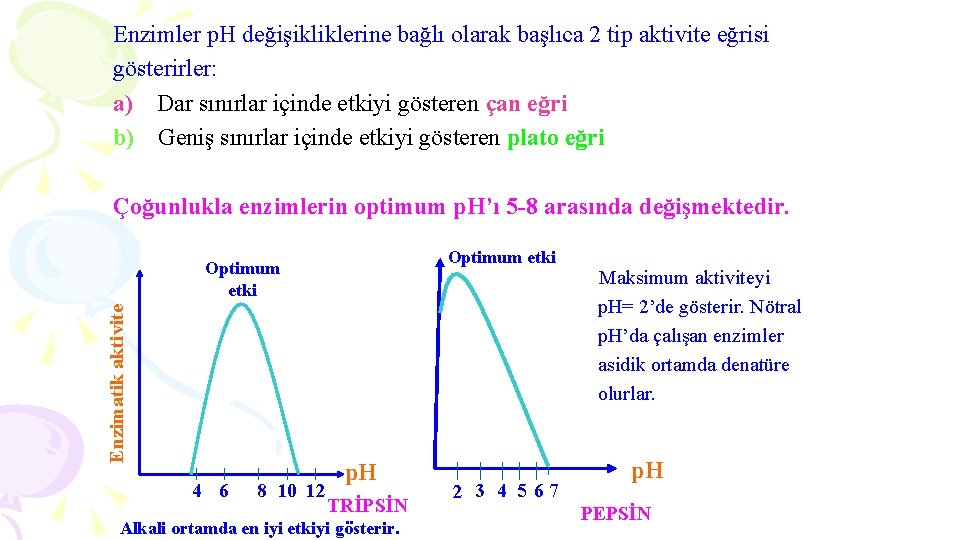
4. p. H Enzimatik reaksiyonlar ortamın H+ iyonu konsantrasyonundan kolaylıkla etkilenirler. § Enzim etkinliğinin en yüksek olduğu p. H , optimum p. H’dır. § Her enzimin etki ettiği p. H farklıdır. enzimatik aktivite b a 4 5 6 7 8 9 10 p. H

Enzimler p. H değişikliklerine bağlı olarak başlıca 2 tip aktivite eğrisi gösterirler: a) Dar sınırlar içinde etkiyi gösteren çan eğri b) Geniş sınırlar içinde etkiyi gösteren plato eğri Çoğunlukla enzimlerin optimum p. H’ı 5 -8 arasında değişmektedir. Optimum etki Enzimatik aktivite Optimum etki 4 6 8 10 12 p. H TRİPSİN Alkali ortamda en iyi etkiyi gösterir. 2 3 4 5 67 Maksimum aktiviteyi p. H= 2’de gösterir. Nötral p. H’da çalışan enzimler asidik ortamda denatüre olurlar. p. H PEPSİN

p. H değişikliklerinin enzimatik aktivite üzerindeki etkileri aşağıdaki faktörler tarafından belirlenmektedir. 1. Ortamın çok yüksek ve çok düşük p. H düzeyleri, enzimin denatürasyonuna yol açarak, yapısında geri dönüşümsüz değişiklikler yapar. 2. Apoenzim ile koenzim arasındaki bağlar etkilenir. 3. Bir protein olan enzimin yapısındaki amino ve karboksil gruplarının iyonizasyon durumu, ortamın p. H değerine bağlı olarak değişir. Aktif bölgedeki iyonizasyon değişikleri, enzim-substrat reaksiyonunu ve buna bağlı olarak katalizi bozar.

Örnek: Katalitik aktivite için ortamdan H+ iyonu kazanılması gerekiyor ise, moleküldeki amino gruplarının protonlaşması gibi: - NH 2 H+ -NH 3+ Alkali p. H ‘da proton kaybı olacağından, verilen örnekte enzimatik aktivite hızı düşer. 4. Büyük çoğunlukla p. H değişikliklerinden substratın da iyonizasyon durumu etkilenir.
 Enzimler
Enzimler Amonyağın karaciğere taşınması
Amonyağın karaciğere taşınması Hormonların çalışma mekanizması
Hormonların çalışma mekanizması Enzimler
Enzimler Biyokimya enzimler ders notları
Biyokimya enzimler ders notları Ekzopeptidaz enzimler
Ekzopeptidaz enzimler Zimojen aktivasyonu
Zimojen aktivasyonu Reversibl kovalent modifikasyon
Reversibl kovalent modifikasyon Mekanik ve kimyasal sindirim nedir
Mekanik ve kimyasal sindirim nedir Kas hastalıklarının tanısında yararlı enzimler
Kas hastalıklarının tanısında yararlı enzimler Enzimler
Enzimler Pvt tim hall
Pvt tim hall Pankreas enzimleri
Pankreas enzimleri Enzimler
Enzimler Protein-protein docking
Protein-protein docking Protein pump vs protein channel
Protein pump vs protein channel Protein processing
Protein processing Protein synthesis
Protein synthesis Pemisahan protein dengan etanol absolut
Pemisahan protein dengan etanol absolut Protein synthesis
Protein synthesis Aldehyde test for protein
Aldehyde test for protein Chapter 12 enzymes the protein catalyst
Chapter 12 enzymes the protein catalyst Bence jones protein ppt
Bence jones protein ppt Totipotent cells
Totipotent cells Digestion of protein by pepsin
Digestion of protein by pepsin What is this
What is this Protein ionization
Protein ionization Ascent protein coupon code
Ascent protein coupon code Struktur primer protein
Struktur primer protein Classify each as carbohydrate protein or lipid
Classify each as carbohydrate protein or lipid Science olympiad protein modeling
Science olympiad protein modeling Protein function
Protein function Nnn plant protein
Nnn plant protein What is protein
What is protein Enzyme vs protein
Enzyme vs protein