INFERENZA STATISTICA Processo di trasferimento dei risultati del






























- Slides: 33

INFERENZA STATISTICA Processo di trasferimento dei risultati del nostro campione al totale della popolazione.

INFERENZA=TRASFERIMENTO DI DATI INTERVALLO DI CONFIDENZA • Il processo di inferenza (trasferimento) da un campione alla popolazione non può mai essere assolutamente sicuro. • Alla fine dello studio dopo aver raccolto i dati e costruito la tabella 2 x 2 dobbiamo trasferire i risultati alla popolazione mediante calcoli statistici che ci possano indicare l’intervallo di confidenza=limiti di confidenza o i 2 valori entro i quali riteniamo stia il reale valore della popolazione. • Più è grande il campione studiato, più sarà preciso lo studio e minore sarà la possibilità di errore, i limiti di confidenza saranno più stretti.

Intervallo di confidenza • Fortemente dipendente dalle dimensioni del campione studiato • Sommando più gruppi di pazienti dello stesso studio l’ampiezza dell’IC si riduce

INTERVALLO DI CONFIDENZA o sicurezza • La sicurezza del nostro intervallo non è mai assoluta, ma relativa. Esiste sempre un margine di errore arbitrariamente fissato dalla comunità scientifica al 5% • Si è deciso per convenzione che durante il processo di inferenza è tollerabile un margine di errore del 5%. • Significa che i metodi statistici usati per calcolare i limiti di confidenza sono impostati per fornire un risultato esatto al 95%

INTERVALLO DI CONFIDENZA o IC • Misure di frequenza (incidenza di malattia in un certo tempo= rapporto tra malati nuovi e soggetti sani) e di associazione (quantificano l’associazione tra esposizione e malattia RR=rapporto tra incidenza di malattia tra esposti e non esposti, OR) sono accompagnate dai limiti di confidenza al 95% ovvero da 2 misure o valori, uno più basso e l’altro più alto, entro i quali è compreso “sicuramente al 95%” il valore vero della popolazione • Es. incidenza di tumore nel campione è del 5% (IC 95%: 3%7%), significa che il campione ha sviluppato il tumore il 5% dei soggetti, mentre la % di soggetti che sviluppano il tumore nella popolazione generale oscilla tra il 3 ed il 7%, cioè il valore vero è “sicuramente (al 95%)” compreso entro questi limiti di confidenza.

Probabilità statistica o p è ricavata da test statistici usati per calcolare i limiti di confidenza • Indica la probabilità che il risultato sia dovuto al caso. • Se la p < 0. 05 il margine di errore del nostro studio è < del 5% per cui si conclude che il risultato è statisticamente significativo perché è il margine di errore considerato tollerabile in medicina. • Se la p > 0. 05 significa che la probabilità che il risultato sia dovuto al caso è > del 5% e quindi non statisticamente significativo

Rischio relativo, probabilità e intervallo di confidenza • RR=0, 64 con p=0, 02 posso concludere che il risultato è statisticamente significativo ad es. il farmaco ha un effetto protettivo. • Se ho RR=0, 64 ma un p=0, 09 il risultato non è statisticamente significativo • I software statistici forniscono sia IC al 95% che la p; è bene dunque riportare anche i limiti di confidenza che rappresentano i 2 valori entro i quali sarà il RR o OR o incidenza etc…nella popolazione generale ovvero una stima quantitativa della precisione dello studio. Mentre la p fornisce solo una conclusione generale sui risultati dello studio.

SIGNIFICATIVITA’ STATISTICA • Più è grande il campione studiato e tanto più simili saranno i risultati rispetto ai valori reali della popolazione. Più sarà preciso lo studio e minore sarà la possibilità di errore, i limiti di confidenza saranno più stretti, cioè più vicini al valore di RR del campione. • Se prendessimo tutta la popolazione non avremmo bisogno di calcolare i limiti di confidenza, perché sapremmo quale è il valore reale

SIGNIFICATIVITA’ STATISTICA • Il fatto che un trial clinico non abbia differenza statisticamente significativa non vuol dire necessariamente che l’intervento sia privo di efficacia. Così i risultati possono essere: • 1) non esiste differenza • 2) non esiste differenza perché il campione esaminato è troppo piccolo (es. della streptochinasi negli infartuati che venne introdotta solo negli anni ottanta dopo averlo testato su 10. 000 pz convalidando la sua efficacia e non prima quando gli studi precenti avevano utilizzato campioni troppo piccoli) • 3) c’è una differenza tale per cui il trattamento non è efficace o addirittura meno efficace di quello classico

Intervallo di confidenza al 95% • I limiti di confidenza vanno riportati nello studio così come la p • Perché in questo modo quantifichiamo i risultati di ricerca mentre con la sola p potremmo essere tratti in inganno (es. per una questione di marketing). Es. nello studio di un determinato farmaco potrebbe essere statisticamente significativa la p (95% CI: 0, 63 -0, 99) con p=0. 046, ma con un IC tra 1 e 37%, per cui se l’efficacia potrebbe essere solo dell’ 1% il paziente potrebbe essere indotto a non comprarlo.

Intervallo di confidenza confidence interval CI

Studi di Review, Review sistematiche e Meta-analisi Sono studi che non portano dati nuovi, ma riassumono le evidenze scientifiche di un fattore di rischio o di un intervento sanitario già esistente nella letteratura. Sono stati dell’arte della ricerca scientifica in ogni settore condotti da esperti del campo.

Review tradizionali o narrative • Revisione da parte di esperti della materia che riassumono le conoscenze bibliografiche su un dato argomento. • Gli autori raccolgono tutte le informazioni disponibili leggendo un gran numero di articoli mediante l’uso dei motori di ricerca e di biblioteche online con o senza pagamento.

Vantaggi e Svantaggi delle Review • Forniscono un rapido ed ottimo aggiornamento • La ricerca può essere condotta ricercando articoli a discrezione dell’autore. • Pertanto risentono delle convinzioni di chi le scrive che saranno più orientati a sbilanciarsi su articoli che avvalorano le loro idee fino addirittura ad escludere quelli orientati in senso opposto. • Non sarà facile trovare review scritte da autori completamente neutrali.

Review sistematica systematic review • Tutti gli studi scientifici devono essere trovati e citati. Sia quelli positivi che quelli negativi. • Forniscono garanzie massime di obiettività

Associazione internazionale di studiosi Cochrane Collaboration • Privilegia solo Review sistematiche, comunque anche queste possono risentire del parere degli autori e seppur vero che dovrebbero riportare tutti gli studi esistenti sull’argomento, non sempre questo viene fatto per volontà o per impossibilità di reperire a volte tutti gli studi esistenti • Si pensi al periodo preinternet e a quanti articoli non sono sul web.

Fasi di una review sistematica • • • Protocollo di ricerca Criteri di inclusione ed esclusione Ricerca bibliografica complessiva e massimale Valutazione della qualità degli studi Riassunto critico dei risultati e conclusioni

Studi di Meta-Analisi meta-analysis • È una review sistematica, quindi è una ricerca bibliografica completa, cui fa seguito una accurata analisi statistica. • Si combinano i risultati degli studi in modo da ottenere un risultato unico. • Si capisce l’importanza di questi articoli che consentono al clinico di farsi in breve tempo un’opinione aggiornata sull’argomento leggendo uno o pochi articoli di meta-analisi e non tutti gli articoli presenti sull’argomento.

Studi di Meta-Analisi • È possibile rappresentare gli studi mediante tabelle semplificative, ma complete. • Su ogni riga sono riportati gli RCT = studi clinici randomizzati con il nome del 1° autore, segue l’anno di pubblicazione ed il numero di pazienti studiati (diviso in 2 gruppi). • Es. per la streptochinasi gli esposti ricevevano il trattamento tradizionale e il nuovo trattamento, i non esposti solo il tradizionale ed il placebo. • L’ouctome considerato era la mortalità nei gruppi.

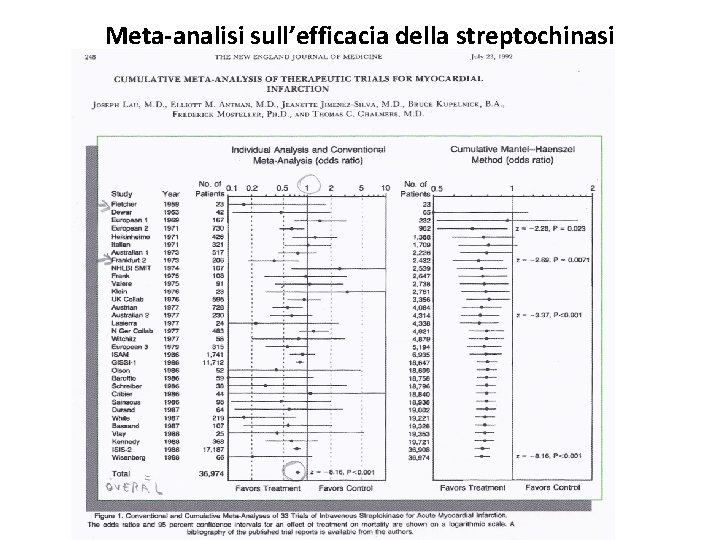
Meta-analisi sull’efficacia della streptochinasi

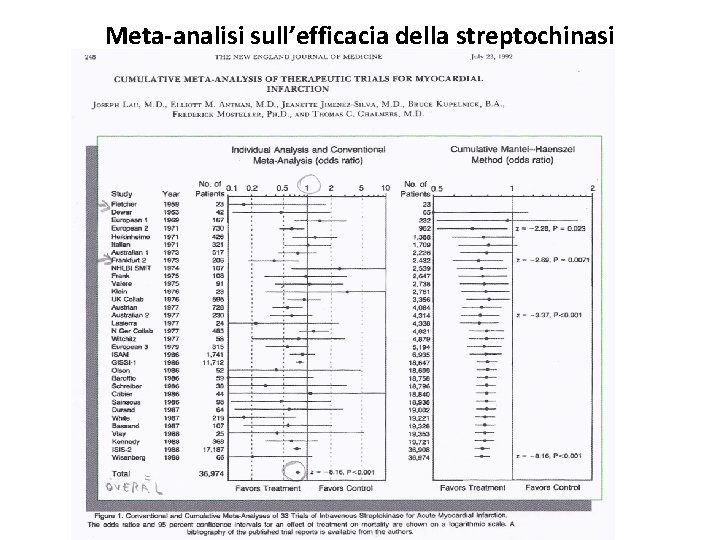
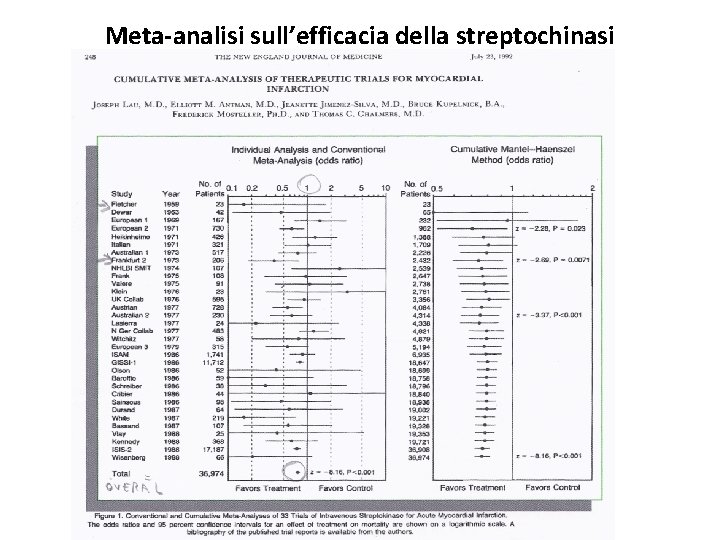
Rappresentazione di studi di meta-analisi: IV colonna La linea orizzontale rappresenta l’intervallo di confidenza al 95% ed il punto=Odds Ratio è la stima puntuale della misura di effetto considerato (OR=rapporto tra incidenza di esposti e non esposti). La linea verticale continua corrisponde al valore 1, per cui se l’Odds Ratio (puntino) si trova a sx della linea verticale significa che è < 1 e quindi la mortalità è < negli esposti, viceversa se è a dx la mortalità è < nei non esposti. Inoltre dobbiamo considerare se la linea orizzontale, ovvero l’IC 95%, di ogni studio contiene oppure no il valore 1; cioè se la linea verticale rimane al di fuori dell’IC 95% indica una differenza statisticamente significativa.

Meta-analisi sull’efficacia della streptochinasi

• Es. Fletcher nel 1959 con 29 pazienti • streptochinasi vs placebo. Mortalità è risultata più bassa negli esposti (OR<1), ma la differenza di mortalità non era statisticamente significativa (IC 95% contiene il valore 1).

tabella • Sono 33 RCT sulla streptochinasi, quasi tutti con OR<1, ma con un IC 95% che contiene il valore 1 per cui l’efficacia del trattamento non viene dimostrata in modo statisticamente significativo. • A fondo pagina troviamo TOTAL o OVERALL (complessivo) che è il risultato della combinazione statistica di tutti gli studi ovvero OR complessivo = media ponderata di tutti gli studi pesati in maniera proporzionale alla dimensione del campione reclutato.

Meta-analisi sull’efficacia della streptochinasi

tabella • Poiché il numero dei campioni, circa 37. 000, aumenta notevolmente combinando i vari studi insieme l’OR complessivo sarà < 1 e verrà così inequivocabilmente dimostrata la significatività statistica del trattamento utile con streptochinasi nei paz con infarto miocardico acuto. Al contrario dei vari studi singoli che avevano un IC contenente il valore 1.

tabella • La parte dx della TABELLA mostra la metaanalisi cumulativa effettuata ogni volta che si rende disponibile un nuovo RCT in ordine cronologico. • La seconda linea rappresenta la meta-analisi dei primi due, la terza linea la meta-analisi dei primi tre studi etc.

Esempio di meta-analisi

Fasi di meta-analisi • 1) Protocollo di ricerca riproducibile • 2) Criteri di inclusione ed esclusione; se possibile usare solo gli RCT • 3) Ricerca bibliografica • 4) valutazione qualitativa degli studi per eseguire una metaanalisi di elevata qualità • 5) Estrazione dei dati o outcomes riportati su tabelle 2 x 2 • 6) valutazione dei dati attraverso test statistici per sapere se sono combinabili tra loro. Da escludere se ci sono differenze sostanziali nei risultati. Es. 10 studi con RR=1, 8 ed altri 10 con RR=0, 5 • 7) Analisi di sensibilità …

Fasi di meta-analisi • 7) Analisi di sensibilità: • 7 A) Analisi statistica dei risultati di studi combinabili per arrivare ad un unico risultato complessivo=media ponderata dei risultati dei singoli studi con un peso maggiore assegnato a agli studi con maggiore numerosità campionaria. L’IC 95% sarà ovviamente più ristretto. • 7 B) Analisi stratificate se si sono utilizzati studi non RCT o studi di bassa qualità che come tali si diversificano da quelli randomizzati e di alta qualità e come tali non possono essere accumulati tra loro. Saranno così i vari studi analizzati a strati separati • 8) Interpretazione e commento dei risultati

Studi RCT di buona qualità devono riportare: -Data e luogo di studio -Criteri di inclusione -Verifica della dimensione del campione rappresentativa della popolaz -Dispersi al follow-up o espulsi (loro esclusione dall’analisi statistica) -Descrizione del trattamento e del placebo -Procedure e verifiche per il cieco e la randomizzazione -Verifica che tutti abbiano fatto il trattamento -Analisi statistica appropriata (negli studi osservazionali deve essere di tipo multivariato) -Calcolo dei limiti di confidenza e del valore di p per i principali outcomes -Discussione degli effetti collaterali -Analisi di sottogruppi -Conflitto di interessi; dichiarazione di Helsinki e consenso informato

Publication bias Studi più pubblicati sono quelli statisticamente significativi, quelli non significativi vengono erroneamente accantonati a meno che non coinvolgano un gran numero di campioni ed allora vengono pubblicati a prescindere dai risultati.

MEDICINA BASATA SULLE EVIDENZE dal 1830 con P. C. A. Louis nasce poi EBM fondata poi da Archibald Cochrane nel 1972 Tutte le azioni cliniche degli operatori sanitari devono essere fondate su solide evidenze scientifiche derivate da una ricerca epidemiologica di qualità, elevata e recente (Review) e dall’esperienza clinica personale x migliorare lo stato di salute del paziente mediante applicazione di: -accessibilità -equità -sicurezza -tempestività -appropriatezza -efficacia -efficienza -accettabilità (evitare l’accanimento terapeutico)