Impacto en Supervivencia de la Quimioterapia Adyuvante en





- Slides: 10

Impacto en Supervivencia de la Quimioterapia Adyuvante en Cáncer de Mama diagnosticado por Screening. Irene Zarcos-Pedrinaci 1, 6, Diego Pérez 1, Antonio Rueda 1, 6, Francisco Rivas-Ruíz 1, Elisabeth Pérez 1, 6, Mar Vernet 3, Rafael Fúnez 4, Francisco Medina-Cano 5, María Sala 2, Maximino Redondo 6. Agradecimientos a Javi Louro 2. 1. Medical Oncology Unit. Costa del Sol Hospital, Marbella. 2. Department of Epidemiology and Evaluation of Hospital del Mar, Barcelona. Red de Investigación en Servicios de Salud en Enfermedades Crónicas (REDISSEC), 3 Department of Surgery, Hospital del Mar, Barcelona. 4. Department of Pathology , Costa del Sol Hospital, Marbella 5 Department of Surgery, Costa del Sol Hospital, Marbella 6 Research Unit Costa del Sol Hospital. Marbella. Spain Red de Investigación en Servicios de Salud en Enfermedades Crónicas (REDISSEC). #SEOM 2017

Disclosure Information q Employment: Medical Oncologist. q Consultant or Advisory Role: No q Stock Ownership: No q Research Funding: This research was partially supported by grants from REDISSEC* (RD 12/0001/0010 and RD 16/0001/0006), Consejería de Salud Junta de Andalucía (298/16) and Fondo Europeo de Desarrollo Regional (FEDER). q Speaking: Diego Pérez Martín q Grant support: No q Other: No *Red de Investigación en Servicios de Salud en Enfermedades Crónicas #SEOM 2017

INTRODUCCIÓN Cáncer de mama diagnosticado por screening buen pronóstico (biología menos agresiva y mejor supervivencia). (Weaver et al 2006, Redondo et al, 2012) Tres grupos: Prevalentes diagnosticados en 1ª ronda, Incidentes en rondas subsiguientes y de Intervalo entre ronda y ronda a menudo por clínica manifiesta. Las guías clínicas actuales no consideran el método de detección a la hora de planificar el tratamiento adyuvante. El beneficio de esta quimioterapia adyuvante (QTa) en alguno de estos grupos es controvertido con efectos secundarios potenciales. Indice de Charlson (IC) Sistema de evaluación de la esperanza de vida a diez años, que depende de la edad y de las comorbilidades del sujeto. • Clasifica y puntúa 19 enfermedades asociadas a un paciente. • Validado y reconocido factor pronóstico independiente en diferentes tumores. • Existen pocos trabajos que incluyan en sus análisis esta variable. OBJETIVO • Analizar el beneficio en supervivencia de la QTa en cada grupo de cáncer de mama diagnosticado por screening, teniendo en cuenta la comorbilidad de las pacientes. #SEOM 2017

MÉTODOS Diseño Estudio de cohortes multicéntrico restrospectivo: H. Costa del Sol (Marbella) y H. del Mar (Barcelona). Población 4 programas nacionales de screening de cáncer de mama. Diagnosticadas e intervenidas de 2000 -2006. Seguimiento hasta 2014. Criterios de inclusión Diagnóstico anatomopatológico de cáncer de mama. Rango de edad entre 45 -69 años Criterios de exclusión Linfomas, Sarcomas. Estadíos IV y carcinomas localmente avanzados e inflamatorios. Pacientes que no hayan recibido quimioterapia por Variables contraindicación absoluta. Demográficas, clínicas, patológicas y relativas a la supervivencia (recurrencia, metástasis y muerte). Recogidas de la Hª Clínica. Análisis estadístico Análisis bivariado para valorar diferencias entre los 3 grupos, utilizando el test de T de Student para variables cuantitativas y test de Ji-Cuadrado para las cualitativas. Análisis de regresión de Cox, crudo y multivariante, para la estimación del riesgo de recaída y muerte. El análisis multivariante se ajustó por las variables: Grupos con o sin QTa; Estadio, Índice de Comorbilidad de Charlson (CCI). Supervivencias libre de recaída y global se estimaron por el me todo de Kaplan- Meier. #SEOM 2017

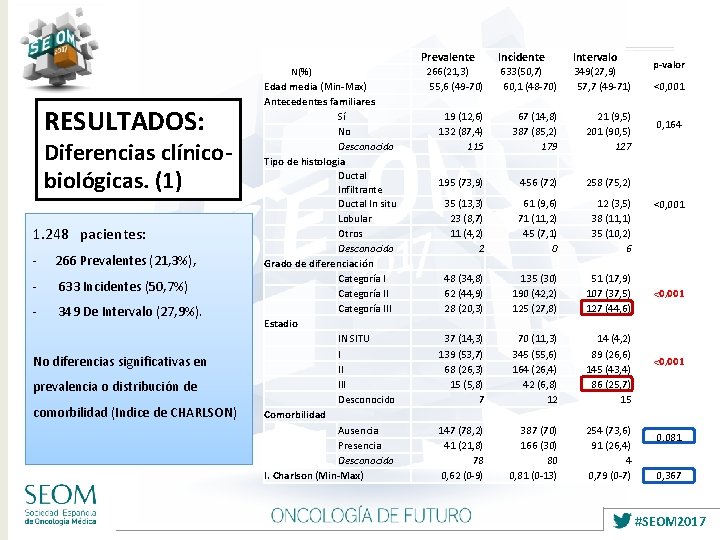
RESULTADOS: Diferencias clínicobiológicas. (1) 1. 248 pacientes: - 266 Prevalentes (21, 3%), - 633 Incidentes (50, 7%) - 349 De Intervalo (27, 9%). No diferencias significativas en prevalencia o distribución de comorbilidad (Indice de CHARLSON) N(%) Edad media (Min-Max) Antecedentes familiares Sí No Desconocido Tipo de histologia Ductal Infiltrante Ductal In situ Lobular Otros Desconocido Grado de diferenciación Categoría III Estadio IN SITU I III Desconocido Comorbilidad Ausencia Presencia Desconocido I. Charlson (Min-Max) Prevalente Incidente Intervalo 266(21, 3) 55, 6 (49 -70) 19 (12, 6) 132 (87, 4) 115 633(50, 7) 60, 1 (48 -70) 67 (14, 8) 387 (85, 2) 179 349(27, 9) 57, 7 (49 -71) 21 (9, 5) 201 (90, 5) 127 195 (73, 9) 456 (72) 258 (75, 2) 35 (13, 3) 23 (8, 7) 11 (4, 2) 2 48 (34, 8) 62 (44, 9) 28 (20, 3) 37 (14, 3) 139 (53, 7) 68 (26, 3) 15 (5, 8) 7 147 (78, 2) 41 (21, 8) 78 0, 62 (0 -9) 61 (9, 6) 71 (11, 2) 45 (7, 1) 0 135 (30) 190 (42, 2) 125 (27, 8) 70 (11, 3) 345 (55, 6) 164 (26, 4) 42 (6, 8) 12 387 (70) 166 (30) 80 0, 81 (0 -13) 12 (3, 5) 38 (11, 1) 35 (10, 2) 6 51 (17, 9) 107 (37, 5) 127 (44, 6) 14 (4, 2) 89 (26, 6) 145 (43, 4) 86 (25, 7) 15 254 (73, 6) 91 (26, 4) 4 0, 79 (0 -7) p-valor <0, 001 0, 164 <0, 001 0, 081 0, 367 #SEOM 2017

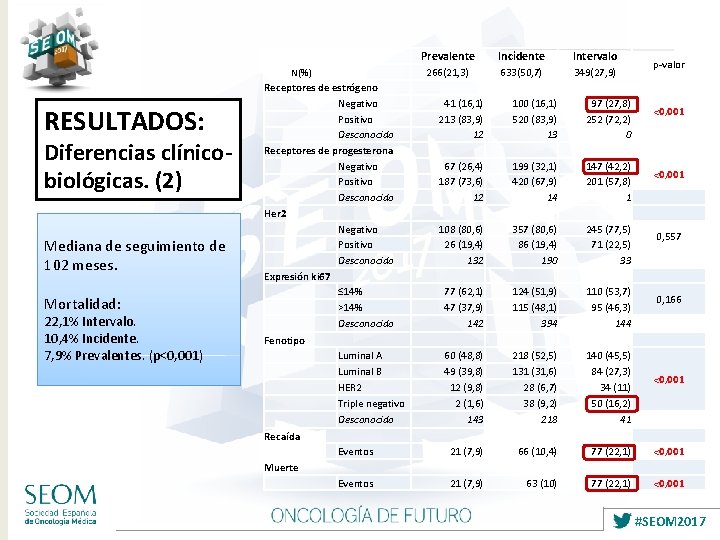
Prevalente Incidente Intervalo Receptores de estrógeno Negativo Positivo Desconocido Receptores de progesterona Negativo Positivo Desconocido Her 2 Negativo Positivo Desconocido Expresión ki 67 ≤ 14% >14% Desconocido Fenotipo Luminal A Luminal B HER 2 Triple negativo Desconocido Recaída Eventos Muerte Eventos 266(21, 3) 633(50, 7) 349(27, 9) N(%) RESULTADOS: Diferencias clínicobiológicas. (2) Mediana de seguimiento de 102 meses. Mortalidad: 22, 1% Intervalo. 10, 4% Incidente. 7, 9% Prevalentes. (p<0, 001) 41 (16, 1) 213 (83, 9) 12 67 (26, 4) 187 (73, 6) 12 108 (80, 6) 26 (19, 4) 132 77 (62, 1) 47 (37, 9) 142 60 (48, 8) 49 (39, 8) 12 (9, 8) 2 (1, 6) 143 21 (7, 9) 100 (16, 1) 520 (83, 9) 13 199 (32, 1) 420 (67, 9) 14 357 (80, 6) 86 (19, 4) 190 124 (51, 9) 115 (48, 1) 394 218 (52, 5) 131 (31, 6) 28 (6, 7) 38 (9, 2) 218 66 (10, 4) 63 (10) 97 (27, 8) 252 (72, 2) 0 147 (42, 2) 201 (57, 8) 1 245 (77, 5) 71 (22, 5) 33 110 (53, 7) 95 (46, 3) 144 140 (45, 5) 84 (27, 3) 34 (11) 50 (16, 2) 41 77 (22, 1) p-valor <0, 001 0, 557 0, 166 <0, 001 #SEOM 2017

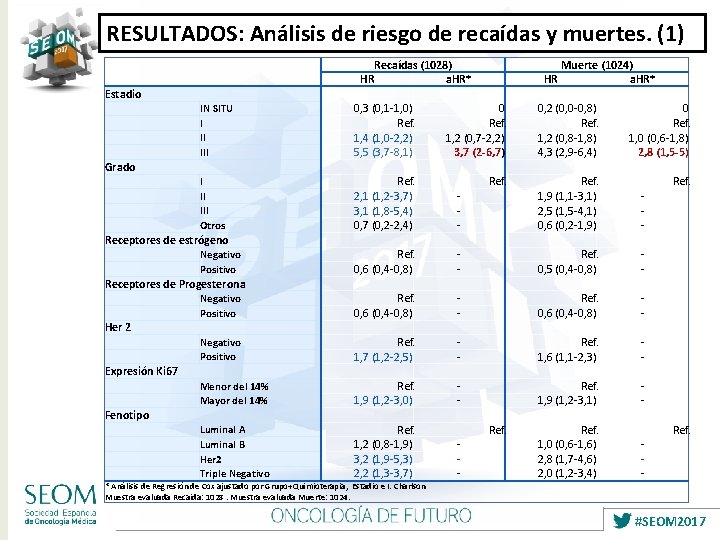
RESULTADOS: Análisis de riesgo de recaídas y muertes. (1) Estadio IN SITU I II III Grado I II III Otros Receptores de estrógeno Negativo Positivo Receptores de Progesterona Negativo Positivo Her 2 Negativo Positivo Expresión Ki 67 Menor del 14% Mayor del 14% Fenotipo Luminal A Luminal B Her 2 Triple Negativo Recaídas (1028) HR a. HR* 0, 3 (0, 1 -1, 0) 0 Ref. 1, 4 (1, 0 -2, 2) 1, 2 (0, 7 -2, 2) 5, 5 (3, 7 -8, 1) 3, 7 (2 -6, 7) Ref. 2, 1 (1, 2 -3, 7) 3, 1 (1, 8 -5, 4) 0, 7 (0, 2 -2, 4) Ref. 0, 6 (0, 4 -0, 8) Ref. 1, 7 (1, 2 -2, 5) Ref. 1, 9 (1, 2 -3, 0) Ref. 1, 2 (0, 8 -1, 9) 3, 2 (1, 9 -5, 3) 2, 2 (1, 3 -3, 7) - * Análisis de Regresión de Cox ajustado por Grupo+Quimioterapia, Estadio e I. Charlson Muestra evaluada Recaida: 1028. Muestra evaluada Muerte: 1024. Muerte (1024) a. HR* 0, 2 (0, 0 -0, 8) 0 Ref. 1, 2 (0, 8 -1, 8) 1, 0 (0, 6 -1, 8) 4, 3 (2, 9 -6, 4) 2, 8 (1, 5 -5) Ref. 1, 9 (1, 1 -3, 1) 2, 5 (1, 5 -4, 1) 0, 6 (0, 2 -1, 9) Ref. 0, 5 (0, 4 -0, 8) Ref. 0, 6 (0, 4 -0, 8) Ref. 1, 6 (1, 1 -2, 3) Ref. 1, 9 (1, 2 -3, 1) Ref. 1, 0 (0, 6 -1, 6) 2, 8 (1, 7 -4, 6) 2, 0 (1, 2 -3, 4) HR #SEOM 2017

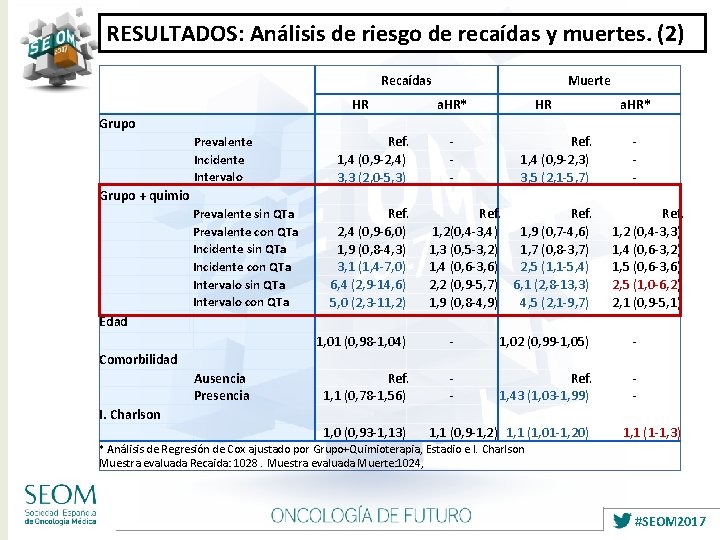
RESULTADOS: Análisis de riesgo de recaídas y muertes. (2) Grupo HR Prevalente Incidente Intervalo Grupo + quimio Prevalente sin QTa Prevalente con QTa Incidente sin QTa Incidente con QTa Intervalo sin QTa Intervalo con QTa Edad Comorbilidad Ausencia Presencia I. Charlson Recaídas Muerte a. HR* - HR Ref. 1, 4 (0, 9 -2, 4) 3, 3 (2, 0 -5, 3) Ref. 2, 4 (0, 9 -6, 0) 1, 9 (0, 8 -4, 3) 3, 1 (1, 4 -7, 0) 6, 4 (2, 9 -14, 6) 5, 0 (2, 3 -11, 2) Ref. 1, 4 (0, 9 -2, 3) 3, 5 (2, 1 -5, 7) Ref. 1, 2(0, 4 -3, 4) 1, 9 (0, 7 -4, 6) 1, 3 (0, 5 -3, 2) 1, 7 (0, 8 -3, 7) 1, 4 (0, 6 -3, 6) 2, 5 (1, 1 -5, 4) 2, 2 (0, 9 -5, 7) 6, 1 (2, 8 -13, 3) 1, 9 (0, 8 -4, 9) 4, 5 (2, 1 -9, 7) 1, 01 (0, 98 -1, 04) Ref. 1, 1 (0, 78 -1, 56) 1, 0 (0, 93 -1, 13) 1, 02 (0, 99 -1, 05) Ref. 1, 43 (1, 03 -1, 99) 1, 1 (0, 9 -1, 2) 1, 1 (1, 01 -1, 20) a. HR* Ref. 1, 2 (0, 4 -3, 3) 1, 4 (0, 6 -3, 2) 1, 5 (0, 6 -3, 6) 2, 5 (1, 0 -6, 2) 2, 1 (0, 9 -5, 1) 1, 1 (1 -1, 3) * Análisis de Regresión de Cox ajustado por Grupo+Quimioterapia, Estadio e I. Charlson Muestra evaluada Recaida: 1028. Muestra evaluada Muerte: 1024, #SEOM 2017

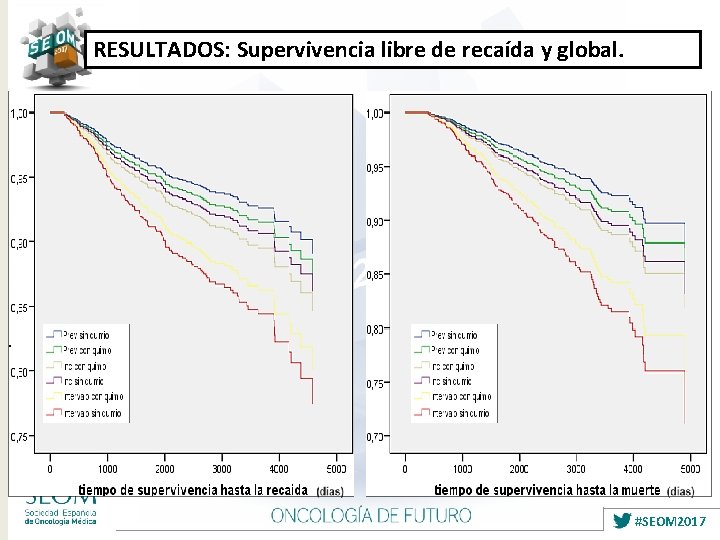
RESULTADOS: Supervivencia libre de recaída y global. #SEOM 2017

CONCLUSIONES • El CM de Intervalo asocia características clínico-patológicas de peor pronóstico en comparación con el prevalente e incidente que por el contrario suele tener un perfil biológico menos agresivo. • Nuestro trabajo es de los pocos que evalúa el beneficio en supervivencia de la QT adyuvante en los diferentes grupos de cáncer de mama diagnosticados por screening, teniendo en cuenta además la comorbilidad. Demostramos que la quimioterapia adyuvante parece beneficiar al cáncer de mama de intervalo, sin que aporte claro beneficio a los grupos de pacientes con carcinomas prevalentes e incidentes, cuando tenemos en cuenta la comorbilidad de las pacientes. • El método de detección del CM, es un importante factor pronóstico que debería considerarse para la toma de decisiones sobre la administración o no de la QT adyuvante a las pacientes. #SEOM 2017



















