GU ASCO 2018 San Francisco 08 10 02


























- Slides: 55

GU ASCO 2018, San Francisco 08. -10. 02. 2018 GU ASCO 2018 1

HODEN GU ASCO 2018 2

IST ACTIVE SURVEILLANCE EINE OPTION BEI PATIENTEN MIT HODENTUMOREN UND GRENZWERTIG VERGRÖßERTEN LYMPHKNOTEN? GU ASCO 2018 3

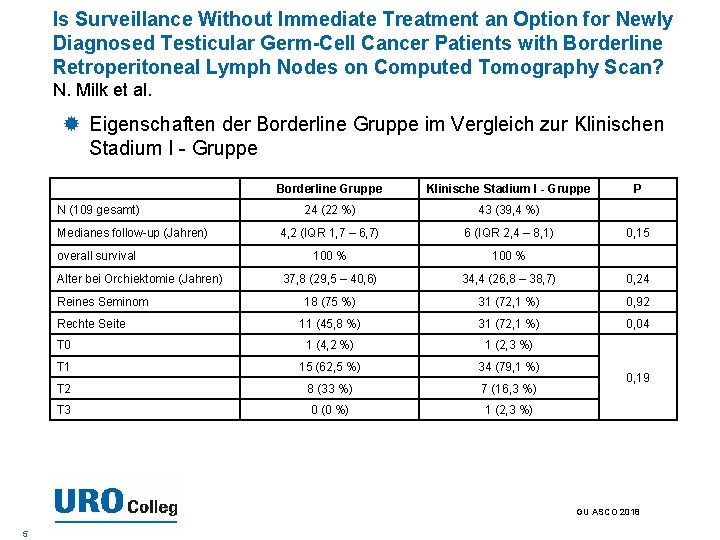
Is Surveillance Without Immediate Treatment an Option for Newly Diagnosed Testicular Germ-Cell Cancer Patients with Borderline Retroperitoneal Lymph Nodes on Computed Tomography Scan? N. Milk et al. Das TNM-Stagingsystem für Hoden Keimzelltumoren (GCT) setzt keinen minimalen Durchmesser, um positive retroperitoneale Lymphknoten (LN) bei der Computertomographie zu definieren. Es ist üblich, sich auf LN ≥ 1 cm Durchmesser als positiv zu beziehen, womit LN Vergrößerungen von 1 -1, 5 cm eher als Borderline gelten. Ziel war es, den klinischen Langzeitverlauf für GCT Patienten mit grenzwertig vergrößerten LN zwischen 1 -1, 5 cm, die zunächst mit der Überwachung behandelt werden, zu beschreiben. GU ASCO 2018 4

Is Surveillance Without Immediate Treatment an Option for Newly Diagnosed Testicular Germ-Cell Cancer Patients with Borderline Retroperitoneal Lymph Nodes on Computed Tomography Scan? N. Milk et al. Eigenschaften der Borderline Gruppe im Vergleich zur Klinischen Stadium I - Gruppe Borderline Gruppe Klinische Stadium I - Gruppe 24 (22 %) 43 (39, 4 %) 4, 2 (IQR 1, 7 – 6, 7) 6 (IQR 2, 4 – 8, 1) 100 % 37, 8 (29, 5 – 40, 6) 34, 4 (26, 8 – 38, 7) 0, 24 18 (75 %) 31 (72, 1 %) 0, 92 11 (45, 8 %) 31 (72, 1 %) 0, 04 T 0 1 (4, 2 %) 1 (2, 3 %) T 1 15 (62, 5 %) 34 (79, 1 %) T 2 8 (33 %) 7 (16, 3 %) T 3 0 (0 %) 1 (2, 3 %) N (109 gesamt) Medianes follow-up (Jahren) overall survival Alter bei Orchiektomie (Jahren) Reines Seminom Rechte Seite P 0, 15 0, 19 GU ASCO 2018 5

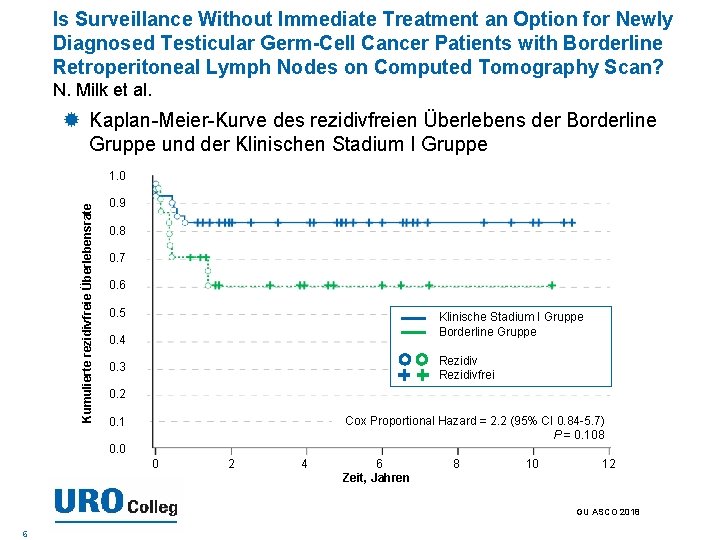
Is Surveillance Without Immediate Treatment an Option for Newly Diagnosed Testicular Germ-Cell Cancer Patients with Borderline Retroperitoneal Lymph Nodes on Computed Tomography Scan? N. Milk et al. Kaplan-Meier-Kurve des rezidivfreien Überlebens der Borderline Gruppe und der Klinischen Stadium I Gruppe Kumulierte rezidivfreie Überlebensrate 1. 0 0. 9 0. 8 0. 7 0. 6 0. 5 Klinische Stadium I Gruppe Borderline Gruppe 0. 4 Rezidivfrei 0. 3 0. 2 Cox Proportional Hazard = 2. 2 (95% CI 0. 84 -5. 7) P = 0. 108 0. 1 0. 0 0 2 4 6 Zeit, Jahren 8 10 12 GU ASCO 2018 6

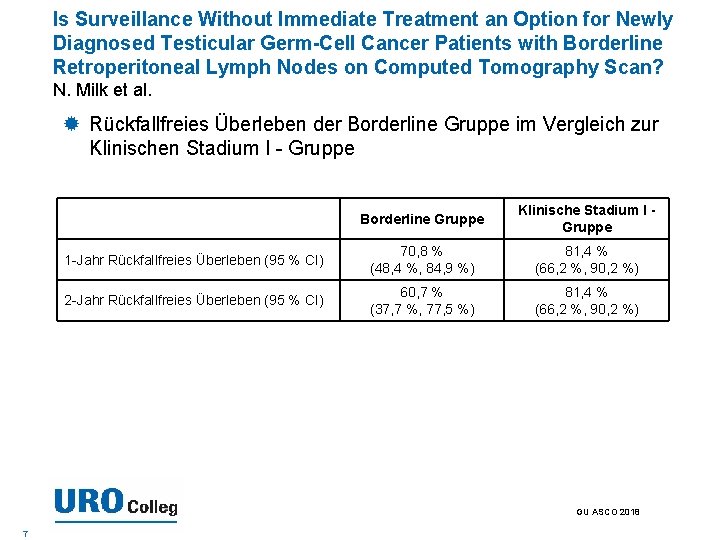
Is Surveillance Without Immediate Treatment an Option for Newly Diagnosed Testicular Germ-Cell Cancer Patients with Borderline Retroperitoneal Lymph Nodes on Computed Tomography Scan? N. Milk et al. Rückfallfreies Überleben der Borderline Gruppe im Vergleich zur Klinischen Stadium I - Gruppe Borderline Gruppe Klinische Stadium I Gruppe 1 -Jahr Rückfallfreies Überleben (95 % CI) 70, 8 % (48, 4 %, 84, 9 %) 81, 4 % (66, 2 %, 90, 2 %) 2 -Jahr Rückfallfreies Überleben (95 % CI) 60, 7 % (37, 7 %, 77, 5 %) 81, 4 % (66, 2 %, 90, 2 %) GU ASCO 2018 7

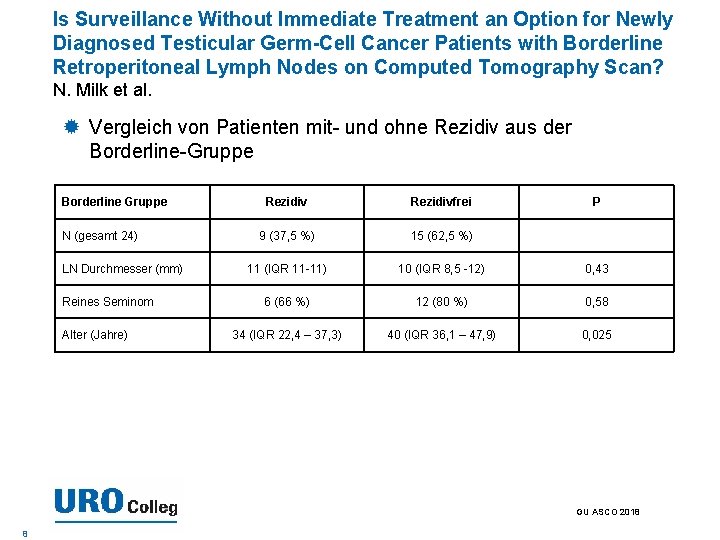
Is Surveillance Without Immediate Treatment an Option for Newly Diagnosed Testicular Germ-Cell Cancer Patients with Borderline Retroperitoneal Lymph Nodes on Computed Tomography Scan? N. Milk et al. Vergleich von Patienten mit- und ohne Rezidiv aus der Borderline-Gruppe Borderline Gruppe N (gesamt 24) LN Durchmesser (mm) Reines Seminom Alter (Jahre) Rezidivfrei P 9 (37, 5 %) 15 (62, 5 %) 11 (IQR 11 -11) 10 (IQR 8, 5 -12) 0, 43 6 (66 %) 12 (80 %) 0, 58 34 (IQR 22, 4 – 37, 3) 40 (IQR 36, 1 – 47, 9) 0, 025 GU ASCO 2018 8

Is Surveillance Without Immediate Treatment an Option for Newly Diagnosed Testicular Germ-Cell Cancer Patients with Borderline Retroperitoneal Lymph Nodes on Computed Tomography Scan? N. Milk et al. Zusammenfassung Surveillance ist eine Option für Patienten mit Keimzelltumoren mit retroperitonealen LN in Borderline-Größe zum Zeitpunkt der Diagnose, und kann dazu beitragen, eine unnötige Behandlung in 60% zu verhindern. GU ASCO 2018 9

GIBT ES NEUE DIAGNOSTISCHE MAßNAHMEN, UM DIE DOKUMENTATION DES ANSPRECHENS AUF CHEMOTHERAPIE BEI HODENTUMOREN ZU VERBESSERN? GU ASCO 2018 10

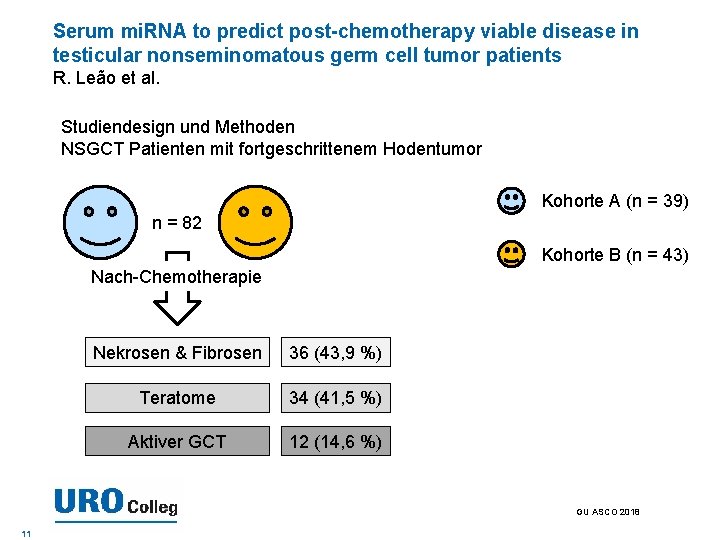
Serum mi. RNA to predict post-chemotherapy viable disease in testicular nonseminomatous germ cell tumor patients R. Leão et al. Studiendesign und Methoden NSGCT Patienten mit fortgeschrittenem Hodentumor Kohorte A (n = 39) n = 82 Kohorte B (n = 43) Nach-Chemotherapie Nekrosen & Fibrosen 36 (43, 9 %) Teratome 34 (41, 5 %) Aktiver GCT 12 (14, 6 %) GU ASCO 2018 11

Serum mi. RNA to predict post-chemotherapy viable disease in testicular nonseminomatous germ cell tumor patients R. Leão et al. Studiendesign und Methoden amp. TSmi. R Test GU ASCO 2018 12

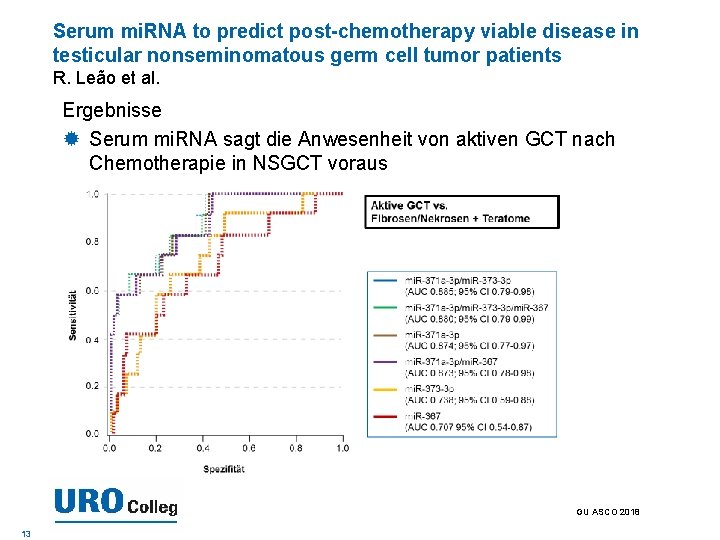
Serum mi. RNA to predict post-chemotherapy viable disease in testicular nonseminomatous germ cell tumor patients R. Leão et al. Ergebnisse Serum mi. RNA sagt die Anwesenheit von aktiven GCT nach Chemotherapie in NSGCT voraus GU ASCO 2018 13

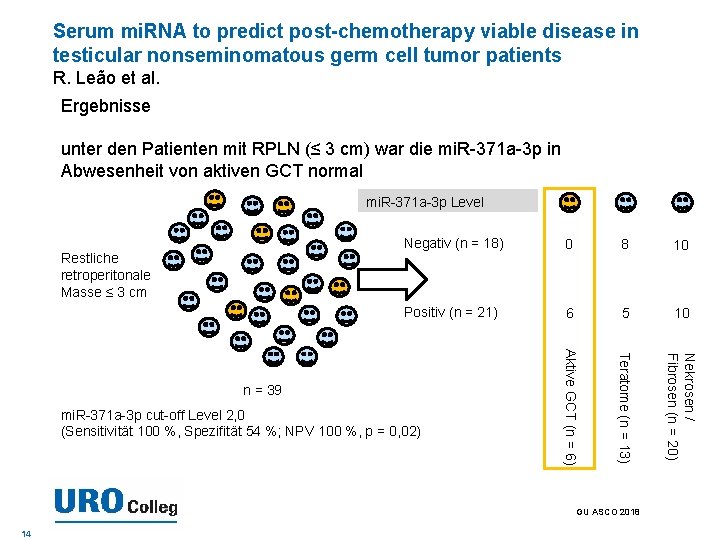
Serum mi. RNA to predict post-chemotherapy viable disease in testicular nonseminomatous germ cell tumor patients R. Leão et al. Ergebnisse unter den Patienten mit RPLN (≤ 3 cm) war die mi. R-371 a-3 p in Abwesenheit von aktiven GCT normal mi. R-371 a-3 p Level 8 10 Positiv (n = 21) 6 5 10 Nekrosen / Fibrosen (n = 20) n = 39 mi. R-371 a-3 p cut-off Level 2, 0 (Sensitivität 100 %, Spezifität 54 %; NPV 100 %, p = 0, 02) Aktive GCT (n = 6) 0 Teratome (n = 13) Restliche retroperitonale Masse ≤ 3 cm Negativ (n = 18) GU ASCO 2018 14

Serum mi. RNA to predict post-chemotherapy viable disease in testicular nonseminomatous germ cell tumor patients R. Leão et al. Zusammenfassung Vorhersage von aktiven Keimzelltumoren Post-Chemotherapie durch getesteten Wert der Serum-mi. RNA Die Serum-mi. RNA ist mit der klinischen Phase und dem Behandlungsansprechen assoziiert Die mi. RNA-371 a-3 p, ist der einzige Serum-Marker, der präzise eine aktive Krankheit nach Chemotherapie prognostiziert Bei retroperitonealer Krankheit (≤ 3 cm), könnte das mi. RNA-371 a-3 p Profil eine Behandlungsentscheidung vorgeben Weitere Studien sind notwendig, um diese Ergebnisse zu bestätigen GU ASCO 2018 15

NIERE GU ASCO 2018 16

BRAUCHEN WIR VERBESSERTE BILDGEBUNG ZUR ABKLÄRUNG VON RAUMFORDERUNGEN DER NIERE? GU ASCO 2018 17

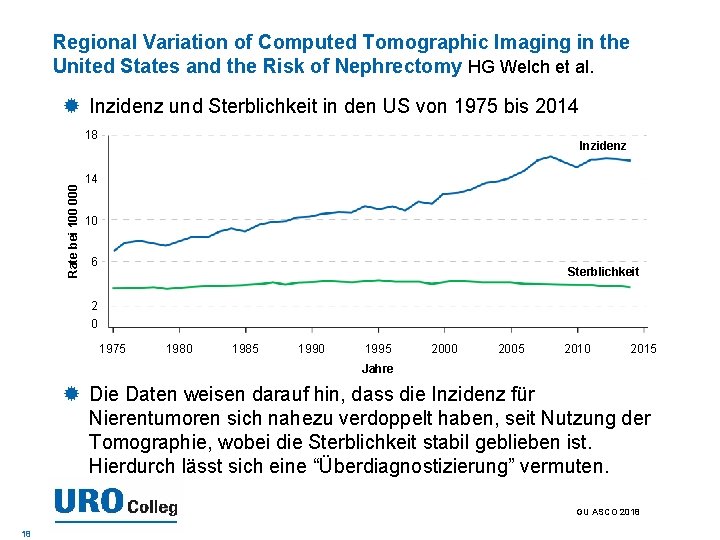
Regional Variation of Computed Tomographic Imaging in the United States and the Risk of Nephrectomy HG Welch et al. Inzidenz und Sterblichkeit in den US von 1975 bis 2014 Rate bei 100 000 18 Inzidenz 14 10 6 Sterblichkeit 2 0 1975 1980 1985 1990 1995 2000 2005 2010 2015 Jahre Die Daten weisen darauf hin, dass die Inzidenz für Nierentumoren sich nahezu verdoppelt haben, seit Nutzung der Tomographie, wobei die Sterblichkeit stabil geblieben ist. Hierdurch lässt sich eine “Überdiagnostizierung” vermuten. GU ASCO 2018 18

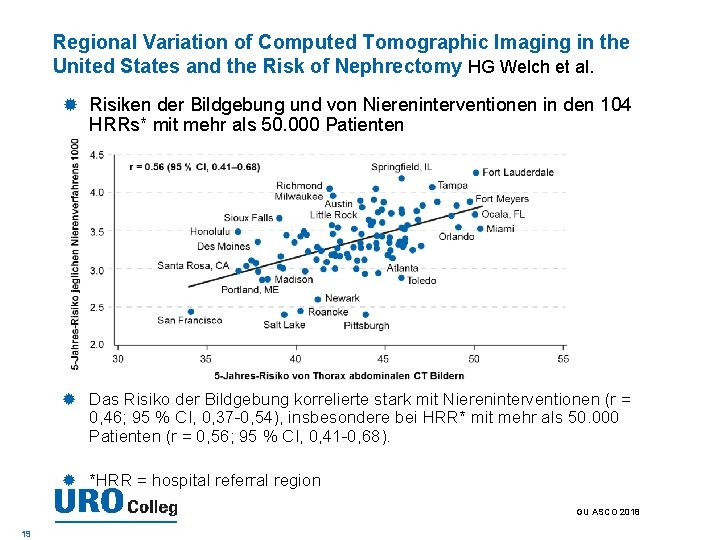
Regional Variation of Computed Tomographic Imaging in the United States and the Risk of Nephrectomy HG Welch et al. Risiken der Bildgebung und von Niereninterventionen in den 104 HRRs* mit mehr als 50. 000 Patienten Das Risiko der Bildgebung korrelierte stark mit Niereninterventionen (r = 0, 46; 95 % CI, 0, 37 -0, 54), insbesondere bei HRR* mit mehr als 50. 000 Patienten (r = 0, 56; 95 % CI, 0, 41 -0, 68). *HRR = hospital referral region GU ASCO 2018 19

Preoperatively Misclassified, Surgically Removed Benign Renal Masses: A Systematic Review of Surgical Series and United States Population Level Burden Estimate DC Johnson et al. Nierenoperationen bei benignen Tumoren 19 Studien evaluierten den Anteil benigner Nierentumoren im Rahmen von Nierenoperationen in den USA bis 1. Juli 2014 • • • Tumor Tumor < 1 cm 1 -2 cm 2 -3 cm 3 -4 cm 4 -7 cm > 7 cm 40, 4 % 20, 9 % 19, 6 % 17, 2 % 9, 2 % 6, 4 % Genutzte Daten: SEER-Datenbasis: Anzahl von Nierenoperationen in US von 2000 – 2009 mit einem Wachstum von 82 % von 3. 098 auf 5. 624 GU ASCO 2018 20

WIE KÖNNEN WIR DIE DIAGNOSTIK KLEINER RAUMFORDERUNGEN DER NIERE VERBESSERN? GU ASCO 2018 21

Renal Mass and Localized Renal Cancer: AUA Guideline S. Campbell et al. GU ASCO 2018 22

Renal Mass and Localized Renal Cancer: AUA Guideline S. Campbell et al. Statements 10 -11 Nierenbiopsie sollte in Betracht gezogen werden, wenn der Tumor verdächtig ist eines hämatologischen, metastatischen, entzündlichen oder infektiösen Ursprungs zu sein. Nierenbiopsie nicht benötigt für: Junge oder gesunde Patienten, die keine Unsicherheiten akzeptieren, die mit der Nierenbiopsie in Verbindung gebracht werden Alte oder gebrechliche Patienten, die konservativ behandelt werden GU ASCO 2018 23

Renal Mass and Localized Renal Cancer: AUA Guideline S. Campbell et al. Statements 12 -13 Patienten sollten aufgeklärt werden über die Rationale für die Biopsie und den Auswirkungen eines positiven oder negativen Ergebnisses und möglichen Nebenwirkungen Keine dokumentierten Fälle von Tumorzellaussaat durch die Biopsie von Nierenzelltumoren in der Literatur Die Nierenbiopsie ist sicher: Hämatome (4, 9 %), klinisch signifikanter Schmerz (1, 2 %), Hämaturie (1, 0 %), Transfusionsrate (0, 4 %) GU ASCO 2018 24

Management of Small Renal Masses: American Society of Clinical Oncology Clinical Practice Guideline A. Finelli et al. ASCO Guidelines: Nierenbiopsie Auf der Basis von tumor-spezifischen Befunden und des Sterblichkeitsrisikos sollten alle Patienten mit einer kleinen Raumforderung der Niere für eine Nierenbiopsie in Betracht gezogen werden. Patienten, die für eine Active Surveillance in Betracht gezogen werden, profitieren möglicherweise auch von einer Biopsie, um das Risiko für Metastasen während der Surveillance zu minimieren und um die Patienten zu informieren Für Patienten mit kleiner Raumforderung der Niere, die für eine Thermoablation in Betracht gezogen werden, sollte eine präablative Nierenbiopsie durchgeführt werden, um die Diagnose zu sichern und das Follow-up anzupassen GU ASCO 2018 25

IST ACTIVE SURVEILLANCE EINE OPTION BEI KLEINEN NIERENTUMOREN? GU ASCO 2018 26

AUA Leitlinien zum Nierenzellkarzinom 2017 GU ASCO 2018 27

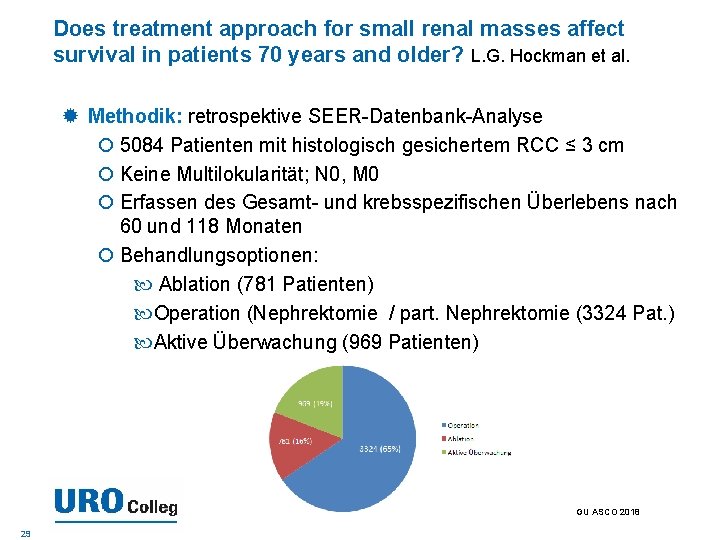
Does treatment approach for small renal masses affect survival in patients 70 years and older? L. G. Hockman et al. Hintergrund: moderne Bildgebung führt zu zunehmender Detektion kleiner, häufiger gutartiger oder niedrig-maligner Nierentumoren ≤ 3 cm. Bei älteren Patienten wird daher zunehmend die aktive Überwachung diskutiert. Diese Studie beleuchtet das Überleben nach verschiedenen Behandlungsmodalitäten bei Patienten über 70 Jahren mit einem kleinen, histologisch gesicherten Nierentumor. GU ASCO 2018 28

Does treatment approach for small renal masses affect survival in patients 70 years and older? L. G. Hockman et al. Methodik: retrospektive SEER-Datenbank-Analyse 5084 Patienten mit histologisch gesichertem RCC ≤ 3 cm Keine Multilokularität; N 0, M 0 Erfassen des Gesamt- und krebsspezifischen Überlebens nach 60 und 118 Monaten Behandlungsoptionen: Ablation (781 Patienten) Operation (Nephrektomie / part. Nephrektomie (3324 Pat. ) Aktive Überwachung (969 Patienten) GU ASCO 2018 29

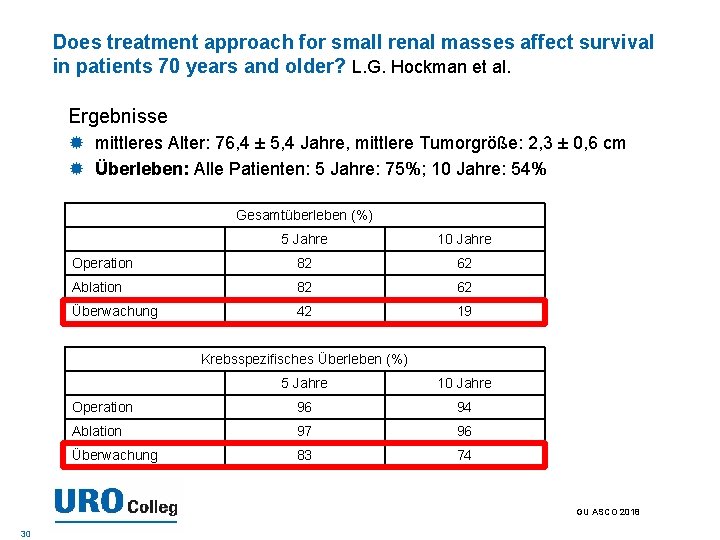
Does treatment approach for small renal masses affect survival in patients 70 years and older? L. G. Hockman et al. Ergebnisse mittleres Alter: 76, 4 ± 5, 4 Jahre, mittlere Tumorgröße: 2, 3 ± 0, 6 cm Überleben: Alle Patienten: 5 Jahre: 75%; 10 Jahre: 54% Gesamtüberleben (%) 5 Jahre 10 Jahre Operation 82 62 Ablation 82 62 Überwachung 42 19 Krebsspezifisches Überleben (%) 5 Jahre 10 Jahre Operation 96 94 Ablation 97 96 Überwachung 83 74 GU ASCO 2018 30

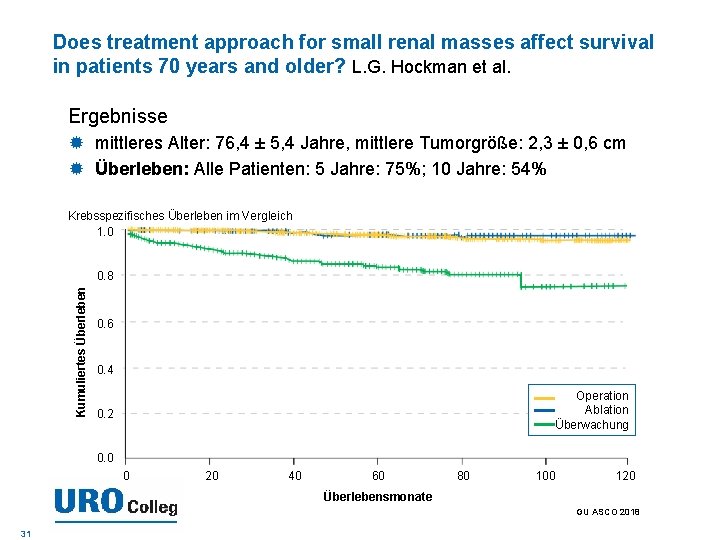
Does treatment approach for small renal masses affect survival in patients 70 years and older? L. G. Hockman et al. Ergebnisse mittleres Alter: 76, 4 ± 5, 4 Jahre, mittlere Tumorgröße: 2, 3 ± 0, 6 cm Überleben: Alle Patienten: 5 Jahre: 75%; 10 Jahre: 54% Krebsspezifisches Überleben im Vergleich 1. 0 Kumuliertes Überleben 0. 8 0. 6 0. 4 Operation Ablation Überwachung 0. 2 0. 0 0 20 40 60 80 100 120 Überlebensmonate GU ASCO 2018 31

Does treatment approach for small renal masses affect survival in patients 70 years and older? L. G. Hockman et al. Schlussfolgerung Die Studie zeigt einen signifikanten krebsspezifischen Überlebensvorteil für eine aktive Therapie (Operation / Ablation) gegenüber der aktiven Überwachung bei Patienten mit ≥ 70 Jahren mit kleinen, histologisch gesicherten, malignen Nierentumoren unter 3 cm. Die aktive Überwachung ist eine Option für Patienten mit signifikanten Komorbiditäten. Dagegen sollte ausgewählten Patienten mit kleinen Nierentumoren eine kurative Therapie angeboten werden, auch wenn sie 70 Jahre oder älter sind. GU ASCO 2018 32

WIE SIEHT DIE AKTUELLE MEDIKAMENTÖSE THERAPIE DES METASTASIERTEN NIERENZELLKARZINOMS AUS? GU ASCO 2018 33

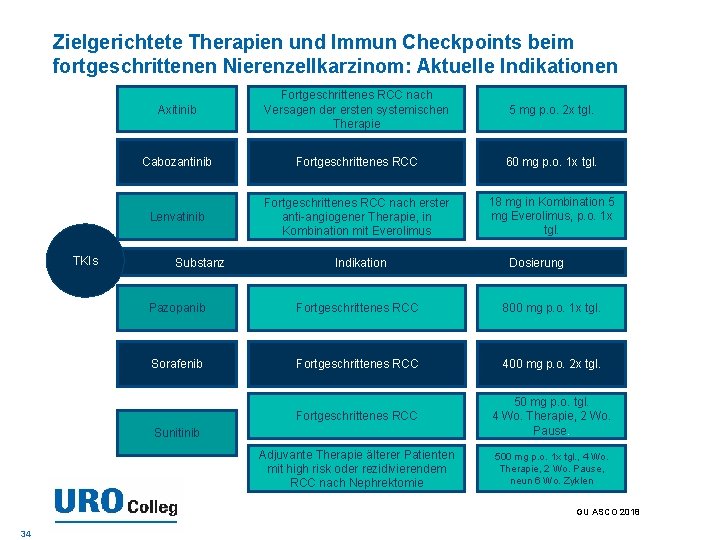
Zielgerichtete Therapien und Immun Checkpoints beim fortgeschrittenen Nierenzellkarzinom: Aktuelle Indikationen TKIs Axitinib Fortgeschrittenes RCC nach Versagen der ersten systemischen Therapie 5 mg p. o. 2 x tgl. Cabozantinib Fortgeschrittenes RCC 60 mg p. o. 1 x tgl. Lenvatinib Fortgeschrittenes RCC nach erster anti-angiogener Therapie, in Kombination mit Everolimus 18 mg in Kombination 5 mg Everolimus, p. o. 1 x tgl. Substanz Indikation Dosierung Pazopanib Fortgeschrittenes RCC 800 mg p. o. 1 x tgl. Sorafenib Fortgeschrittenes RCC 400 mg p. o. 2 x tgl. Fortgeschrittenes RCC 50 mg p. o. tgl. 4 Wo. Therapie, 2 Wo. Pause. Adjuvante Therapie älterer Patienten mit high risk oder rezidivierendem RCC nach Nephrektomie 500 mg p. o. 1 x tgl. , 4 Wo. Therapie, 2 Wo. Pause, neun 6 Wo. Zyklen Sunitinib GU ASCO 2018 34

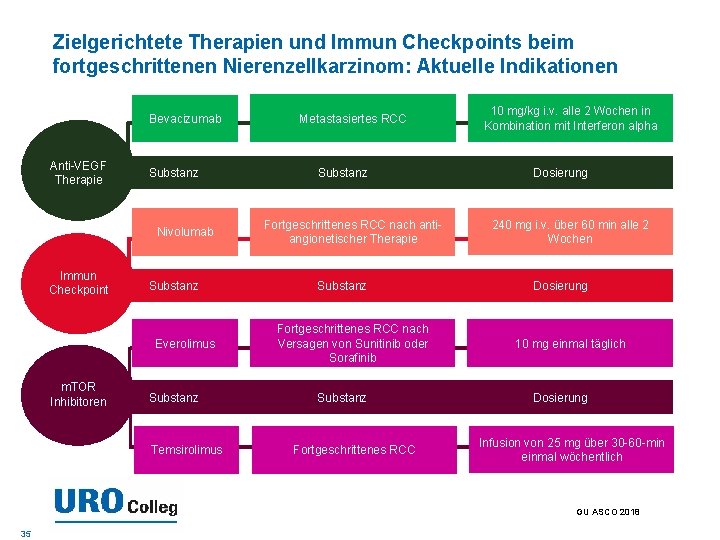
Zielgerichtete Therapien und Immun Checkpoints beim fortgeschrittenen Nierenzellkarzinom: Aktuelle Indikationen Bevacizumab Anti-VEGF Therapie Substanz Nivolumab Immun Checkpoint Substanz Everolimus m. TOR Inhibitoren Substanz Temsirolimus Metastasiertes RCC Substanz Fortgeschrittenes RCC nach antiangionetischer Therapie Substanz Fortgeschrittenes RCC nach Versagen von Sunitinib oder Sorafinib Substanz Fortgeschrittenes RCC 10 mg/kg i. v. alle 2 Wochen in Kombination mit Interferon alpha Dosierung 240 mg i. v. über 60 min alle 2 Wochen Dosierung 10 mg einmal täglich Dosierung Infusion von 25 mg über 30 -60 -min einmal wöchentlich GU ASCO 2018 35

BRINGT DIE KOMBINIERTE IMMUNTHERAPIE VORTEILE GEGENÜBER DER ALLEINIGEN TKITHERAPIE BEI DER ERSTLINIENTHERAPIE DES METASTASIERTEN KLARZELLIGEN NIERENZELLKARZINOMS? GU ASCO 2018 36

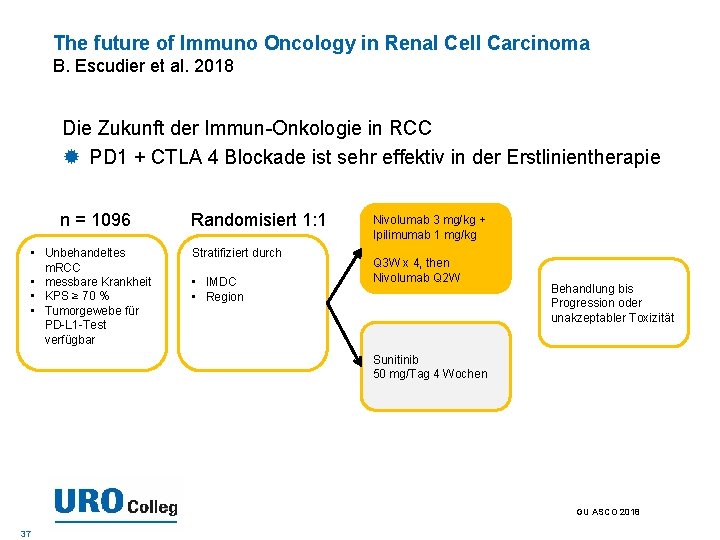
The future of Immuno Oncology in Renal Cell Carcinoma B. Escudier et al. 2018 Die Zukunft der Immun-Onkologie in RCC PD 1 + CTLA 4 Blockade ist sehr effektiv in der Erstlinientherapie n = 1096 • Unbehandeltes m. RCC • messbare Krankheit • KPS ≥ 70 % • Tumorgewebe für PD-L 1 -Test verfügbar Randomisiert 1: 1 Stratifiziert durch • IMDC • Region Nivolumab 3 mg/kg + Ipilimumab 1 mg/kg Q 3 W x 4, then Nivolumab Q 2 W Behandlung bis Progression oder unakzeptabler Toxizität Sunitinib 50 mg/Tag 4 Wochen GU ASCO 2018 37

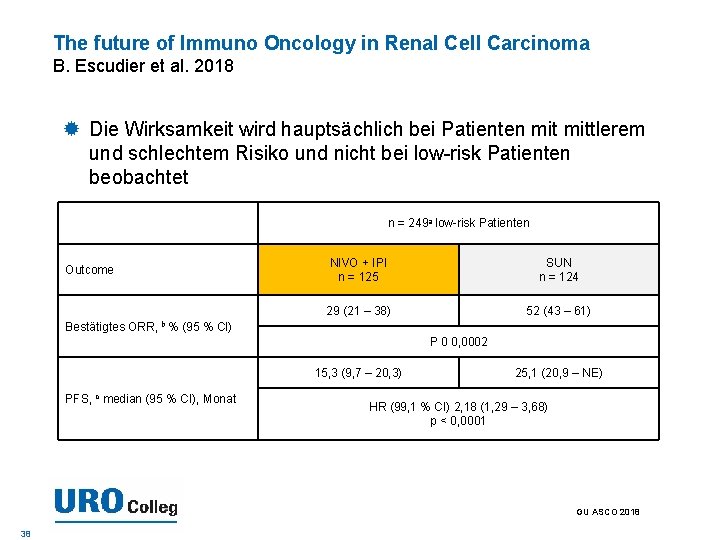
The future of Immuno Oncology in Renal Cell Carcinoma B. Escudier et al. 2018 Die Wirksamkeit wird hauptsächlich bei Patienten mittlerem und schlechtem Risiko und nicht bei low-risk Patienten beobachtet n = 249 a low-risk Patienten Outcome Bestätigtes ORR, b% NIVO + IPI n = 125 SUN n = 124 29 (21 – 38) 52 (43 – 61) (95 % CI) P 0 0, 0002 15, 3 (9, 7 – 20, 3) PFS, c median (95 % CI), Monat 25, 1 (20, 9 – NE) HR (99, 1 % CI) 2, 18 (1, 29 – 3, 68) p < 0, 0001 GU ASCO 2018 38

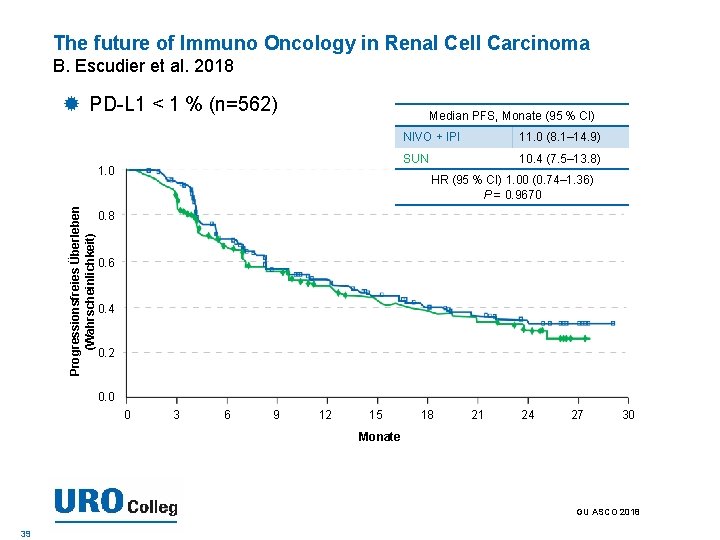
The future of Immuno Oncology in Renal Cell Carcinoma B. Escudier et al. 2018 PD-L 1 < 1 % (n=562) Median PFS, Monate (95 % CI) Progressionsfreies Überleben (Wahrscheinlichkeit) 1. 0 NIVO + IPI 11. 0 (8. 1– 14. 9) SUN 10. 4 (7. 5– 13. 8) HR (95 % CI) 1. 00 (0. 74– 1. 36) P = 0. 9670 0. 8 0. 6 0. 4 0. 2 0. 0 0 3 6 9 12 15 18 21 24 27 30 Monate GU ASCO 2018 39

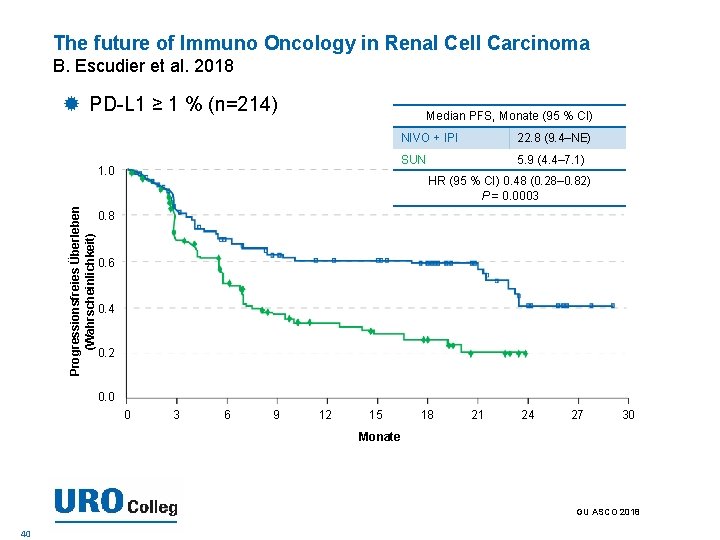
The future of Immuno Oncology in Renal Cell Carcinoma B. Escudier et al. 2018 PD-L 1 ≥ 1 % (n=214) Median PFS, Monate (95 % CI) Progressionsfreies Überleben (Wahrscheinlichkeit) 1. 0 NIVO + IPI 22. 8 (9. 4–NE) SUN 5. 9 (4. 4– 7. 1) HR (95 % CI) 0. 48 (0. 28– 0. 82) P = 0. 0003 0. 8 0. 6 0. 4 0. 2 0. 0 0 3 6 9 12 15 18 21 24 27 30 Monate GU ASCO 2018 40

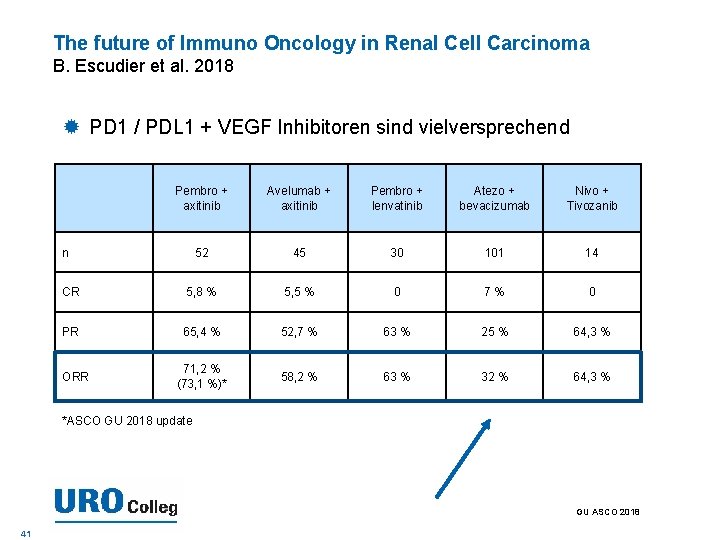
The future of Immuno Oncology in Renal Cell Carcinoma B. Escudier et al. 2018 PD 1 / PDL 1 + VEGF Inhibitoren sind vielversprechend Pembro + axitinib Avelumab + axitinib Pembro + lenvatinib Atezo + bevacizumab Nivo + Tivozanib 52 45 30 101 14 CR 5, 8 % 5, 5 % 0 7% 0 PR 65, 4 % 52, 7 % 63 % 25 % 64, 3 % 71, 2 % (73, 1 %)* 58, 2 % 63 % 32 % 64, 3 % n ORR *ASCO GU 2018 update GU ASCO 2018 41

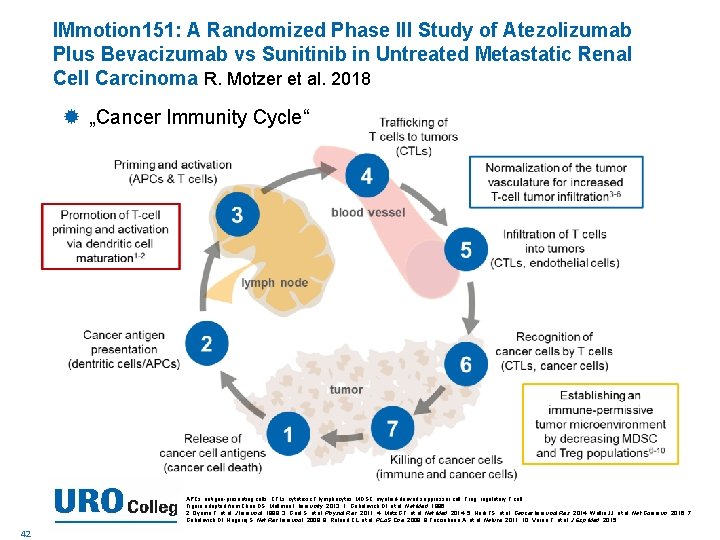
IMmotion 151: A Randomized Phase III Study of Atezolizumab Plus Bevacizumab vs Sunitinib in Untreated Metastatic Renal Cell Carcinoma R. Motzer et al. 2018 „Cancer Immunity Cycle“ APCs, antigen-presenting cells; CTLs, cytotoxic T lymphocytes; MDSC, myeloid-derived suppressor cell; Treg, regulatory T cell. Figure adapted from Chen DS, Mellman I. Immunity, 2013. 1. Gabrilovich DI, et al. Nat Med. 1996. GU Wallin ASCO 2. Oyama T, et al. J Immunol. 1998. 3. Goel S, et al. Physiol Rev. 2011. 4. Motz GT, et al. Nat Med. 2014. 5. Hodi FS, et al. Cancer Immunol Res. 2014. JJ, et 2018 al. Nat Commun. 2016. 7. Gabrilovich DI, Nagaraj S. Nat Rev Immunol. 2009. 8. Roland CL, et al. PLo. S One. 2009. 9 Facciabene A, et al. Nature. 2011. 10. Voron T, et al. J Exp Med. 2015. 42

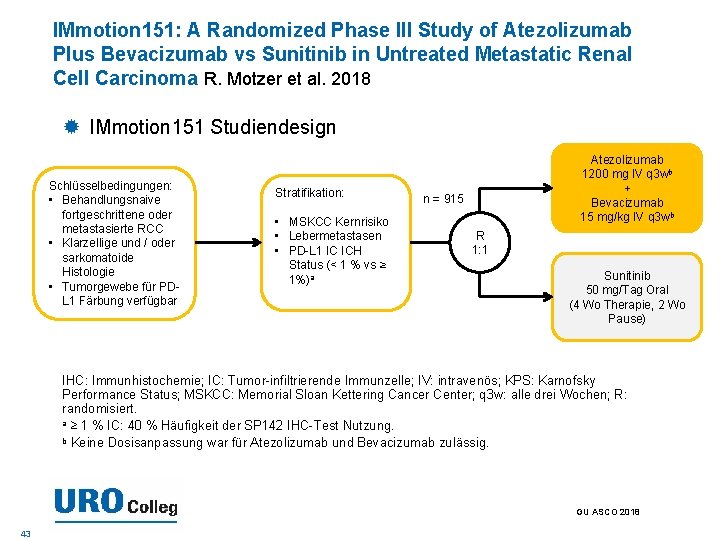
IMmotion 151: A Randomized Phase III Study of Atezolizumab Plus Bevacizumab vs Sunitinib in Untreated Metastatic Renal Cell Carcinoma R. Motzer et al. 2018 IMmotion 151 Studiendesign Schlüsselbedingungen: • Behandlungsnaive fortgeschrittene oder metastasierte RCC • Klarzellige und / oder sarkomatoide Histologie • Tumorgewebe für PDL 1 Färbung verfügbar Stratifikation: • MSKCC Kernrisiko • Lebermetastasen • PD-L 1 IC ICH Status (< 1 % vs ≥ 1%)a Atezolizumab 1200 mg IV q 3 wb + Bevacizumab 15 mg/kg IV q 3 wb n = 915 R 1: 1 Sunitinib 50 mg/Tag Oral (4 Wo Therapie, 2 Wo Pause) IHC: Immunhistochemie; IC: Tumor-infiltrierende Immunzelle; IV: intravenös; KPS: Karnofsky Performance Status; MSKCC: Memorial Sloan Kettering Cancer Center; q 3 w: alle drei Wochen; R: randomisiert. a ≥ 1 % IC: 40 % Häufigkeit der SP 142 IHC-Test Nutzung. b Keine Dosisanpassung war für Atezolizumab und Bevacizumab zulässig. GU ASCO 2018 43

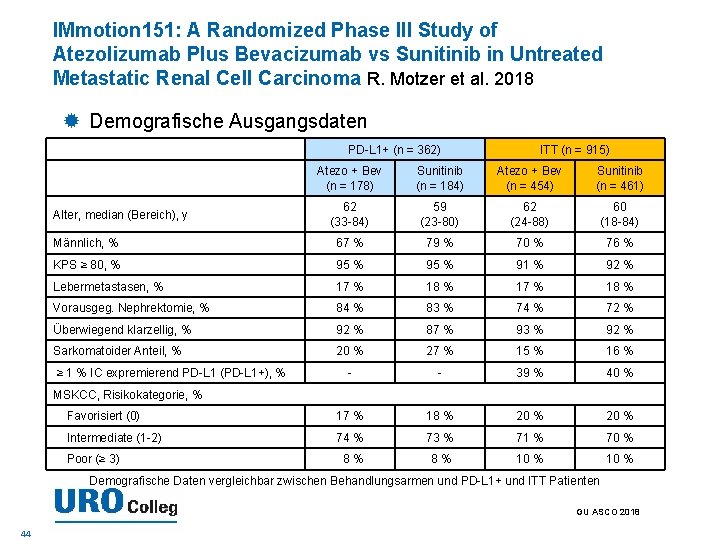
IMmotion 151: A Randomized Phase III Study of Atezolizumab Plus Bevacizumab vs Sunitinib in Untreated Metastatic Renal Cell Carcinoma R. Motzer et al. 2018 Demografische Ausgangsdaten PD-L 1+ (n = 362) ITT (n = 915) Atezo + Bev (n = 178) Sunitinib (n = 184) Atezo + Bev (n = 454) Sunitinib (n = 461) 62 (33 -84) 59 (23 -80) 62 (24 -88) 60 (18 -84) Männlich, % 67 % 79 % 70 % 76 % KPS ≥ 80, % 95 % 91 % 92 % Lebermetastasen, % 17 % 18 % Vorausgeg. Nephrektomie, % 84 % 83 % 74 % 72 % Überwiegend klarzellig, % 92 % 87 % 93 % 92 % Sarkomatoider Anteil, % 20 % 27 % 15 % 16 % - - 39 % 40 % Favorisiert (0) 17 % 18 % 20 % Intermediate (1 -2) 74 % 73 % 71 % 70 % 8% 8% 10 % Alter, median (Bereich), y ≥ 1 % IC expremierend PD-L 1 (PD-L 1+), % MSKCC, Risikokategorie, % Poor (≥ 3) Demografische Daten vergleichbar zwischen Behandlungsarmen und PD-L 1+ und ITT Patienten GU ASCO 2018 44

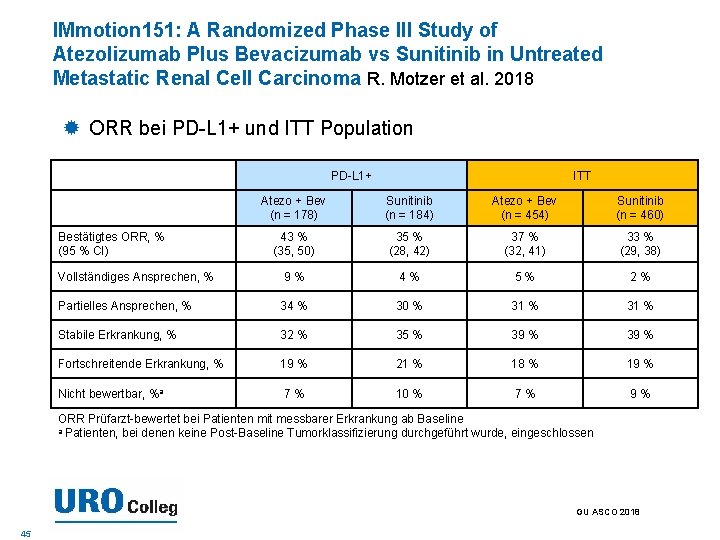
IMmotion 151: A Randomized Phase III Study of Atezolizumab Plus Bevacizumab vs Sunitinib in Untreated Metastatic Renal Cell Carcinoma R. Motzer et al. 2018 ORR bei PD-L 1+ und ITT Population PD-L 1+ ITT Atezo + Bev (n = 178) Sunitinib (n = 184) Atezo + Bev (n = 454) Sunitinib (n = 460) 43 % (35, 50) 35 % (28, 42) 37 % (32, 41) 33 % (29, 38) Vollständiges Ansprechen, % 9% 4% 5% 2% Partielles Ansprechen, % 34 % 30 % 31 % Stabile Erkrankung, % 32 % 35 % 39 % Fortschreitende Erkrankung, % 19 % 21 % 18 % 19 % Nicht bewertbar, %a 7% 10 % 7% 9% Bestätigtes ORR, % (95 % CI) ORR Prüfarzt-bewertet bei Patienten mit messbarer Erkrankung ab Baseline a Patienten, bei denen keine Post-Baseline Tumorklassifizierung durchgeführt wurde, eingeschlossen GU ASCO 2018 45

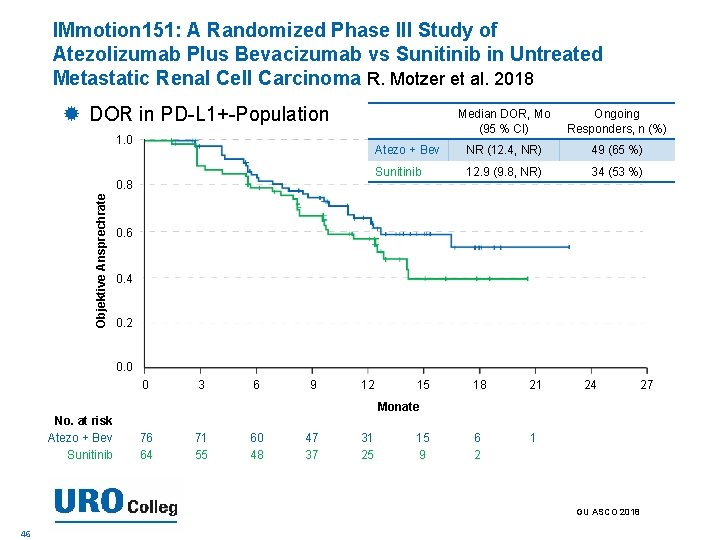
IMmotion 151: A Randomized Phase III Study of Atezolizumab Plus Bevacizumab vs Sunitinib in Untreated Metastatic Renal Cell Carcinoma R. Motzer et al. 2018 DOR in PD-L 1+-Population 1. 0 Objektive Ansprechrate 0. 8 Median DOR, Mo (95 % CI) Ongoing Responders, n (%) Atezo + Bev NR (12. 4, NR) 49 (65 %) Sunitinib 12. 9 (9. 8, NR) 34 (53 %) 0. 6 0. 4 0. 2 0. 0 0 3 6 9 12 15 18 21 6 2 1 24 Monate No. at risk Atezo + Bev Sunitinib 76 64 71 55 60 48 47 37 31 25 15 9 GU ASCO 2018 46 27

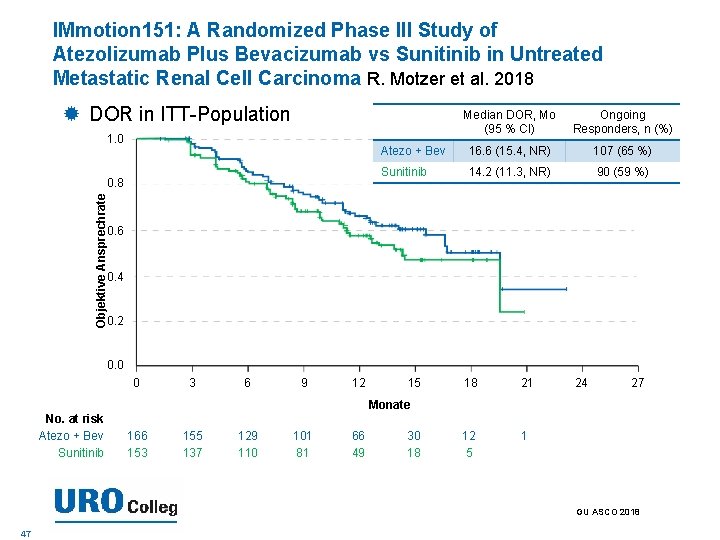
IMmotion 151: A Randomized Phase III Study of Atezolizumab Plus Bevacizumab vs Sunitinib in Untreated Metastatic Renal Cell Carcinoma R. Motzer et al. 2018 DOR in ITT-Population 1. 0 Ongoing Responders, n (%) Atezo + Bev 16. 6 (15. 4, NR) 107 (65 %) Sunitinib 14. 2 (11. 3, NR) 90 (59 %) Objektive Ansprechrate 0. 8 Median DOR, Mo (95 % CI) 0. 6 0. 4 0. 2 0. 0 0 3 6 9 12 15 18 21 12 5 1 24 27 Monate No. at risk Atezo + Bev Sunitinib 166 153 155 137 129 110 101 81 66 49 30 18 GU ASCO 2018 47

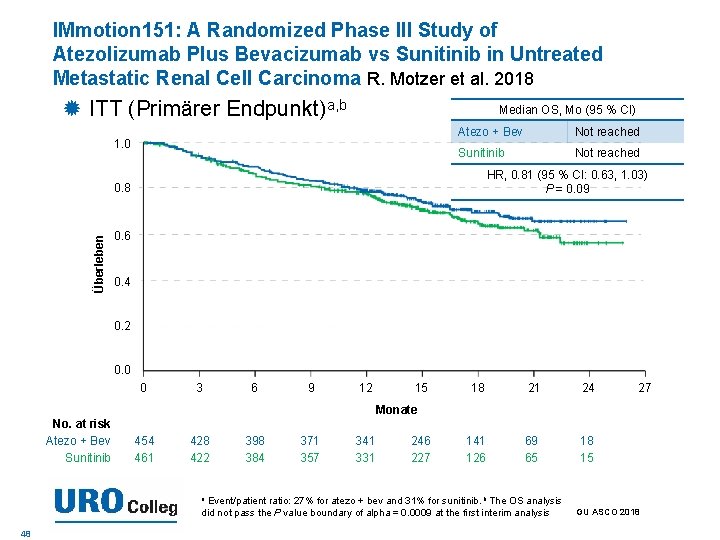
IMmotion 151: A Randomized Phase III Study of Atezolizumab Plus Bevacizumab vs Sunitinib in Untreated Metastatic Renal Cell Carcinoma R. Motzer et al. 2018 ITT (Primärer Endpunkt)a, b Median OS, Mo (95 % CI) 1. 0 Atezo + Bev Not reached Sunitinib Not reached HR, 0. 81 (95 % CI: 0. 63, 1. 03) P = 0. 09 Überleben 0. 8 0. 6 0. 4 0. 2 0. 0 0 3 6 9 12 15 18 21 24 141 126 69 65 18 15 27 Monate No. at risk Atezo + Bev Sunitinib 454 461 428 422 398 384 371 357 341 331 246 227 Event/patient ratio: 27% for atezo + bev and 31% for sunitinib. b The OS analysis did not pass the P value boundary of alpha = 0. 0009 at the first interim analysis a 48 GU ASCO 2018

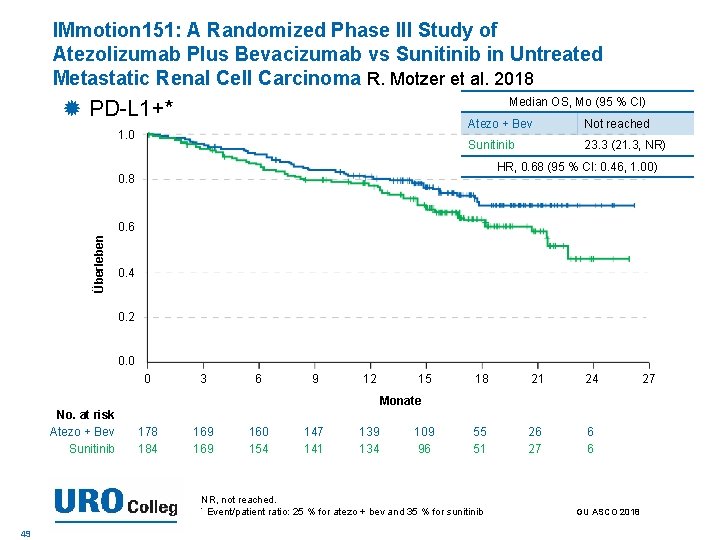
IMmotion 151: A Randomized Phase III Study of Atezolizumab Plus Bevacizumab vs Sunitinib in Untreated Metastatic Renal Cell Carcinoma R. Motzer et al. 2018 Median OS, Mo (95 % CI) PD-L 1+* 1. 0 Atezo + Bev Not reached Sunitinib 23. 3 (21. 3, NR) HR, 0. 68 (95 % CI: 0. 46, 1. 00) 0. 8 Überleben 0. 6 0. 4 0. 2 0. 0 0 3 6 9 12 15 18 21 24 55 51 26 27 6 6 Monate No. at risk Atezo + Bev Sunitinib 178 184 169 160 154 147 141 139 134 109 96 NR, not reached. * Event/patient ratio: 25 % for atezo + bev and 35 % for sunitinib 49 GU ASCO 2018 27

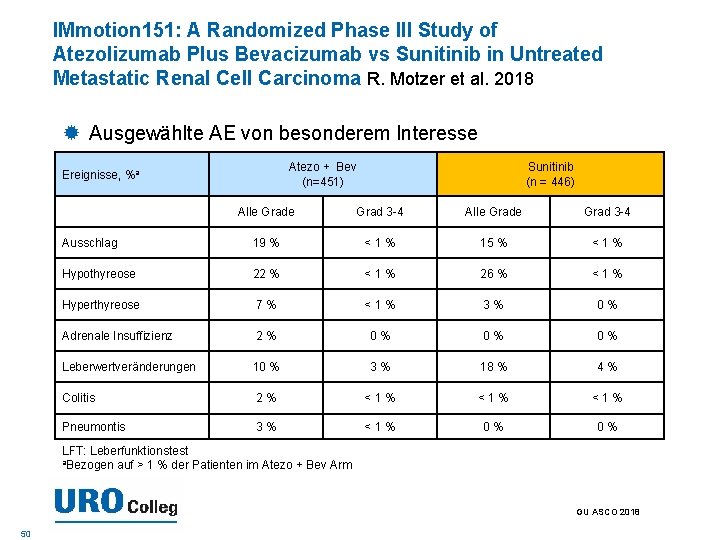
IMmotion 151: A Randomized Phase III Study of Atezolizumab Plus Bevacizumab vs Sunitinib in Untreated Metastatic Renal Cell Carcinoma R. Motzer et al. 2018 Ausgewählte AE von besonderem Interesse Atezo + Bev (n=451) Ereignisse, %a Sunitinib (n = 446) Alle Grade Grad 3 -4 Ausschlag 19 % <1% 15 % <1% Hypothyreose 22 % <1% 26 % <1% Hyperthyreose 7% <1% 3% 0% Adrenale Insuffizienz 2% 0% 0% 0% Leberwertveränderungen 10 % 3% 18 % 4% Colitis 2% <1% <1% Pneumontis 3% <1% 0% 0% LFT: Leberfunktionstest a. Bezogen auf > 1 % der Patienten im Atezo + Bev Arm GU ASCO 2018 50

IMmotion 151: A Randomized Phase III Study of Atezolizumab Plus Bevacizumab vs Sunitinib in Untreated Metastatic Renal Cell Carcinoma R. Motzer et al. 2018 Zusammenfassung IMmotion 151 hat den co-primären PFS Endpunkt erreicht Die Kombination von Atezolizumab + Bevacizumab ist Sunitinib für Patienten mit PD-L 1+ überlegen Die Ansprechraten und OS Ergebnisse zeigen Überlegenheit von Atezolizumab + Bevacizumab Die Studie unterstützt Atezolizumab + Bevacizumab als Erstlinientherapieoption für Patienten mit PD-L 1+ fortgeschrittenem RCC GU ASCO 2018 51

Adjuvant antiangiogenic agents in post-nephrectomy renal cell carcinoma (RCC): A systematic review and meta-analysis. M. B. Sonbol et al. Hintergrund Die Effizienz der antiangioplastischen TKIs in der Therapie des fortgeschrittenen NCC ist etabliert. Nicht sicher geklärt ist der Nutzen in der adjuvanten Situation bei nephrektomierten Patienten mit hohen Tumorrisiko Methodik Retrospektive Analyse von drei RTCs (ASSURE, PROTECT, STRAC) 3693 nephrektomierte Patienten mit hohem / sehr hohem Relapserisiko Studienendpunkte: OS und DFS Studien-TKIs: Sunitinib, Sorafinib und Pazopanib, Kontrolle: Placebo GU ASCO 2018 52

Adjuvant antiangiogenic agents in post-nephrectomy renal cell carcinoma (RCC): A systematic review and meta-analysis. M. B. Sonbol et al. Ergebnisse gepoolt Alle 3 VEGF-TKIs: DFS: HR 0, 92 95%CI 0, 78 – 1, 07 OS: HR 0, 99 95%CI 0, 79 – 1, 25 z. B. Sunitinib: DFS: HR 0, 89 95%CI 0, 67 – 1, 19 OS: HR 1, 11 95%CI 0, 9 – 1, 37 Schlussfolgerung VEGF-TKIs bieten gegenüber Placebo keinen Vorteil in der adjuvanten Therapie bei nephrektomierten Patienten mit hohem und sehr hohem Relapse-Risiko Darüber hinaus haben die mit den VEGF-TKIs behandelten Patienten ein 2, 7 -fach erhöhtes Risiko für Grad ≥ 3 Nebenwirkungen gegenüber Placebo GU ASCO 2018 53

Copyright-Hinweis Die Inhalte des vorangegangenen Slidekits basieren auf wissenschaftlichen Vorträgen und Poster Sessions des Genitourinary Cancers Symposiums, San Francisco, 2018 und den vom Veranstalter erworbenen Abstracts und Meeting Slides. Die Veröffentlichung im Rahmen dieses Slidekits erfolgt unter Berücksichtigung aller Urheberrechte und erfolgt ausdrücklich nur zu Fort- und Ausbildungszwecken. GU ASCO 2018 54

Vielen Dank für Ihre Aufmerksamkeit! GU ASCO 2018 55
 Asco gu san francisco
Asco gu san francisco Msei usfca
Msei usfca Tu restaurante favorito
Tu restaurante favorito Asco 2017 virtual meeting
Asco 2017 virtual meeting Asco coi
Asco coi Guias asco
Guias asco Gunter von minckwitz
Gunter von minckwitz 2017 asco oncology practice conference
2017 asco oncology practice conference Que letra continua m v t m j
Que letra continua m v t m j Faglia san francisco
Faglia san francisco Escuela san francisco de asis temuco
Escuela san francisco de asis temuco Fdic flood insurance
Fdic flood insurance Asha san francisco
Asha san francisco Plung
Plung Www.sfihsspa.org
Www.sfihsspa.org San francisco vikings
San francisco vikings Criterios de san francisco
Criterios de san francisco Cesar coll biografia
Cesar coll biografia Colegio ass
Colegio ass Santa clara y san francisco de asis
Santa clara y san francisco de asis San francisco unified school district restorative practices
San francisco unified school district restorative practices Material de apoyo colegio san francisco coll
Material de apoyo colegio san francisco coll Características de san francisco coll
Características de san francisco coll Escuela san francisco de asis temuco
Escuela san francisco de asis temuco Colegio san francisco de asis temuco
Colegio san francisco de asis temuco San francisco earthquake 1906 magnitude
San francisco earthquake 1906 magnitude Safe training san francisco
Safe training san francisco Lgst 100 upenn
Lgst 100 upenn San francisco background check
San francisco background check San francisco community clinic consortium
San francisco community clinic consortium Simon marcus spotify
Simon marcus spotify Cmips ii
Cmips ii Enterprise zone credit san francisco
Enterprise zone credit san francisco San francisco fire prevention
San francisco fire prevention Colegio san francisco javier
Colegio san francisco javier University of san francisco marketing
University of san francisco marketing San francisco hospital
San francisco hospital 1988 earthquake san francisco
1988 earthquake san francisco Escuela profesional san francisco
Escuela profesional san francisco 5 themes of geography san francisco
5 themes of geography san francisco General assistance sf
General assistance sf Poeta en san francisco
Poeta en san francisco Faglia san francisco
Faglia san francisco Museum of modern art san francisco
Museum of modern art san francisco San francisco de sales y don bosco
San francisco de sales y don bosco Lisosoma función
Lisosoma función Escaleras de san francisco
Escaleras de san francisco Startup weekend san francisco
Startup weekend san francisco Colegio san francisco de asis nueva imperial
Colegio san francisco de asis nueva imperial Ryan furtado san francisco
Ryan furtado san francisco Issa san francisco
Issa san francisco Helen hayes rehabilitation hospital
Helen hayes rehabilitation hospital Tracheal shave san francisco
Tracheal shave san francisco En que se parecen san francisco de sales y don bosco
En que se parecen san francisco de sales y don bosco Distancia entre san francisco y napa valley
Distancia entre san francisco y napa valley Istituto comprensivo san salvatore telesino
Istituto comprensivo san salvatore telesino