Furukawa IFUSP Yamamura FUNDUNESP TERMODIN NICA OVERVIEW 1
















- Slides: 44

Furukawa - IFUSP Yamamura - FUNDUNESP TERMODIN NICA OVERVIEW 1ª e 2 a Leis

Termodinâmica é a ciência que trata • do calor e do trabalho • das características dos sistemas e • das propriedades dos fluidos termodinâmicos

Alguns ilustres pesquisadores que construiram a termodinâmica James Joule 1818 - 1889 Sadi Carnot 1796 - 1832 Emile Claupeyron 1799 - 1864 Wiliam Thomson Lord Kelvin 1824 - 1907 Rudolf Clausius 1822 - 1888

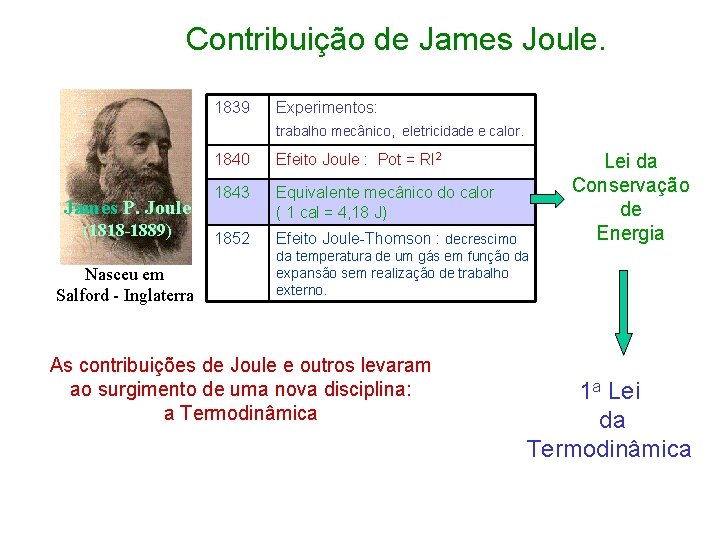
Contribuição de James Joule. 1839 Experimentos: trabalho mecânico, eletricidade e calor. James P. Joule (1818 -1889) Nasceu em Salford - Inglaterra 1840 Efeito Joule : Pot = RI 2 1843 Equivalente mecânico do calor ( 1 cal = 4, 18 J) 1852 Efeito Joule-Thomson : decrescimo Lei da Conservação de Energia da temperatura de um gás em função da expansão sem realização de trabalho externo. As contribuições de Joule e outros levaram ao surgimento de uma nova disciplina: a Termodinâmica 1 a Lei da Termodinâmica

Para entender melhor a 1 a Lei de Termodinâmica é preciso compreender as características dos sistemas termodinâmicos e os caminhos “percorridos” pelo calor. . .

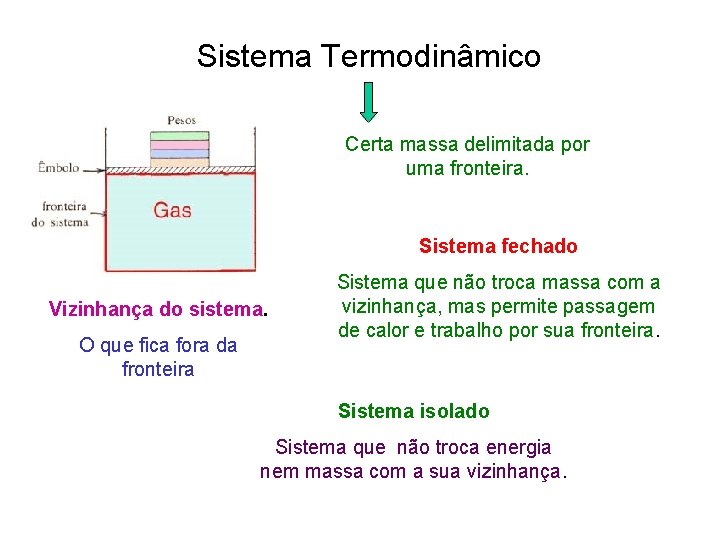
Sistema Termodinâmico Certa massa delimitada por uma fronteira. Sistema fechado Vizinhança do sistema. O que fica fora da fronteira Sistema que não troca massa com a vizinhança, mas permite passagem de calor e trabalho por sua fronteira. Sistema isolado Sistema que não troca energia nem massa com a sua vizinhança.

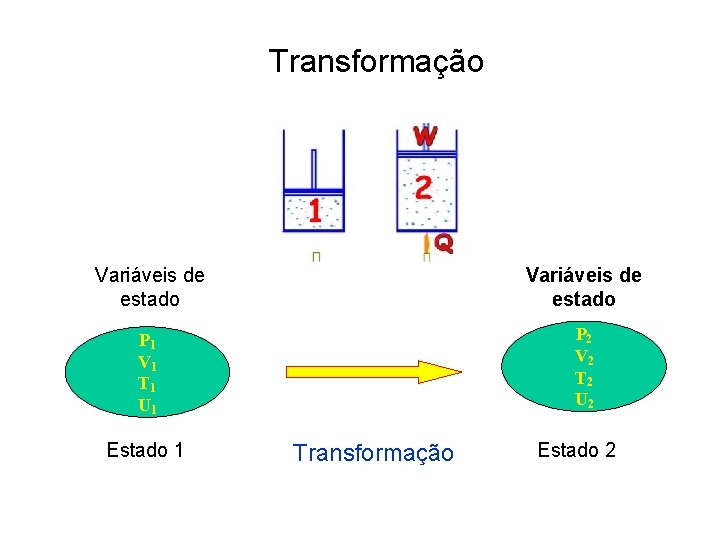
Transformação Variáveis de estado P 2 V 2 T 2 U 2 P 1 V 1 T 1 U 1 Estado 1 Transformação Estado 2

Processos “Caminho” descrito pelo sistema na transformação. P 1 V 1 T 1 U 1 Processos P 2 V 2 T 2 U 2 Durante a transformação Isotérmico temperatura invariável Isobárico Pressão invariável Isovolumétrico volume constante Adiabático É nula a troca de calor com a vizinhança.

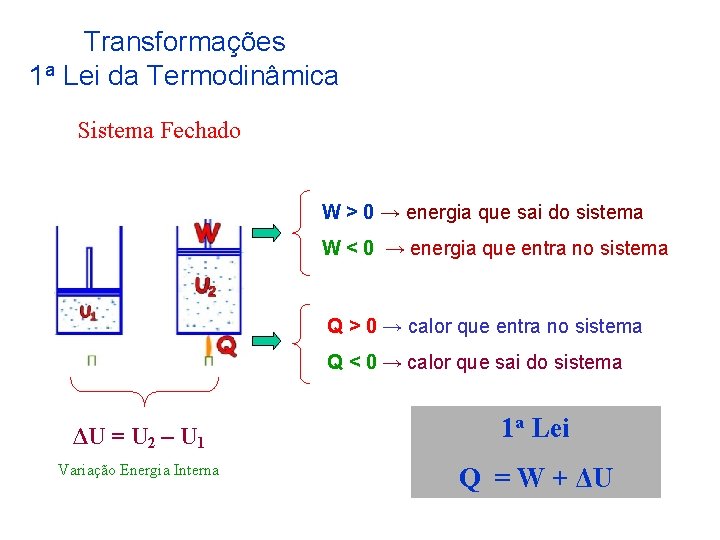
Transformações 1 a Lei da Termodinâmica Sistema Fechado W > 0 → energia que sai do sistema W < 0 → energia que entra no sistema Q > 0 → calor que entra no sistema Q < 0 → calor que sai do sistema ΔU = U 2 – U 1 Variação Energia Interna 1 a Lei Q = W + ΔU

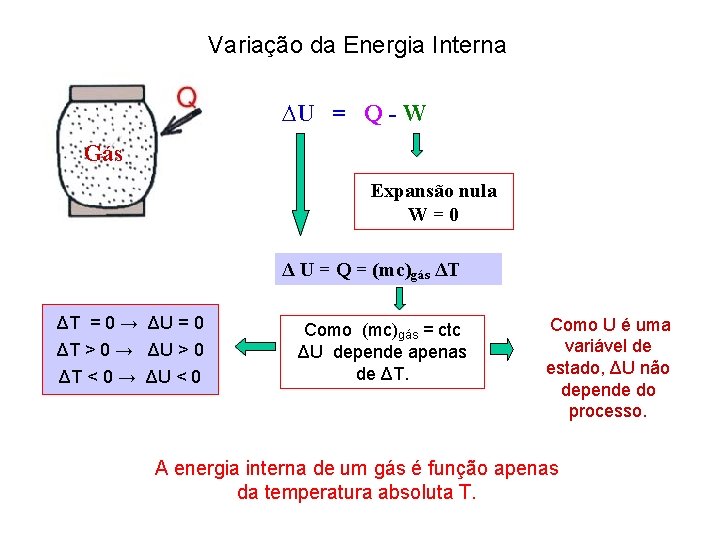
Variação da Energia Interna ∆U = Q - W Gás Expansão nula W = 0 Δ U = Q = (mc)gás ΔT ΔT = 0 → ΔU = 0 ΔT > 0 → ΔU > 0 ΔT < 0 → ΔU < 0 Como (mc)gás = ctc ΔU depende apenas de ΔT. Como U é uma variável de estado, ΔU não depende do processo. A energia interna de um gás é função apenas da temperatura absoluta T.

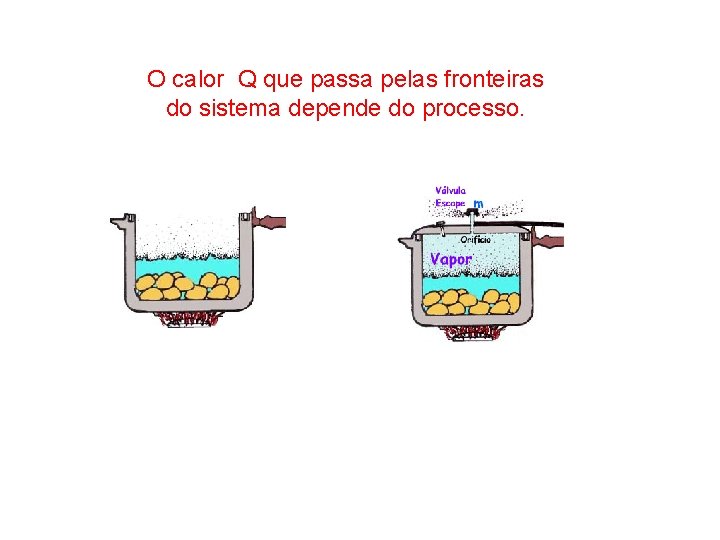
O calor Q que passa pelas fronteiras do sistema depende do processo.

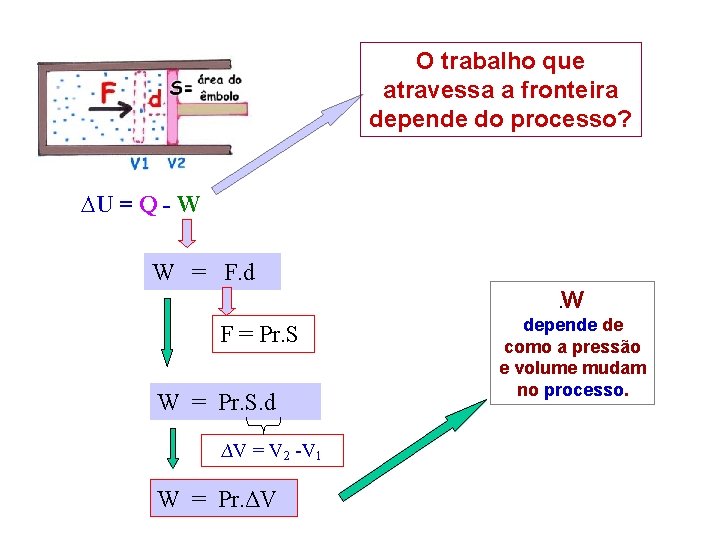
O trabalho que atravessa a fronteira depende do processo? ∆U = Q - W W = F. d. W F = Pr. S W = Pr. S. d ∆V = V 2 -V 1 W = Pr. ΔV depende de como a pressão e volume mudam no processo.

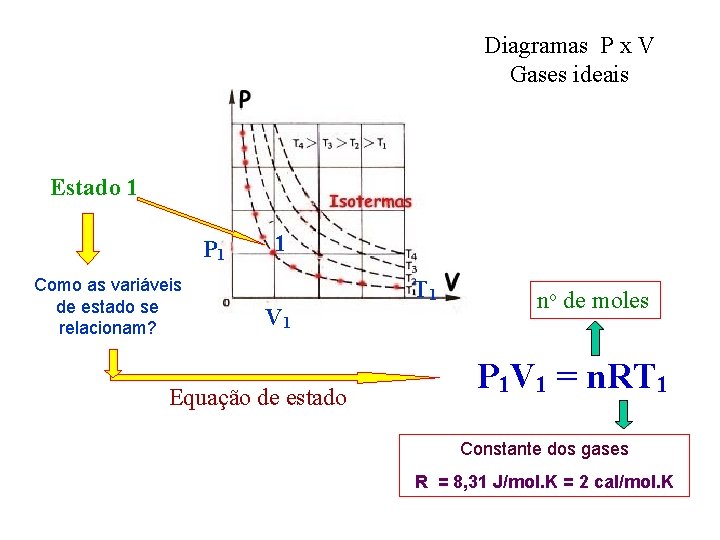
Diagramas P x V Gases ideais Estado 1 P 1 Como as variáveis de estado se relacionam? 1 T 1 V 1 Equação de estado no de moles P 1 V 1 = n. RT 1 Constante dos gases R = 8, 31 J/mol. K = 2 cal/mol. K

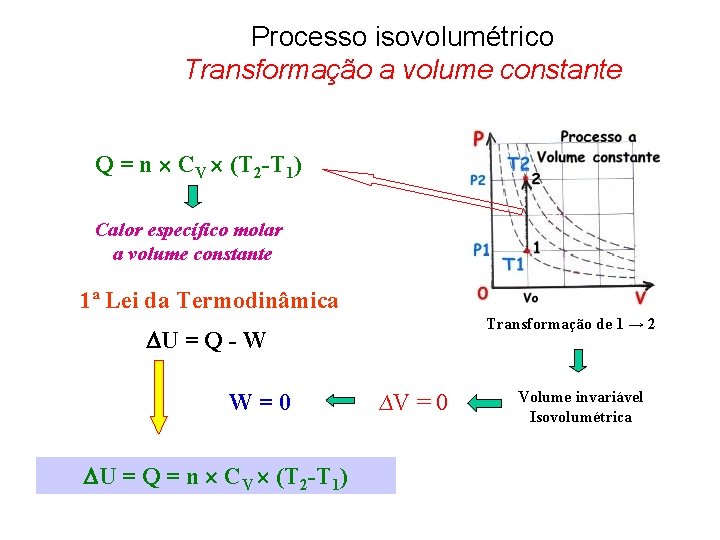
Processo isovolumétrico Transformação a volume constante Q = n CV (T 2 -T 1) Calor específico molar a volume constante 1ª Lei da Termodinâmica Transformação de 1 → 2 U = Q - W W = 0 U = Q = n CV (T 2 -T 1) ∆V = 0 Volume invariável Isovolumétrica

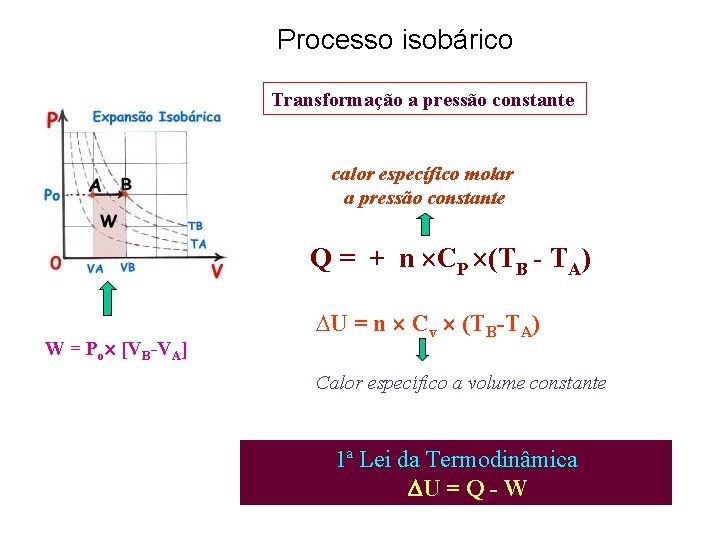
Processo isobárico Transformação a pressão constante calor específico molar a pressão constante Q = + n CP (TB - TA) W = Po [VB-VA] ∆U = n Cv (TB-TA) Calor específico a volume constante 1ª Lei da Termodinâmica U = Q - W

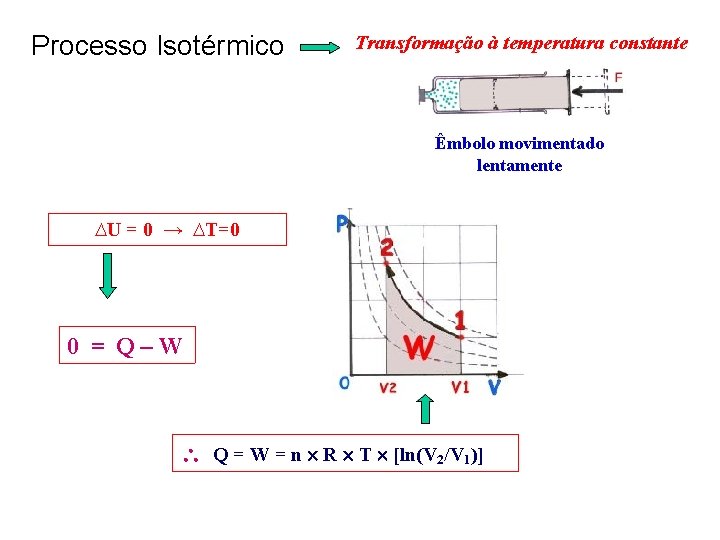
Processo Isotérmico Transformação à temperatura constante Êmbolo movimentado lentamente ∆U = 0 → ∆T=0 0 = Q – W Q = W = n R T [ln(V 2/V 1)]

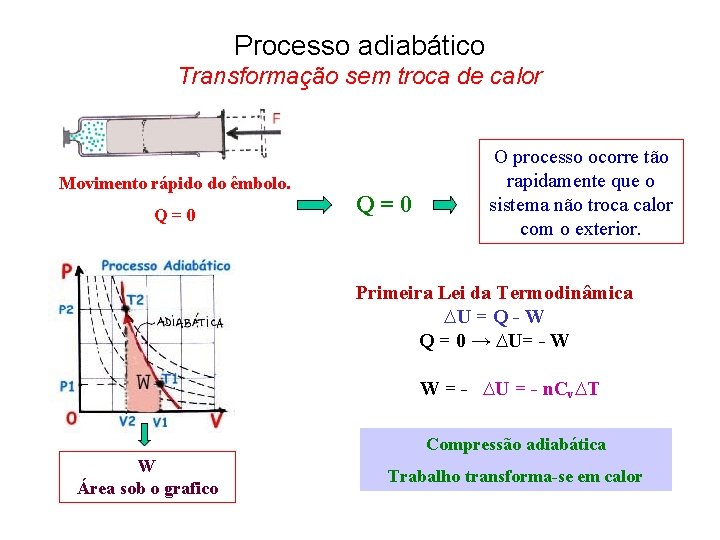
Processo adiabático Transformação sem troca de calor Movimento rápido do êmbolo. Q = 0 O processo ocorre tão rapidamente que o sistema não troca calor com o exterior. Primeira Lei da Termodinâmica ∆U = Q - W Q = 0 → ∆U= - W W = - ∆U = - n. Cv∆T Compressão adiabática W Área sob o grafico Trabalho transforma-se em calor

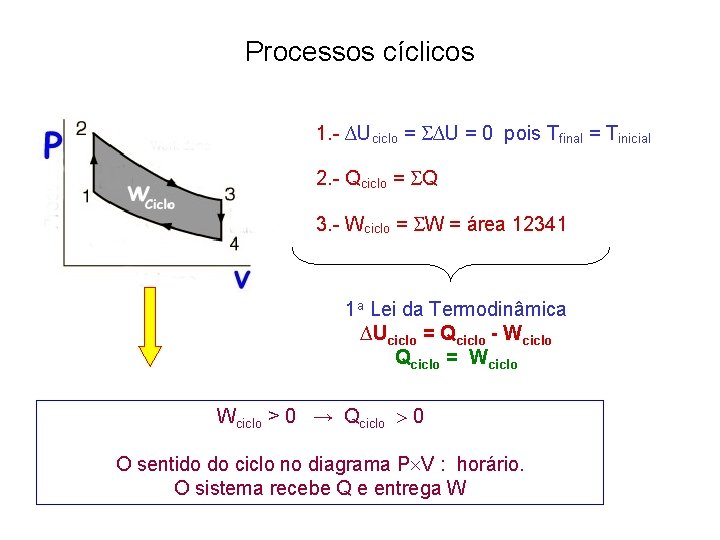
Processos cíclicos 1. - ∆Uciclo = ∆U = 0 pois Tfinal = Tinicial 2. - Qciclo = Q 3. - Wciclo = W = área 12341 1 a Lei da Termodinâmica ∆Uciclo = Qciclo - Wciclo Qciclo = Wciclo > 0 → Qciclo 0 O sentido do ciclo no diagrama P V : horário. O sistema recebe Q e entrega W

Máquinas Térmicas “Trabalham” em ciclos.

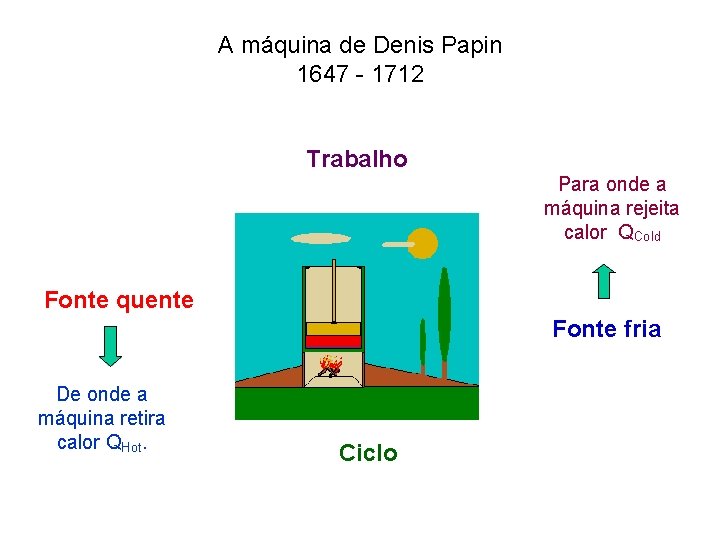
A máquina de Denis Papin 1647 - 1712 Trabalho Para onde a máquina rejeita calor QCold Fonte quente Fonte fria De onde a máquina retira calor QHot. Ciclo

Transformações máquinas térmicas - Diagrama PV

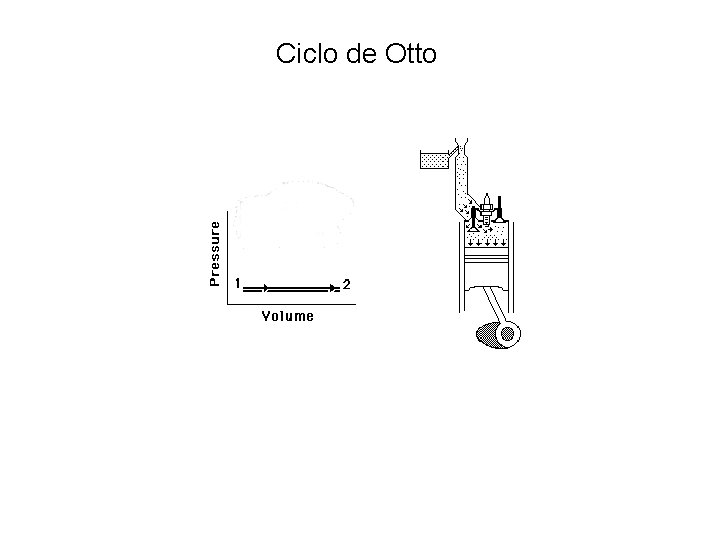
Ciclo de Otto

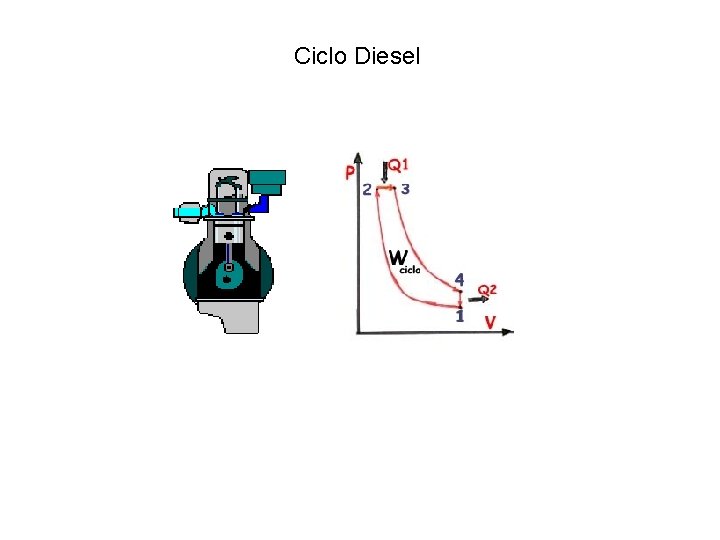
Ciclo Diesel

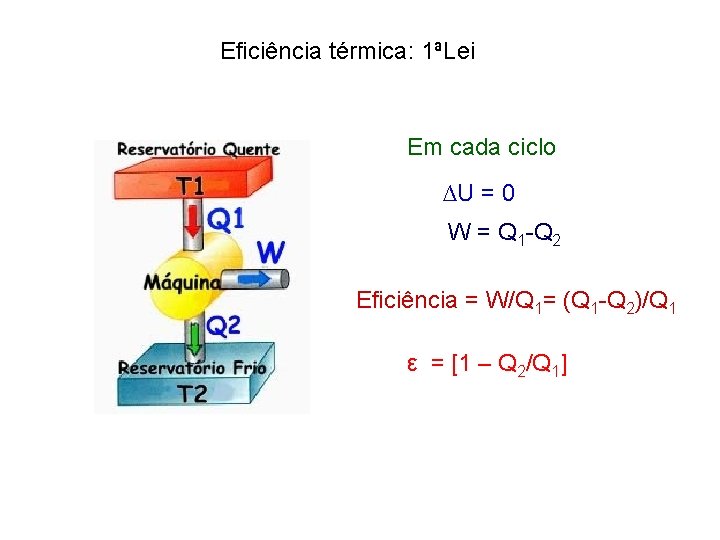
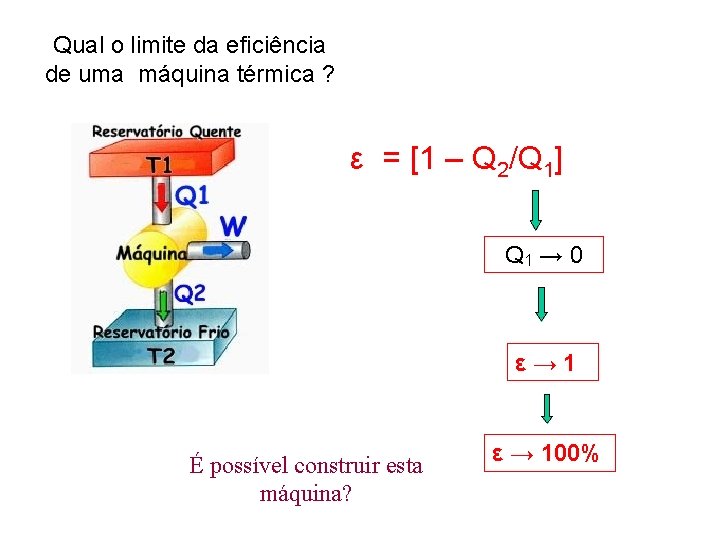
Eficiência térmica: 1ªLei Em cada ciclo ∆U = 0 W = Q 1 -Q 2 Eficiência = W/Q 1= (Q 1 -Q 2)/Q 1 ε = [1 – Q 2/Q 1]

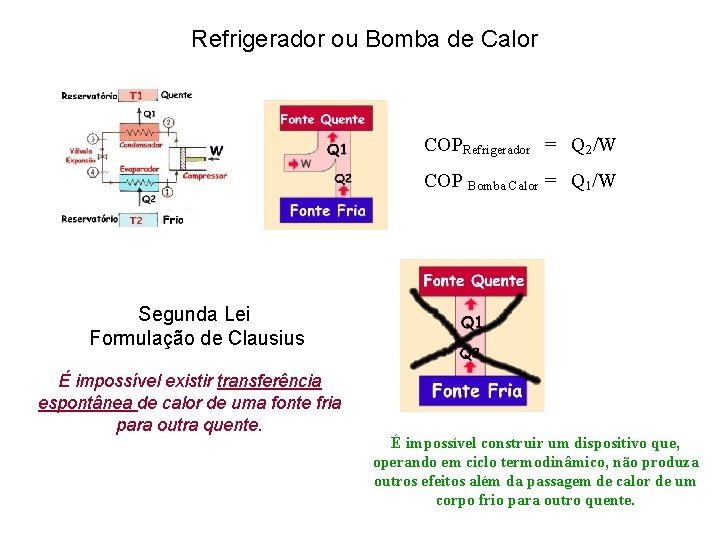
Ciclo Refrigerador Bomba de calor Refrigerador 12: compressão adiabática em um compressor 23: processo de rejeição de calor a pressão constante 34: estrangulamento em uma válvula de expansão (com a respectiva queda de pressão) 41: absorção de calor a pressão constante, no evaporador

COP - Coeficiente de Performance Primeira Lei da Termodinâmica Em cada ciclo ∆U = 0 → W + Q 2 = Q 1 W = Q 1 - Q 2 Coeficiente de Performance – COP refrigerador = Q 2/W = Q 2/(Q 1 - Q 2 ) = T 2/(T 1 – T 2) COP bomba calor = Q 1/W = Q 1/(Q 1 - Q 2 ) = T 1/(T 1 -T 2) Uma bomba de calor necessita de 1. 000 W da rede para funcionar e aquece 1 litro de água de 0, 5 o. C /s. Qual o COP desta bomba?

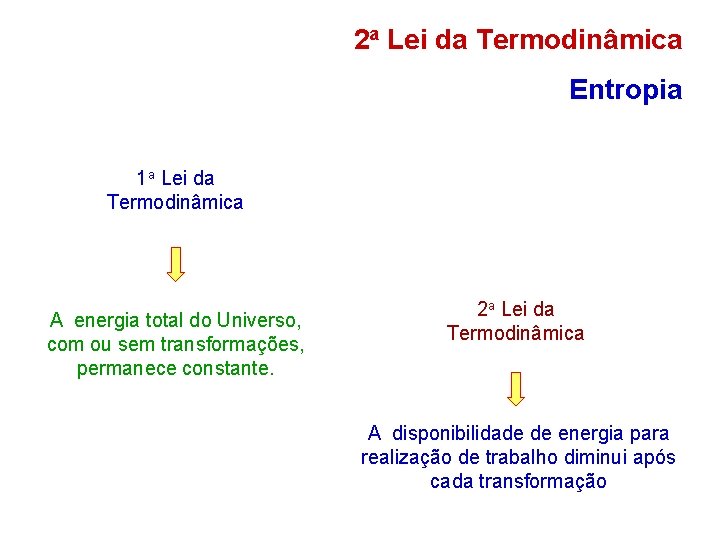
2 a Lei da Termodinâmica Entropia 1 a Lei da Termodinâmica A energia total do Universo, com ou sem transformações, permanece constante. 2 a Lei da Termodinâmica A disponibilidade de energia para realização de trabalho diminui após cada transformação

Refrigerador ou Bomba de Calor COPRefrigerador = Q 2/W COP Bomba Calor = Q 1/W Segunda Lei Formulação de Clausius É impossível existir transferência espontânea de calor de uma fonte fria para outra quente. É impossível construir um dispositivo que, operando em ciclo termodinâmico, não produza outros efeitos além da passagem de calor de um corpo frio para outro quente.

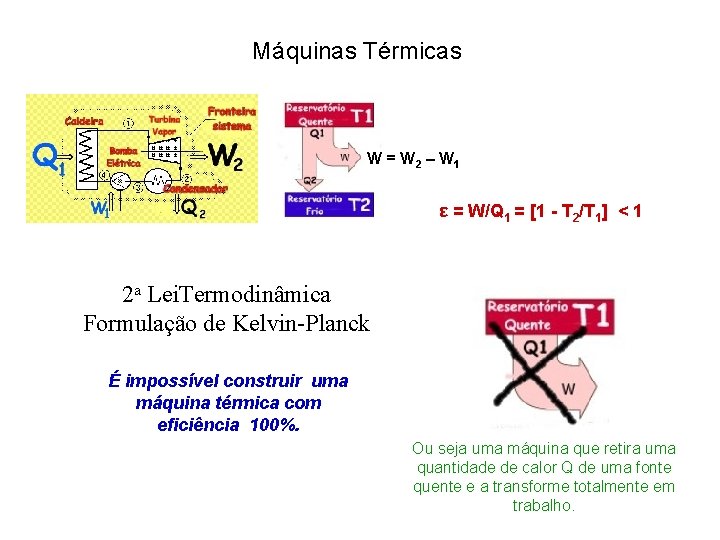
Máquinas Térmicas W = W 2 – W 1 ε = W/Q 1 = [1 - T 2/T 1] < 1 2 a Lei. Termodinâmica Formulação de Kelvin-Planck É impossível construir uma máquina térmica com eficiência 100%. Ou seja uma máquina que retira uma quantidade de calor Q de uma fonte quente e a transforme totalmente em trabalho.

Segunda Lei Termodinâmica Formulação de Clausius Formulação Kelvin-Planck É impossível existir transferência espontânea de calor de uma fonte fria para outra quente. É impossível construir uma máquina térmica com eficiência 100%. Ambas são afirmações negativas. Não podem ser demonstradas. Baseiam-se em evidências experimentais. A 2 a Lei enuncia a impossibilidade de construção de moto perpétuo de 2 a espécie. Moto Perpétuo 1 a Espécie: criaria trabalho do nada. Viola a 1 a Lei. 2 a Espécie: viola a 2 a Lei 3 a Espécie: inexistencia de atrito produziria movimento eterno sem realização de trabalho

Qual o limite da eficiência de uma máquina térmica ? ε = [1 – Q 2/Q 1] Q 1 → 0 ε → 1 É possível construir esta máquina? ε → 100%

Máquinas Térmicas 100% de rendimento ? Impossível! Qual o máximo rendimento de uma Máquina Térmica?

A construção de uma máquina ideal Definição de um processo ideal. Processo reversível. Aquele que tendo ocorrido, pode ser invertido de sentido e retornar ao estado original, sem deixar vestígios no sistema e no meio circundante. Processo reversível: desvio do equilíbrio é infinitesimal e ocorre numa velocidade infinitesimal.

Causas que tornam um processo irreversível. Atrito Expansão não resistida. Mistura de 2 substâncias diferentes. Outros fatores: Efeito Joule, Combustão, Histerese, etc. Troca de calor com diferença finita de temperatura. O processo de troca de calor pode ser reversível se for feita mediante diferença infinitesimal de temperatura, mas que exige tempo infinito ou área infinita. Conclusão: todos os processos reais de troca de calor são irreversíveis.

A máquina ideal de Carnot Ciclo reversível A eficiência da Máquina de Carnot No ciclo: ∆U=0 → W = Q 1 - Q 2 ε = W/Q 1 = [Q 1 -Q 2]/Q 1 = 1 - Q 2/Q 1 = T 2/T 1 BC e DA = adiabáticas ε = (1 - Q 2/Q 1) = (1 - T 2/T 1) ε = 1 - T 2/T 1 Princípio de Carnot "Nenhuma máquina térmica real, operando entre 2 reservatórios térmicos T 1 e T 2 , pode ser mais eficiente que a "máquina de Carnot" operando entre os mesmos reservatórios"

Entropia Rudolf Clausius Nasceu em Koslin (Polônia) e morreu em Bonn (Alemanha) Físico Teórico - Termodinâmica Apresentou em 1865 a sua versão para as 1 a e 2 a Leis da Termodinâmica. 1. - A energia do Universo é constante. 2. - A entropia do Universo tende a uma valor máximo. A quantificação da 2 a Lei

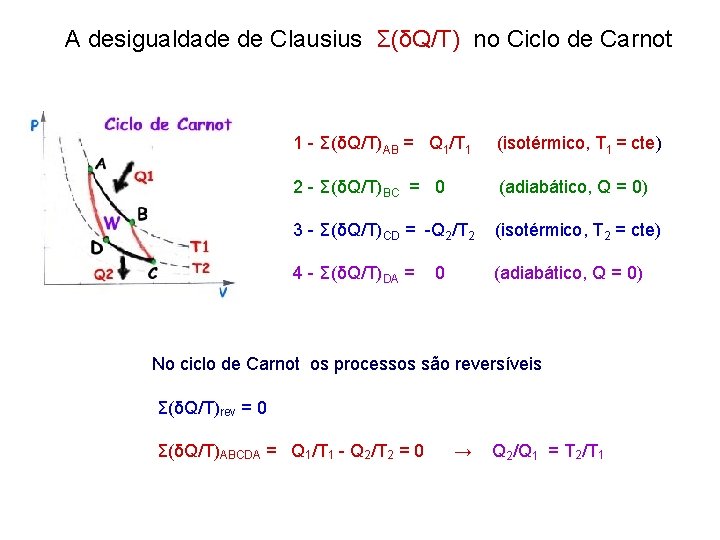
A desigualdade de Clausius (δQ/T)rev = 0 Σ(δQ/T) ≤ 0 Σ(δQ/T)irrev < 0

A desigualdade de Clausius Σ(δQ/T) no Ciclo de Carnot 1 - Σ(δQ/T)AB = Q 1/T 1 (isotérmico, T 1 = cte) 2 - Σ(δQ/T)BC = 0 (adiabático, Q = 0) 3 - Σ(δQ/T)CD = -Q 2/T 2 (isotérmico, T 2 = cte) 4 - Σ(δQ/T)DA = 0 (adiabático, Q = 0) No ciclo de Carnot os processos são reversíveis Σ(δQ/T)rev = 0 Σ(δQ/T)ABCDA = Q 1/T 1 - Q 2/T 2 = 0 → Q 2/Q 1 = T 2/T 1

Entropia, uma variável de estado No ciclo A 1 B 2 A Σ(δQ/T)A 1 B 2 A =Σ(δQ/T)A 1 B + Σ(δQ/T)B 2 A = 0 (I) No ciclo A 1 B 3 A Σ(δQ/T)A 1 B 3 A =Σ(δQ/T)A 1 B + Σ(δQ/T)B 3 A = 0 (II) Subtraindo-se (II) de (I) tem-se Σ(δQ/T)B 2 A = Σ(δQ/T)B 3 A Em outras "trajetórias"4, 5, . . . reversíveis entre A e B, o resultado seria Σ(δQ/T)B 2 A = Σ(δQ/T)B 3 A = Σ(δQ/T)B 4 A = Σ(δQ/T)B 5 A =. . . Existe uma “variável de estado”, além do V, P, T e U, que caracteriza cada estado térmico de um sistema termodinâmico: é a Entropia (símbolo: S) ∆S = Σ(δQ/T)rev SB –SA = Σ(δQ/T)rev

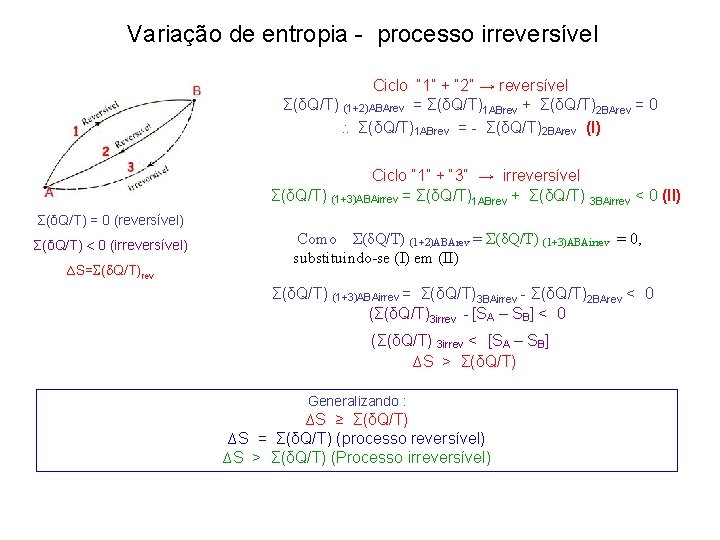
Variação de entropia - processo irreversível Ciclo “ 1” + “ 2” → reversível Σ(δQ/T) (1+2)ABArev = Σ(δQ/T)1 ABrev + Σ(δQ/T)2 BArev = 0 Σ(δQ/T)1 ABrev = - Σ(δQ/T)2 BArev (I) Ciclo “ 1” + “ 3” → irreversível Σ(δQ/T) (1+3)ABAirrev = Σ(δQ/T)1 ABrev + Σ(δQ/T) 3 BAirrev < 0 (II) Σ(δQ/T) = 0 (reversível) Σ(δQ/T) 0 (irreversível) ∆S= ( Q/T)rev Como Σ(δQ/T) (1+2)ABArev = Σ(δQ/T) (1+3)ABAirrev = 0, substituindo-se (I) em (II) Σ(δQ/T) (1+3)ABAirrev = Σ(δQ/T)3 BAirrev - Σ(δQ/T)2 BArev < 0 (Σ(δQ/T)3 irrev - [SA – SB] < 0 (Σ(δQ/T) 3 irrev < [SA – SB] ∆S > Σ(δQ/T) Generalizando : ∆S ≥ Σ(δQ/T) ∆S = Σ(δQ/T) (processo reversível) ∆S > Σ(δQ/T) (Processo irreversível)

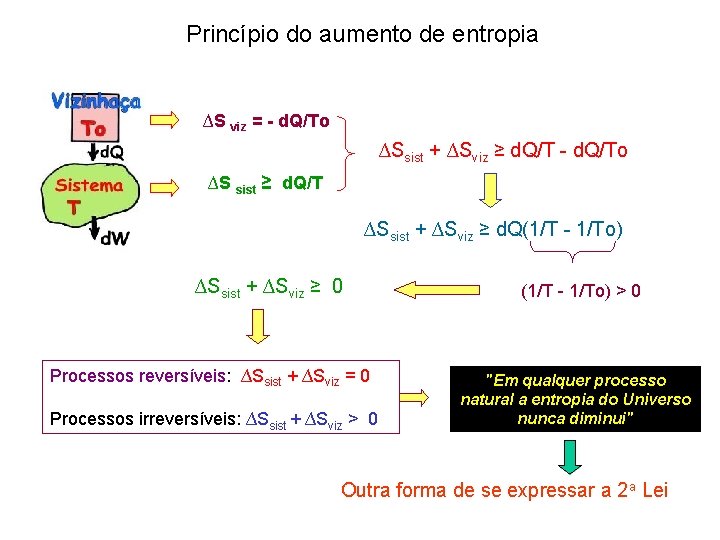
Princípio do aumento de entropia ∆S viz = - d. Q/To ∆Ssist + ∆Sviz ≥ d. Q/T - d. Q/To ∆S sist ≥ d. Q/T ∆Ssist + ∆Sviz ≥ d. Q(1/T - 1/To) ∆Ssist + ∆Sviz ≥ 0 Processos reversíveis: ∆Ssist + ∆Sviz = 0 Processos irreversíveis: ∆Ssist + ∆Sviz > 0 (1/T - 1/To) > 0 "Em qualquer processo natural a entropia do Universo nunca diminui" Outra forma de se expressar a 2 a Lei

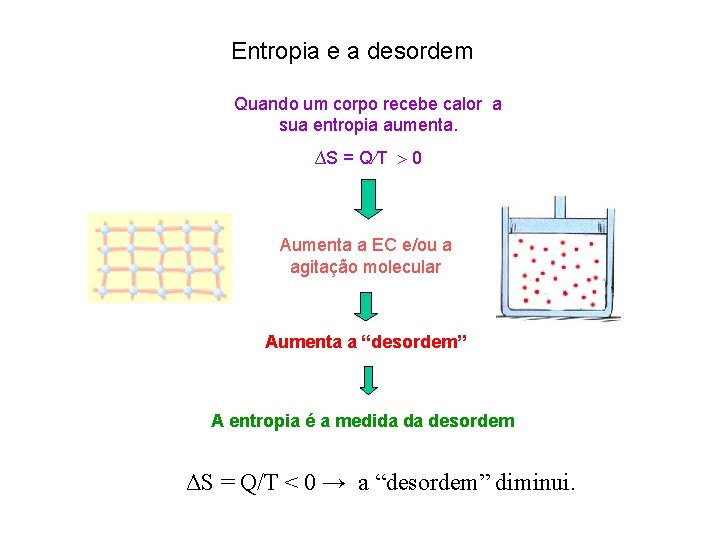
Entropia e a desordem Quando um corpo recebe calor a sua entropia aumenta. ∆S = Q T 0 Aumenta a EC e/ou a agitação molecular Aumenta a “desordem” A entropia é a medida da desordem ΔS = Q/T < 0 → a “desordem” diminui.

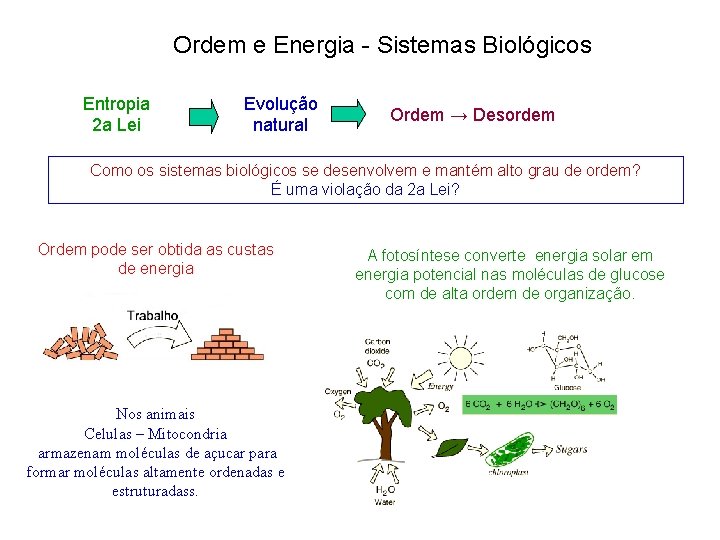
Ordem e Energia - Sistemas Biológicos Entropia 2 a Lei Evolução natural Ordem → Desordem Como os sistemas biológicos se desenvolvem e mantém alto grau de ordem? É uma violação da 2 a Lei? Ordem pode ser obtida as custas de energia Nos animais Celulas – Mitocondria armazenam moléculas de açucar para formar moléculas altamente ordenadas e estruturadass. A fotosíntese converte energia solar em energia potencial nas moléculas de glucose com de alta ordem de organização.

Boa Prova
 Brian furukawa
Brian furukawa Nica a
Nica a Adolf x nica
Adolf x nica Biomec nica
Biomec nica Nica
Nica Nica ny results
Nica ny results Arco supranasal
Arco supranasal Biomec nica
Biomec nica Peta konsep perjuangan mempertahankan kemerdekaan indonesia
Peta konsep perjuangan mempertahankan kemerdekaan indonesia Methodologies for cross-domain data fusion: an overview
Methodologies for cross-domain data fusion: an overview Avamar ndmp
Avamar ndmp Indian banking sector overview
Indian banking sector overview Set associative mapping in cache memory
Set associative mapping in cache memory Overview button
Overview button Overview of financial management
Overview of financial management Apple company profile
Apple company profile Data quality and data cleaning an overview
Data quality and data cleaning an overview Ospf overview
Ospf overview Gsm architecture diagram
Gsm architecture diagram What is project overview example
What is project overview example Overview of business environment
Overview of business environment Dr korson
Dr korson Lesson overview
Lesson overview Rfid technology overview
Rfid technology overview Definition of software testing
Definition of software testing Use case outline
Use case outline Overview of oracle architecture
Overview of oracle architecture Sap sd overview
Sap sd overview Steps of accounting process
Steps of accounting process Ajax overview
Ajax overview Papercut job tickerting print management
Papercut job tickerting print management Data cleaning problems and current approaches
Data cleaning problems and current approaches Basha high school graduation 2022
Basha high school graduation 2022 Overview of graphic communications
Overview of graphic communications Nagios tactical overview
Nagios tactical overview Maximo overview
Maximo overview Early years learning framework overview
Early years learning framework overview Solar system overview
Solar system overview Disadvantages of skimming reading
Disadvantages of skimming reading Exchange online protection overview
Exchange online protection overview Facts about psalm 119
Facts about psalm 119 Logic based testing
Logic based testing Avaya aura contact center overview ppt
Avaya aura contact center overview ppt Itil brief overview
Itil brief overview Data quality and data cleaning an overview
Data quality and data cleaning an overview



































































