FARMACOLOGA Y MONITORIZACIN DE FRMACOS INMUNOSUPRESORES EN TRASPLANTADOS





























- Slides: 35

FARMACOLOGÍA Y MONITORIZACIÓN DE FÁRMACOS INMUNOSUPRESORES EN TRASPLANTADOS RENALES Javier Gonzálvez Aracil, MIR-2

ÍNDICE 1. 2. INTRODUCCIÓN FÁRMACOS 1. 2. 3. Corticosteroides Anticuerpos antilinfocitarios Inmunosupresores xenobióticos. 1. 2. 4. 5. 3. 4. Inhibidores de la síntesis de purinas. Otros. PAUTAS DE TRATAMIENTO MONITORIZACIÓN 1. 2. 3. 5. Inhibidores de la calcineurina(INCA) Inhibidores de m. TOR Farmacocinética de los inmunosupresores Justificación de la monitorización Métodos analíticos MONITORIZACIÓN FARMACODINÁMICA.

INTRODUCCIÓN

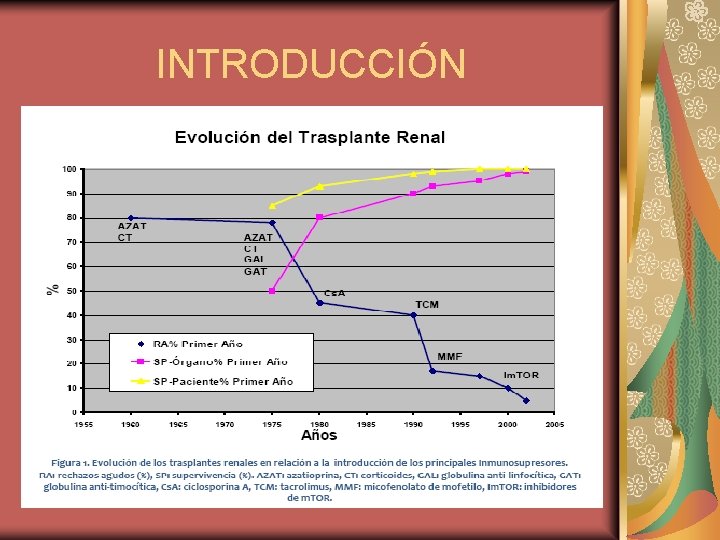
INTRODUCCIÓN El trasplante renal constituye la mejor solución ante una enfermedad renal en estado terminal, proporcionando los mejores resultados en términos de supervivencia y calidad de vida, y es la opción que presenta una relación costeefectividad más favorable. Los resultados han mejorado en los últimos treinta años por varios factores: los progresos en donación de órganos, la mejoría de la técnica quirúrgica y preservación de órganos, la mejor profilaxis antiinfecciosa, los mejores cuidados médicos y, fundamentalmente, por los avances en el tratamiento inmunosupresor.

INTRODUCCIÓN

INTRODUCCIÓN Actualmente nos encontramos un amplio arsenal terapéutico inmunosupresor. La principal dificultad consiste en adecuar el tratamiento a la situación de los receptores y a las características del órgano donado Los receptores, en un porcentaje elevado, son mayores de 65 años, portadores de otras patologías y en bastantes ocasiones son retrasplantados o hiperinmunizados. Por lo tanto, la individualización de la terapia es fundamental para la adaptación al receptor. El tratamiento inmunosupresor debe ser dinámico, adaptándose en cada situación a la evolución del trasplante renal.

FÁRMACOS

FÁRMACOS El objetivo del tratamiento inmunosupresor es la profilaxis del rechazo agudo/crónico en el paciente trasplantado y conseguir la máxima supervivencia del riñón y del paciente, con la mejor calidad de vida posible y con mínimos efectos adversos.

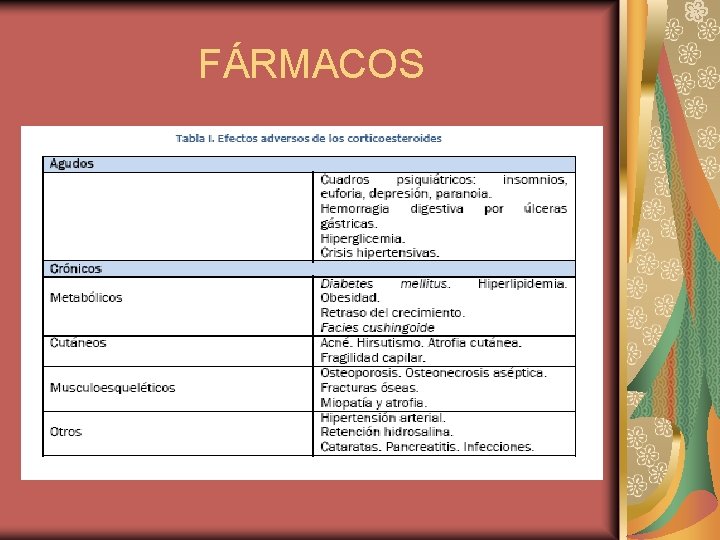
FÁRMACOS CORTICOSTEROIDES La prednisona, la prednisolona y la m-prednisolona son los corticosteroides más utilizados en el trasplante renal. El mecanismo de acción de los corticosteroides es dosis dependiente. A dosis altas son el tratamiento de primera línea de los episodios de rechazo agudo no complicado, por vía IV en bolos de mprednisolona consiguen la reversión de más del 70% de los rechazos agudos. A altas dosis, los efectos son rápidos. A dosis menores, por vía oral, se usan en terapias de inducción y mantenimiento y su mecanismo de acción de los se ejerce gracias a la unión con receptores citoplasmáticos. El complejo corticoidereceptor impide la activación del NF-k. B (factor nuclear potenciador de las cadenas ligeras kappa de las células B activadas), encargado de la transcripción y síntesis de moléculas de adhesión y citoquinas, lo que explica los efectos inmunosupresores y antiinflamatorios. Sobre las células presentadoras de antígenos (ACP) actúan inhibiendo la síntesis de las interleuquinas 1 y 6 (IL-1 e IL-6)

FÁRMACOS

FÁRMACOS ANTICUERPOS ANTILINFOCITARIOS Dentro de los anticuerpos antilinfocitarios podemos distinguir dos tipos: 1. Anticuerpos antilinfocitarios monoclonales a. Anticuerpo monoclonal OKT 3 Formando parte del TCR se encuentra el CD 3. El OKT 3 es un anticuerpo monoclonal murino anti-CD 3, que bloquea el reconocimiento antigénico e inhibe la función de los linfocitos T. En el momento actual Ka caído en desuso. b. Anticuerpos monoclonales anti-receptor de la IL-2 (anti-IL 2 R, anti-CD 25) La IL-2 es una citoquina sintetizada y secretada por linfocitos Th activados tras el reconocimiento del aloantígeno, fundamental para la proliferación clonal de los linfocitos Th y Tc Los IL-2 R, en la superficie de los linfocitos T, están constituido por tres subunidades: la subunidad alfa (CD 25), la subunidad ß (CD 122) y la subunidad γ (CD 132). La cadena alfa se expresa únicamente en los linfocitos T activados, siendo necesaria para que el IL-2 R sea de alta afinidad y se produzca la expansión clonal. Por tanto, los anticuerpos anti-CD 25 se dirigen únicamente hacia los linfocitos T activados y bloquea su expansión clonal IL-2. En la actualidad existen daclizumab (anti-CD 25, anticuerpo monoclonal humanizado) y basiliximab (anti-CD 25, anticuerpo monoclonal quimérico) y se administran por vía IV. Se encuentra disponible para su uso el basiliximab. No son útiles para el tratamiento del rechazo agudo, pero sí reducen su riesgo.

FÁRMACOS c. Alemtuzumab (Campath-1 H, Anti-CD 52) no se encuentra disponible en España. d. Rituximab (Anti-CD 20) El receptor de membrana CD 20 es una proteína expresada sólo a nivel de linfocitos B (LB) maduros. El rituximab es un anticuerpo monoclonal murino humanizado anti-CD 20. Este anticuerpo elimina a los LB mediante un lisis celular mediado por complemento. Su efecto persiste durante largo tiempo y no afecta a las células plasmáticas. En el del trasplante renal, se utiliza de forma compasiva en pautas de desensibilización HLA o trasplante ABO incompatible, tratamiento profiláctico del rechazo hiperagudo en pacientes hipersensibilizados, así como tratamiento del rechazo agudo y crónico mediado por anticuerpos. 2. Anticuerpos antilinfocitarios policlonales Existen dos tipos de sueros policlonales, la gammaglobulina antilinfocitaria (GAL) que se obtiene inmunizando caballos con linfoblastos humanos (actualmente en desuso) y la gammaglobulina antitimocítica (GAT, timoglobulinas) que se obtiene a partir de conejos inmunizados con timocitos. Una vez purificados, estos sueros reducen en número y en capacidad de respuesta las células inmunocompetentes. Se utiliza en pautas de inducción y en el tratamiento del rechazo agudo. Sin embargo, al ser proteínas heterólogas pueden producir anafilaxia, fiebre, escalofríos, diarrea, rash cutáneo, prurito, hipotensión, hemólisis, leucopenia y plaquetopenia y provocar la síntesis de anticuerpos antiglobulina de conejo en más del 70% de los pacientes. Esto implica una pérdida de efectividad posterior. Además, aumenta el riesgo de enfermedad por citomegalovirus, de síndrome linfoproliferativo en relación con el virus de Epstein-Barr (EBV), así como de linfomas no Hodgkin.

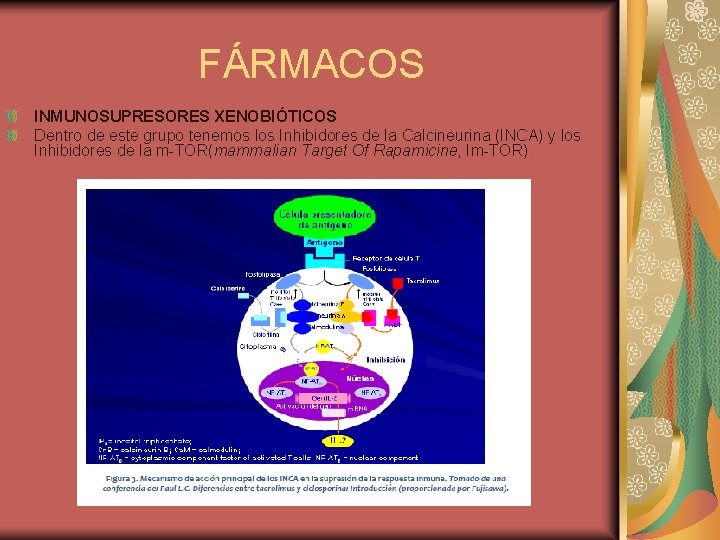
FÁRMACOS INMUNOSUPRESORES XENOBIÓTICOS Dentro de este grupo tenemos los Inhibidores de la Calcineurina (INCA) y los Inhibidores de la m-TOR(mammalian Target Of Rapamicine, Im-TOR).

FÁRMACOS 1. Inhibidores de la calcineurina (INCA) Son la ciclosporina A que es un endecapéptido cíclico y el tacrolimus, un macrólido lactónico. En trasplante renal, los INCA se utilizan en terapia de inducción y de mantenimiento. Son insolubles en agua y muy solubles en disolventes orgánicos, y comparten el mismo mecanismo de acción, aunque el tacrolimus es mucho más potente. Se unen a unas proteínas citoplasmáticas conocidas como inmunofilinas, e inhiben la acción de la calcineurina y la transcripción de los genes que codifican la síntesis de IL-2, receptores de IL-2, IL-4 e interferón γ. . El principal problema tanto de la ciclosporina A como del tacrolimus es su nefrotoxicidad, debido a un efecto vasoconstrictor sobre la arteriola aferente y eferente. Esto puede ser reversible (disminuyendo la dosis de INCA), o bien puede volverse crónico, si se mantienen niveles elevados.

FÁRMACOS 2. Inhibidores de m-TOR (Im-TOR, mammalian target of rapamycin) son la rapamicina o sirolimus y el everolimus. El sirolimus es un macrólido lactónico y el everolimus es un derivado del sirolimus obtenido para mejorar algunas propiedades farmacocinéticas. La diferencia fundamental es su vida media: la del sirolimus es de 60 horas y se administra una vez al día y la del everolimus es la mitad y debe administrarse cada 12. Ambos fármacos tienen una potencia inmunosupresora similar, igual mecanismo de acción y perfil de seguridad. Se utilizan en terapias de inducción y sobre todo en pautas de mantenimiento junto a un INCA o en pautas de conversión sustituyéndolo. El mecanismo de acción consiste en la inhibición de la proliferación de LT y LB activados mediante su unión a la FKBP 12, y este complejo inhibe a la m-TOR que es la enzima clave para poner en marcha el paso de la fase G 1 a S del ciclo celular, impidiendo la progresión del ciclo celular, así como la respuesta celular a otras citoquinas como IL-11, G-CSF y eritropoyetina. Son fármacos no nefrotóxicos, aunque pueden potenciar la nefrotoxicidad causada por ciclosporina A. Actúan de manera sinérgica con INCA obligando al uso de dosis más bajas de éstos. Los efectos adversos son dosis dependientes. Los de mayor relevancia mielosupresión (especialmente anemia), hiperlipidemia (controlable con estatinas), edema, proteinuria y neumonitis que, cuando se presenta, requiere la retirada del fármaco. El uso de estos fármacos se asocia con una menor incidencia de infección por CMV, propiedades antineoplásicas y efectos beneficiosos sobre la aparición y expansión clonal de linfocitos T reguladores.

FÁRMACOS 4. INHIBIDORES DE LA SÍNTESIS DE PURINAS Estos medicamentos se utilizan en pautas de inducción y mantenimiento junto con los INCA como profilaxis de rechazo agudo, para minimizar o eliminar esteroides y reducir nefrotoxicidad. Pueden usarse asociados a Im. TOR sin INCA. 2. 4. 1. Azatioprina Es un derivado imidazólico de la 6 -mercaptopurina, cuyo mecanismo de acción consiste en el bloqueo de la síntesis de los ácidos adenílico y guanílico lo cual impide la síntesis de ADN y ARN en linfocitos T y B activados, bloqueando su proliferación. Su principal efecto adverso es la mielotoxicidad, especialmente la leucopenia. No debe administrarse con alopurinol porque puede provocar aplasia medular. Su uso prolongado se asocia con hepatotoxicidad y carcinomas cutáneos. Su uso es mínimo debido a que hay otros fármacos con mejor perfil de seguridad. 2. 4. 2. Micofenolato de mofetilo y micofenolato sódico con recubrimiento entérico(MPS) Son profármacos del ácido micofenólico que es el auténtico principio activo. Ambos están indicados en terapias de inducción y mantenimiento. Es un inhibidor no del enzima inosina-monofosfato-deshidrogenasa (IMPDH) e interfiere la síntesis “de novo” de guanina y la replicación de ADN en linfocitos activados. Además el ácido micofenólico es capaz de inhibir la síntesis de anticuerpos y también la transferencia de residuos de fucosa y manosa a moléculas de adhesión, disminuyendo la capacidad de fijación de los linfocitos al endotelio. Esto podría explicar su utilidad en el tratamiento del rechazo agudo y del rechazo agudo refractario a esteroides. Los efectos adversos son dosis dependientes, los más frecuentes son diarrea, molestias gastrointestinales, toxicidad medular especialmente anemia y trombopenia. El objeto de la formulación de MPS es minimizar los efectos gastrointestinales. Estos fármacos no son nefrotóxicos aunque aumentan la incidencia de infección por CMV.

FÁRMACOS 5. OTROS Estos fármacos o bien no están disponibles en el Estado Español, o están en fase de estudio, o se utilizan por le momento en otras patologías 1. 2. 3. 4. 5. 6. Belatacept: se une a CD 80 y CD 86 e impide que estos se unan a CD 28, bbloqueando la señal coestimuladora Alefacept: inhibe la adhesión de LT. En estudio Sotrastaurina: inhibidor de la protein-quinasa C. Podría evitar el rechazo agudo. Bortezomib: inhibidor del proteosoma, para MM. Posible uso en rechazo agudo humoral. Eculizumab: ac frente a C 5 a. Se usa en rechazo humoral agudo de mal pronóstico además de HPN y SHU. Tofacitinib: inhibidor de JAK-3. Esta enzima solo se expresa en LT y LB activados, responsables del rechazo. Su efecto secundario principal es anemia, al bloquear en parte a JAK-2

PAUTAS DE TRATAMIENTO

PAUTAS DE TRATAMIENTO 1. PAUTA DE INDUCCIÓN Se trata de pautas que se usan al principio, basadas en agentes biológicos, que se aplican durante un breve espacio de tiempo y luego se completa su acción con INCA o Im. TOR, derivados del ácido micofenólico y corticosteroides. La inducción es muy utilizada en trasplante renal y se asocia a un descenso de rechazo agudo aunque no se deriva una mayor tasa de supervivencia del injerto a largo plazo. La inducción más habitual en pacientes que no presenten riesgo, utiliza un anticuerpo antilinfocitario (anti-CD 25), corticoides, tacrolimus y un inhibidor de la IMPDH. Esta pauta permite en muchos casos la retirada de corticoides. A la hora de implantar una pauta hay que tener en cuenta características del receptor (como su riesgo inmunológico), y del órgano trasplantado (donante cadáver o vivo, tiempo de isquemia fría…).

PAUTAS DE TRATAMIENTO 2. PAUTA DE MANTENIMIENTO Están basadas generalmente en los INCA, siendo la pauta más habitual la de tacrolimus, un inhibidor de la IMPDH con o sin esteroides. Actualmente, se considera a pauta más segura y eficaz la de inducción con anti-CD 25, corticoides, dosis reducidas de tacrolimus y ácido micofenólico. La mejora de la supervivencia al año es evidente pero después ocurre un 4 -5% de pérdida anual del trasplante (similar al de la terapia con azatioprina). Esto se debe, sobre todo, a disfunción crónica del injerto o a la muerte del paciente con injerto funcionante. En el momento actual la vida media del trasplante renal de donante cadáver está en unos 13 años. La implantación de estas pautas requiere un estrecho seguimiento clínico y del control del tratamiento y para ello la monitorización terapéutica de los medicamentos inmunosupresores por el laboratorio resulta fundamental

MONITORIZACIÓN

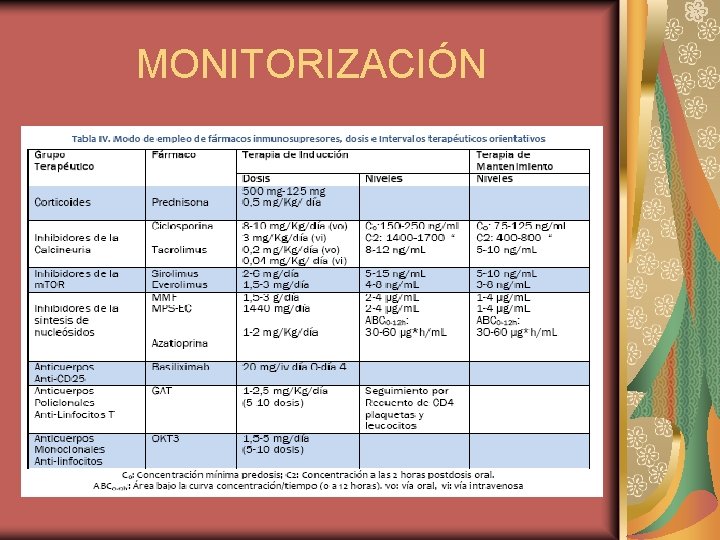
MONITORIZACIÓN La utilización de estos fármacos supone un riesgo, ya que la infradosificación aumenta la probabilidad de rechazo agudo y la sobredosificación puede significar una inmunosupresión excesiva, ocasionando la aparición de infecciones, enfermedades malignas o efectos adversos que pueden poner en peligro la vida del paciente, la supervivencia del injerto por nefrotoxicidad o comprometer la función de otros órganos. La monitorización terapéutica de inmunosupresores consiste en garantizar que la dosis administrada es adecuada para alcanzar y mantener unas concentraciones que supriman la respuesta aloinmune, mientras que se evita la toxicidad relacionada con una inmunosupresión excesiva y unos efectos adversos secundarios a su concentración. En el momento actual, los inmunosupresores que habitualmente están sujetos a monitorización terapéutica de sus concentraciones en sangre son los INCA: ciclosporina A y tacrolimus, los Im. TOR: sirolimus y everolimus y el inhibidor de la IMPDH, ácido micofenólico.

MONITORIZACIÓN CARACTERÍSTICAS FARMACOCINÉTICAS DE INCA E IMTOR. Los INCA e Im. TOR, presentan una biodisponibilidad oral baja y variable entre 10 -30%. Sufren metabolismo de primer paso a nivel intestinal y los alimentos tienden a disminuir su absorción, especialmente las grasas. Estos medicamentos son lipofílicos, presentan un volumen de distribución alto y se distribuyen ampliamente en el interior de los hematíes. La fracción plasmática se une a lipoproteínas, en un 9899%. El tiempo para alcanzar la Cmax oscila entre 1, 5 -2 horas. Presentan metabolismo hepático, a cargo de CYP 3 A 4/5. En relación a la vida media (t 1/2), los INCA entre 16 y 18 horas, y los Im. TOR, el sirolimus 60 horas y el everolimus menor de 30 horas. Se elimina en forma de metabolitos por vía biliar y el aclaramiento de estos fármacos no está influido por la insuficiencia renal (IR).

MONITORIZACIÓN CARACTERÍSTICAS FARMACOCINÉTICAS DEL ÁCIDO MICOFENÓLICO (AMF) La biodisponibilidad oral del MMF es del 94% y parece que no se afecta por los alimentos. El metabolismo es hepático, por glucuronidación, dando lugar al G-AMF. El volumen de distribución del ácido micofenólico es aproximadamente 3, 6 L/Kg. El 99, 9% del AMF se encuentra en el plasma, unido a proteínas en un 97 -98%, sobre todo albúmina. El G-AMF también se une mayoritariamente a la albúmina, un 82 -84%. Por tanto, este metabolito compite con el AMF por su unión a la albúmina. El tiempo para alcanzar la Cmax oscila entre 0, 5 y 2 horas. La vida media está en 16 h. La vía de eliminación mayoritaria es la renal. En IR se acumula el G-AMF.

MONITORIZACIÓN JUSTIFICACIÓN DE LA MONITORIZACIÓN DE CONCENTRACIONES SANGUÍNEAS 1. Variabilidad farmacocinética de los inmunosupresores La causa fundamental es que existe una alta variabilidad farmacocinética intra- e interindividual. Las principales causas que contribuyen a esta variabilidad farmacocinética, y por tanto a la falta de correlación entre dosis y nivel de inmunosupresores son: Las interacciones medicamentosas El paciente trasplantado renal, es un paciente con politerapia, tanto con inmunosupresores como de otros tipos, y esta es la principal razón para que se interacciones medicamentosas.

MONITORIZACIÓN JUSTIFICACIÓN DE LA MONITORIZACIÓN DE CONCENTRACIONES SANGUÍNEAS 1. Variabilidad farmacocinética de los inmunosupresores Polimorfismo Genético el polimorfismo genético de determinadas proteínas que intervienen en el metabolismo y disposición de estos fármacos. Como es el caso de las isoenzimas del CYP 3 A (3 A 4 y 3 A 5) y de la Gp-P. El que les afecta es el polimorfismo de un nucleótido (P 1 N), que originan distintas variantes alélicas, que según se expresen influyen en el metabolismo y eliminación de los inmunosupresores. Esto puede explicar las diferencias étnicas en la farmacocinética de estos medicamentos. Pacientes de raza negra o hispanoamericanos no blancos, necesitan dosis mayores que los caucásicos, debido a que expresan más frecuentemente la isoenzima CYP 3 A 5. 2. Intervalo terapéutico estrecho Hablar de intervalos terapéuticos en sentido clásico resulta complicado, mejor hablar de concentraciones diana propuestas, ya que las concentraciones de los inmunosupresores varian en función de distintas condiciones: situación del paciente postrasplante (inducción o mantenimiento), pauta de inmunosupresión y su situación fisiopatológica. Ttodas estas circunstancias hacen que cada equipo adopte unas concentraciones diana variables.

MONITORIZACIÓN JUSTIFICACIÓN DE LA MONITORIZACIÓN DE CONCENTRACIONES SANGUÍNEAS 3. Vigilar el cumplimiento del tratamiento 4. Individualización de las concentraciones de inmunosupresores El parámetro farmacocinético que mejor refleja el grado de exposición del paciente a la acción del fármaco es el área bajo la curva concentración/tiempo pero su obtención no es posible debido a que es necesario obtener un número alto de muestras durante un intervalo y resulta incómodo para el paciente y complicado para el laboratorio. Lo que se hace es obtener una muestra basal pre-dosis (Cmin) y suponer que la Cmin correlaciona con el área bajo la curva y por tanto refleja la exposición del paciente a la acción del fármaco. En el caso de tacrolimus, sirolimus o everolimus, sí existe correlación , pero no para la ciclosporina A o ácido micofenólico, y para individualizar mejor la dosificación se recurre a otras estrategias de muestreo. En la ciclosporina A se ha encontrado una relación entre el área bajo la curva durante las primeras cuatro horas y la concentración del punto obtenido a las dos horas tras la dosis de ciclosporina A (C 2); este punto sería el que mejor predice la exposición al fármaco y el área bajo la curva total. Por tanto la C 2 sería el parámetro ideal para el ajuste de la dosis. En el caso del ácido micofenólico se observa una amplia variabilidad y se han estudiado estrategias de 3 o 4 muestras aplicando algoritmos matemáticos.

MONITORIZACIÓN

MONITORIZACIÓN MÉTODOS ANALÍTICOS Existen dos métodos: cromatográficos (por HPLC) o inmunológicos, bien isotópicos o bien no isotópicos (detección enzimática o inmunoturbidimetría) El método debe ser específico frente al fármaco original, siendo los de referencia los cromatográficos, pero los inmunológicos tienen un buen rendimiento analítico aunque hay que tener siempre en cuenta la posible reactividad cruzada de los anticuerpos con los metabolitos del fármaco a analizar.

MONITORIZACIÓN MÉTODOS ANALÍTICOS: RECOMENDACIONES Es recomendable que los laboratorios estén en algún programa de acreditación externa de la calidad que garantice su aptitud. Resulta interesante además, porque permite extraer conclusiones sobre los métodos analíticos. La sangre total anticoagulada con EDTA es la muestra ideal para ciclosporina A, tacrolimus y sirolimus/everolimus. En cambio, para el AMF es mejor el plasma. La muestras deben obtenerse en el estado estacionario y la frecuencia de las determinaciones por lógica, será superior en las primeras semanas (2 -3 por semana) disminuyéndola posteriormente. Se recomienda medir los niveles de INCA cada dos días durante el postoperatorio inmediato hasta alcanzar los niveles esperados.

MONITORIZACIÓN FARMACODINÁMICA

MONITORIZACIÓN FARMACODINÁMICA La monitorización farmacodinámica a proporciona una valoración del efecto biológico en el lugar de acción. Por desgracia, esto no es siempre factible. Los métodos presentan muchas limitaciones: baja estandarización (la mayoría de los laboratorios utilizan métodos propios), consumen mucho tiempo y recursos, están sometidos a amplia variabilidad analítica, son difíciles de implantar en la rutina y están poco validados clínicamente. Además, la monitorización farmacodinámica está restringida a laboratorios muy especializados. El futuro de la monitorización terapéutica posiblemente tienda a un equilibrio entre las determinaciones farmacocinéticas, farmacodinámicas y farmacogenéticas, entendidas como el estudio del soporte genético implicado en la disposición de estos fármacos, que nos lleven a la utilización de pautas inmunosupresoras cada vez más individualizadas.

ANEXO En nuestro hospital no se realizan transplantes, por lo tanto la pauta de tratamientos viene indicada desde el HGUA el Dr. Peset de València o el Clínic de Barcelona (en caso de doble transplante de riñón y páncreas). Los nefrólogos, por lo tanto, son los que hacen el seguimiento y el ajuste de dosis, pero sin cambiar los fármacos. Además de corticoides, los fármacos que más ven pautados son ciclosporina A, tacrolimus, de los que SÍ piden niveles, azatioprina y AMF, de los que NO suelen pedir niveles. Del resto de fármacos, hay algún paciente que tiene pautado everolimus.

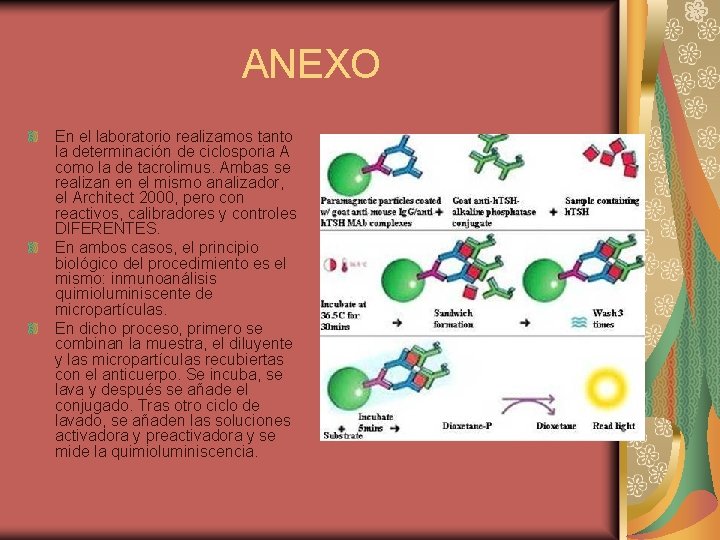
ANEXO En el laboratorio realizamos tanto la determinación de ciclosporia A como la de tacrolimus. Ambas se realizan en el mismo analizador, el Architect 2000, pero con reactivos, calibradores y controles DIFERENTES. En ambos casos, el principio biológico del procedimiento es el mismo: inmunoanálisis quimioluminiscente de micropartículas. En dicho proceso, primero se combinan la muestra, el diluyente y las micropartículas recubiertas con el anticuerpo. Se incuba, se lava y después se añade el conjugado. Tras otro ciclo de lavado, se añaden las soluciones activadora y preactivadora y se mide la quimioluminiscencia.