Estructura tridimensional de macromolculas su determinacin usando difraccin



























- Slides: 45


Estructura tridimensional de macromoléculas : su determinación usando difracción de rayos X o se trata de biología estructural…?

Las estructuras secundarias y terciarias de las macromoléculas, conllevan información clave para determinar las funciones bioquímicas y celulares mioglobina Proteína A

Sitios activos en 3 D Diagrama 2 D

Ecosistemas Comunidades Ecología In vitro In vivo Poblaciones Organismos Fisiología Tejidos Histología Células Moléculas Atomos Biología celular Biología molecular / bioquímica Biología estructural

Biología estructural Técnicas biofísicas : • Cristalografía de rayos X • Calorimetría • Microscopía electrónica • ≠ técnicas espectroscópicas (CD, EPR, …) • RMN • Espectroscopía de masa • Dispersión de luz • Espectrofluorometría • ………….

Biología estructural La estructura 3 D de moléculas biológicas nos permite contribuir a entender : • qué moléculas interactúan? cómo? • rearreglos conformacionales disparados por la interacción • cómo hacen las enzimas para catalizar reacciones?

…para describir la forma (y la topología) de algo, lo mejor es… MIRARLO! Es muy pequeño? … usá un microscopio … lentes imagen objeto

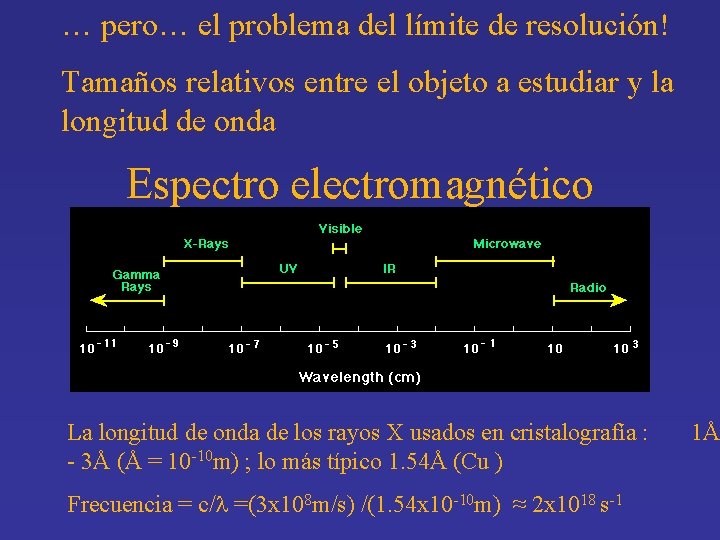
… pero… el problema del límite de resolución! Tamaños relativos entre el objeto a estudiar y la longitud de onda Espectro electromagnético La longitud de onda de los rayos X usados en cristalografía : - 3Å (Å = 10 -10 m) ; lo más típico 1. 54Å (Cu ) Frecuencia = c/ =(3 x 108 m/s) /(1. 54 x 10 -10 m) ≈ 2 x 1018 s-1 1Å

… pero, no podemos (aún? ) fabricar un microscopio de rayos X : • no hay lentes • aun si las tuviéramos, deberíamos poder pulirlas con una precisión mejor a 0. 1Å!! Necesitamos aprender a interpretar los patrones de difracción de rayos X (no refocalizados), para reconstruir la distribución de densidad electrónica que difractó

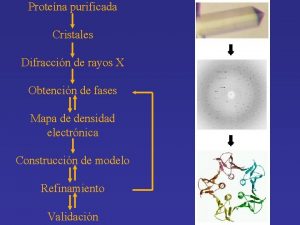
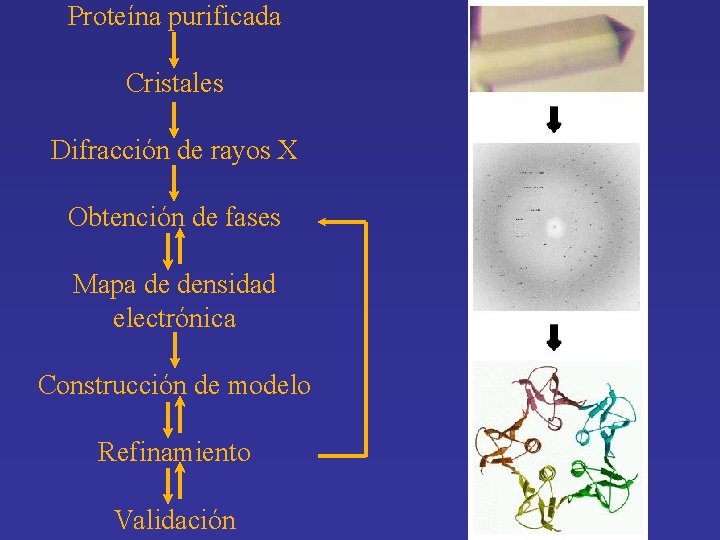
Proteína purificada Cristales Difracción de rayos X Obtención de fases Mapa de densidad electrónica Construcción de modelo Refinamiento Validación

Institut Pasteur de Montevideo X RAY DIFFRACTION FACILITY

Setup experimental para hacer difraccion de cristales unicos Resultado experimental: estructuras a resolucion atomica

Qué es un cristal? • La materia se clasifica en gases, líquidos y sólidos • (también hay mezclas homogéneas que están digamos "en el medio"!! coloides, sólidos amorfos, etc) • Sólidos: volumen fijo, incompresibles, comportamientos anisotrópicos interacciones intermoleculares fuertes orden

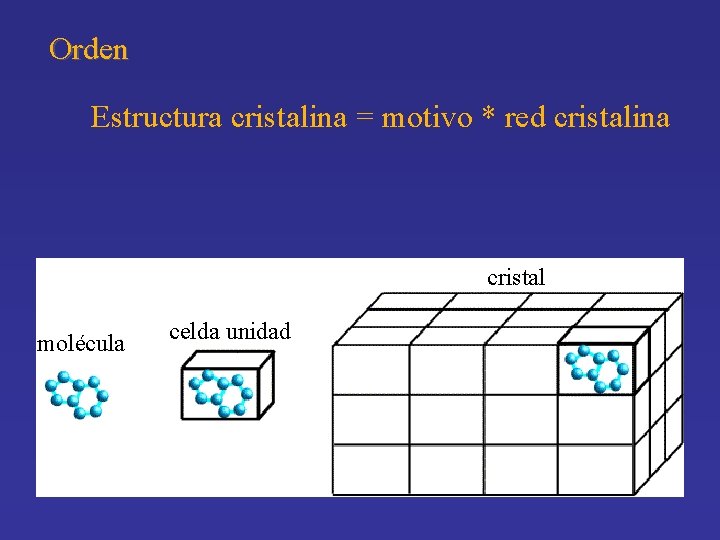
Orden • Explica el comportamiento anisotrópico (óptico, mecánico, magnético, eléctrico, etc) • Arreglo ordenado a largas distancias entre moléculas (simetría, capas o planos moleculares) Estructura cristalina = motivo * red cristalina

Orden Estructura cristalina = motivo * red cristalina cristal molécula celda unidad

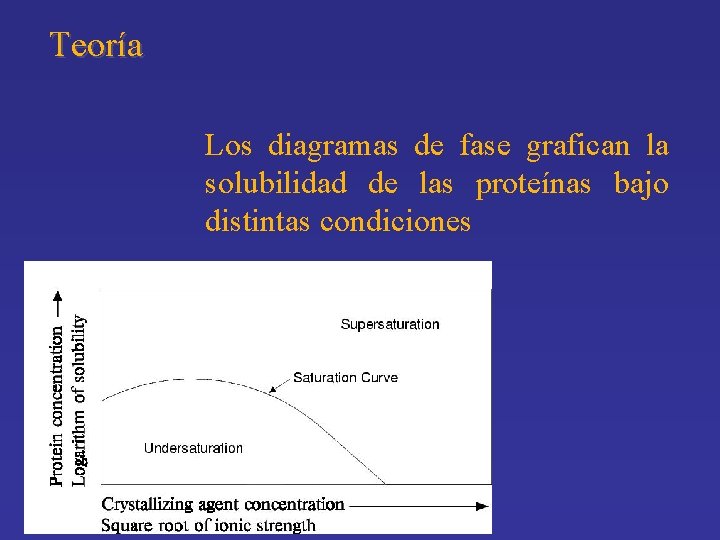
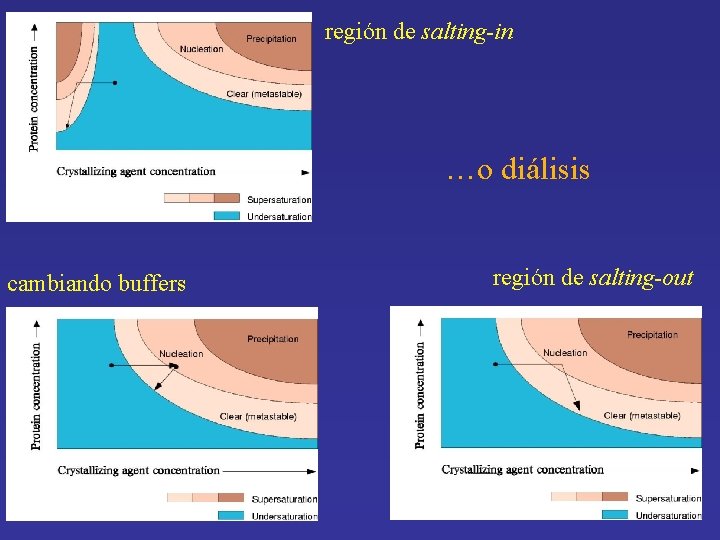
Teoría Los diagramas de fase grafican la solubilidad de las proteínas bajo distintas condiciones

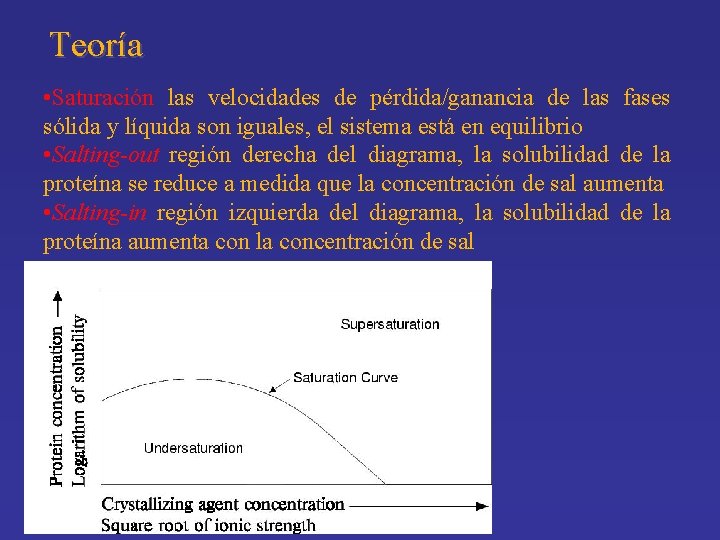
Teoría • Saturación las velocidades de pérdida/ganancia de las fases sólida y líquida son iguales, el sistema está en equilibrio • Salting-out región derecha del diagrama, la solubilidad de la proteína se reduce a medida que la concentración de sal aumenta • Salting-in región izquierda del diagrama, la solubilidad de la proteína aumenta con la concentración de sal

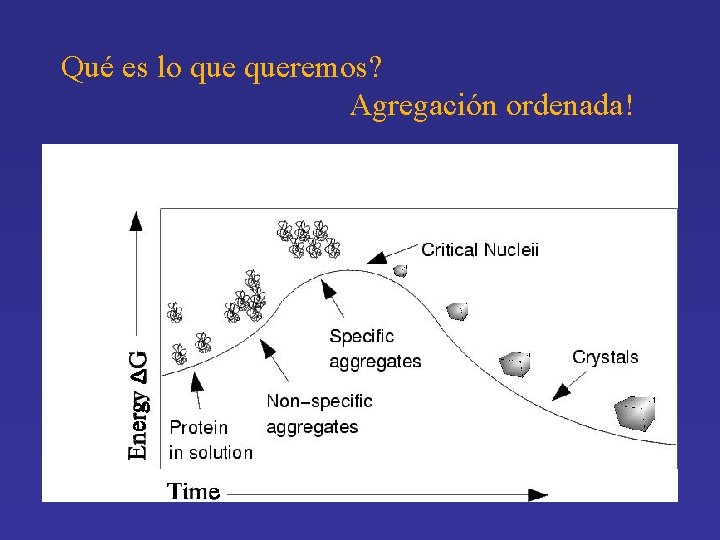
Qué es lo queremos? Agregación ordenada!

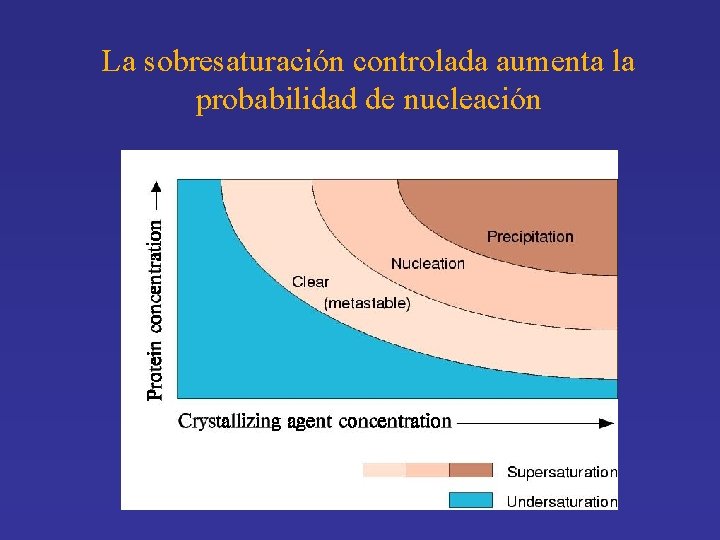
La sobresaturación controlada aumenta la probabilidad de nucleación

Métodos Experimento de difusión de vapor pequeños volúmenes de precipitante y de proteína son mezclados en una gota que se deja equilibrar contra un reservorio de mucho más volúmen conteniendo precipitante u otro agente deshidratante gota colgante

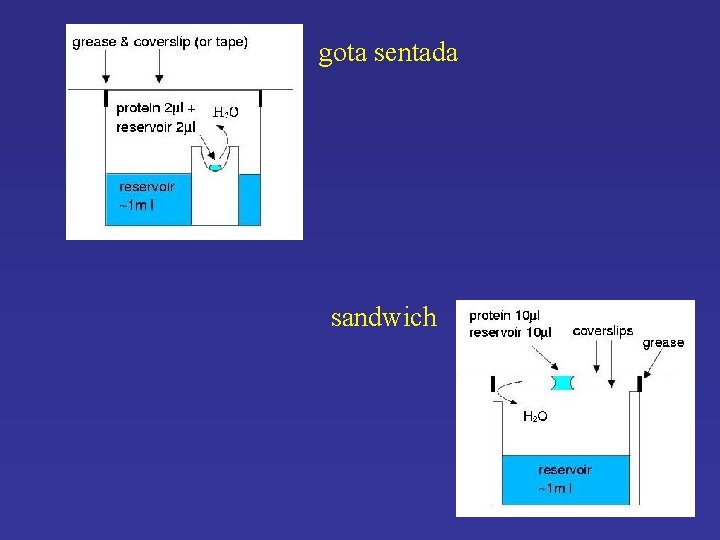
gota sentada sandwich

Tipico setup de difusión de vapor

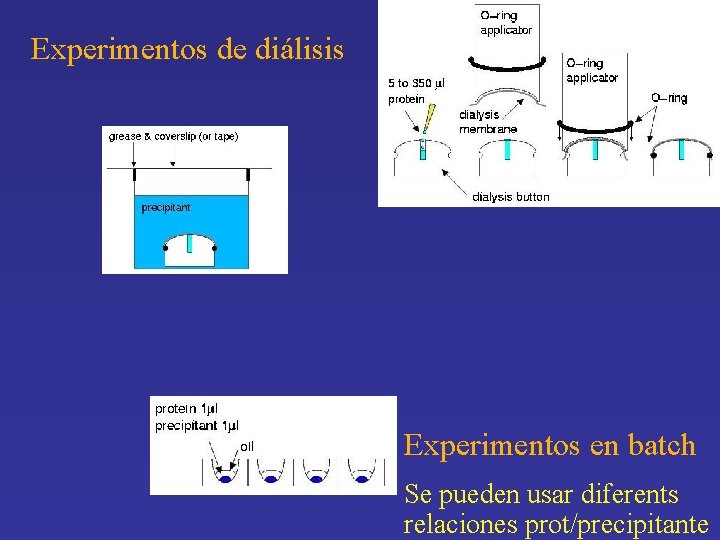
Experimentos de diálisis Experimentos en batch Se pueden usar diferents relaciones prot/precipitante

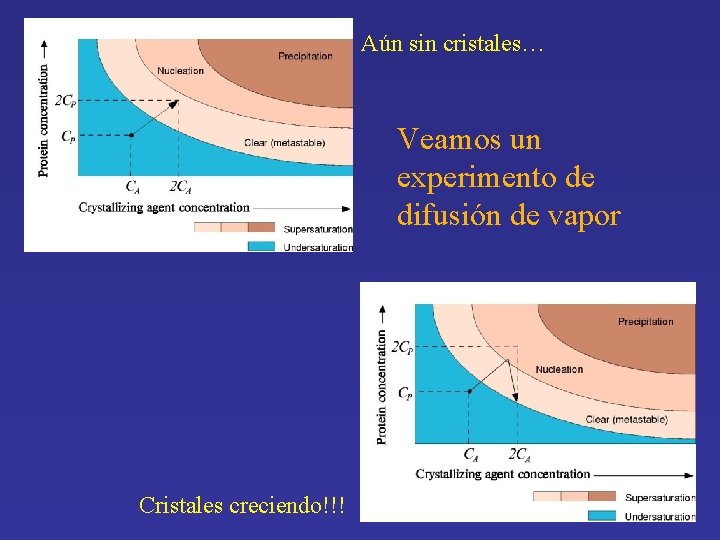
Aún sin cristales… Veamos un experimento de difusión de vapor Cristales creciendo!!!

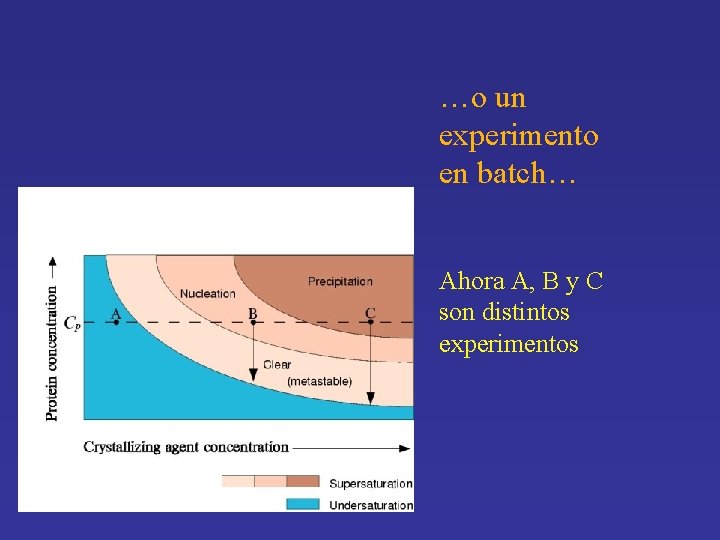
…o un experimento en batch… Ahora A, B y C son distintos experimentos

región de salting-in …o diálisis cambiando buffers región de salting-out

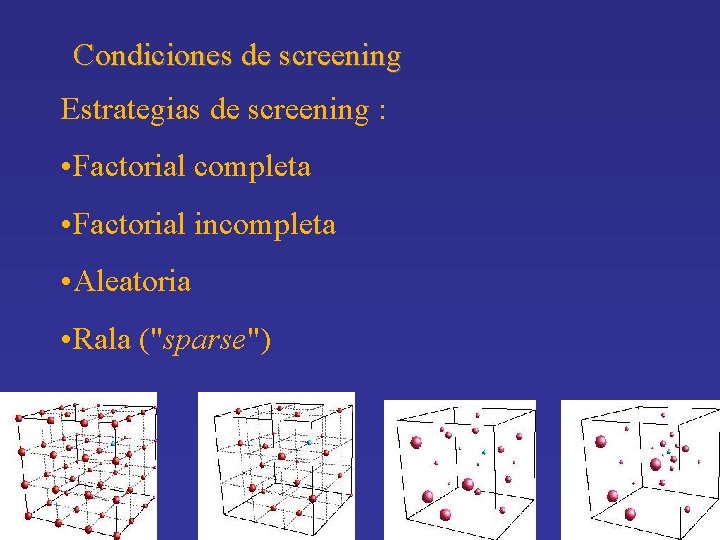
Condiciones de screening Los parámetros que típicamente son variados: • Concentración de proteína (comenzar lo más alto posible) • Precipitante (PEG’s, SA, solventes, sales concentradas, etc) • Presencia de sales (u otros “aditivos”) • p. H y tipo de buffer • Temperatura

Condiciones de screening Estrategias de screening : • Factorial completa • Factorial incompleta • Aleatoria • Rala ("sparse")

Calidad de la proteína • Está pura? • el requisito más importante • hacer (SDS-PAGE, MS) + (SEC, IEC) • Está plegada correctamente? • testear actividad si se tiene un ensayo • testear el espectro CD (o PAGE nativo) • Es fresca? • Es monodispersa? • monodispersión significa que la proteína existe en solución como una única especie de estructura terciaria/cuaternaria determinada (homogeneidad conformacional) • usar una columna de exclusión por tamaño (SEC) como último paso de purificación • usar dispersión de luz (DLS o SLS) como control de calidad

Observación Hay ± 9 cosas distintas que se pueden llegar a ver, a veces combinando más de una en la misma gota 1. 2. 3. 4. 5. 6. 7. 8. 9. Gotas claras Materia Precipitado Geles Piel Separación de fases Aceites Esferulitas Cristales Precipitado microcristalino 1 D - agujas 2 D - placas

Algunas fotos…

…algunas más…

Optimización Cuando se llega a identificar algo "interesante" se procede a • Rastrear alrededor de la condición ("afinar") • Usar aditivos • Sembrar gotas frescas preequilibradas, con el material "interesante" : micro and macro-seeding un cristal demasiado observado nunca crece!!

Tomar la primer foto! El único requerimiento para considerar un cristal de proteína como 'bueno' es que difracte La difracción depende de : §Tamaño • La intensidad de dispersión es proporcional al número de celdas unidad en el cristal • El N° de celdas unidad es proporcional al volúmen del cristal (duplicando todas las dimensiones de un cristal cúbico dará reflexiones ~8 veces más intensas) • El N° de celdas unidad de un cristal depende del tamaño de las celdas (tamaño de la proteína, cuan compacto sea el empaquetamiento, N° de proteínas en la unidad asimétrica, simetría) §Orden • La difracción depende de cuan idénticas son las celdas

Tomar la primera foto! • Encontrar la concentración mínima de crio-protector para el licor madre (criocristalografía) • Poner el cristal en la solución crioprotectora por x tiempo, y montarlo en un loop no hay difracción débil (anisotrópica) 10 Å Fuerza • Colectar una imagen con un prometedora ángulo de oscilación 4. 5 -6 Å grande. Si el cristal es de sal, los puntos van a estar bien alejados <y podrían buena 3Å no verse toma un ángulo pequeño. Calidad de si lasedifracción cristal múltiple / split Si lamentablemente es sal, se cristal veránúnico puntos intensos muymuy mosaico Calidad difractando aun a muy alta resolución cristal único(celdas unidad muy pequeñas, bien ordenadas)

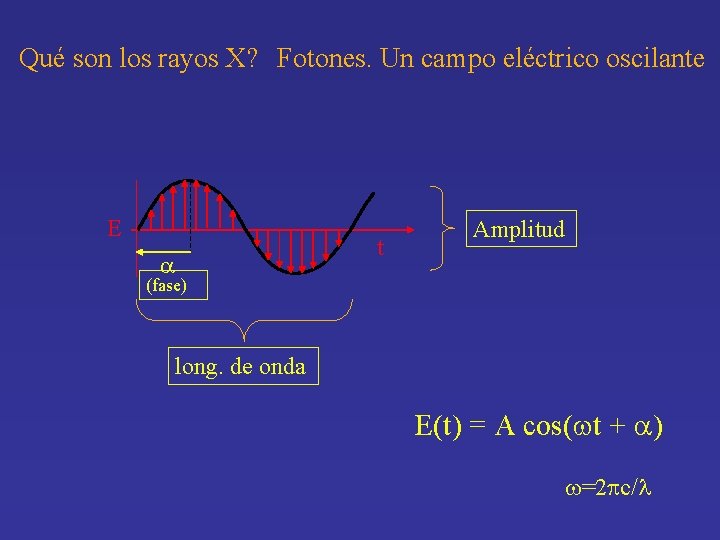
Sabemos entonces por qué usamos rayos X … Pero por qué obtenemos densidad electrónica? Qué son los rayos X? Fotones = un campo eléctrico oscilante* *también un campo magnético oscilante de la misma frecuencia, pero ortogonal y desfasado 90°

Qué son los rayos X? Fotones. Un campo eléctrico oscilante E t a Amplitud (fase) long. de onda E(t) = A cos(wt + a) w=2 pc/

Un electrón en un campo eléctrico oscilante Los electrones e- orbitan a una velocidad aprox 1/100 th c (≈2 x 106 m/s), Por lo que en un ciclo del haz de Rx, e- viajará 2 x 106 m s-1 / 2 x 1018 s-1 = 10 -12 m = 0. 01Å (no mucho comparado al tamaño del átomo) En otras palabras, los Rx ven a los e- como si estuvieran quietos.

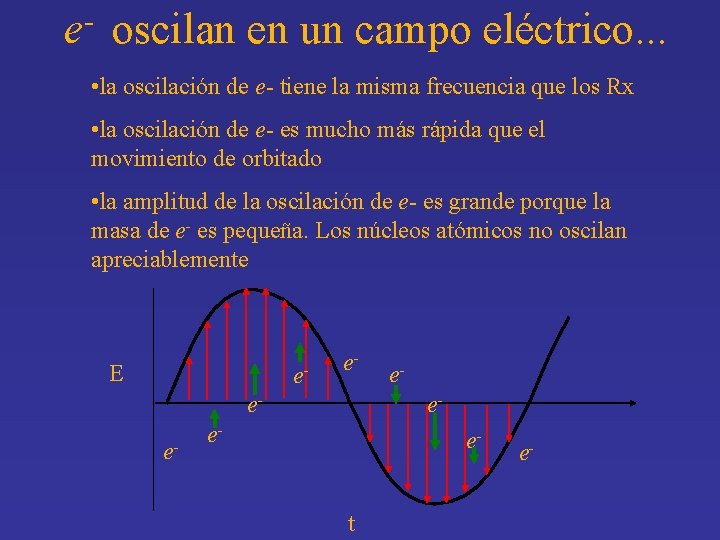
e- oscilan en un campo eléctrico. . . • la oscilación de e- tiene la misma frecuencia que los Rx • la oscilación de e- es mucho más rápida que el movimiento de orbitado • la amplitud de la oscilación de e- es grande porque la masa de e- es pequeña. Los núcleos atómicos no oscilan apreciablemente E e- e- ee- e- et e-

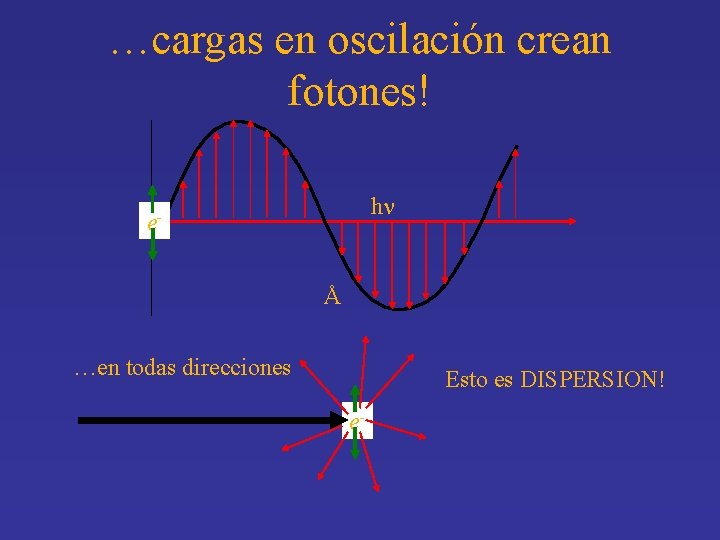
…cargas en oscilación crean fotones! hn eÅ …en todas direcciones Esto es DISPERSION! e-

En el fenómeno de dispersión hay al menos 3 efectos : • Fotoeléctrico --->> absorción • Compton (interacción incoherente) • Thompson o difracción de Bragg (coherente, elástica)

Dispersión de Thompson I I 0 e 4 2 r 2 m 2 c 4 (1 + cos 2 )

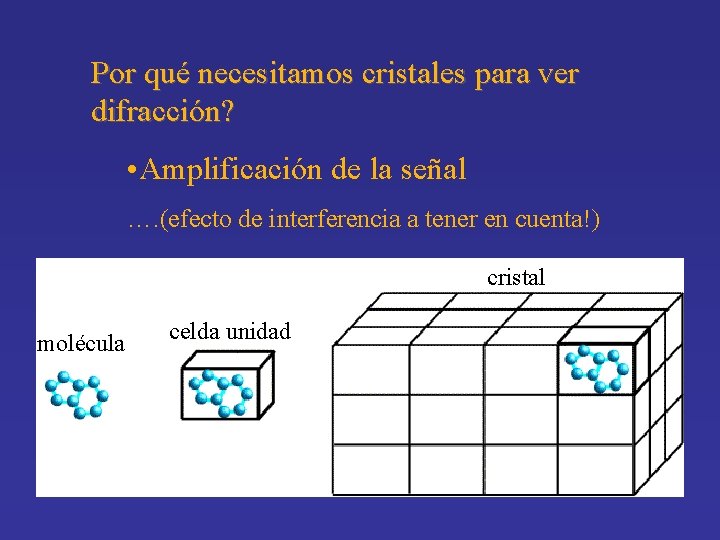
Por qué necesitamos cristales para ver difracción? • Amplificación de la señal …. (efecto de interferencia a tener en cuenta!) cristal molécula celda unidad

Difracción: Cada electrón dispersa Las ondas emitidas se suman … y se restan!! El resultado final depende de las fases relativas de las ondas adicionadas en cada dirección Ley de Bragg : n = 2 d sin Usar el sitio interactivo http: //www. journey. sunysb. edu/ Project. Java/Bragg/home. html
 Deflectarse
Deflectarse Estructura tridimensional de la hemoglobina
Estructura tridimensional de la hemoglobina Kana renk veren
Kana renk veren Formas figurativas
Formas figurativas Direcciones primarias del diseño tridimensional
Direcciones primarias del diseño tridimensional Diseño grafico espacio fluctuante
Diseño grafico espacio fluctuante Un entramado tridimensional de proteínas
Un entramado tridimensional de proteínas Nominativa innominada tridimensional mixta
Nominativa innominada tridimensional mixta Teoria tridimensional do direito
Teoria tridimensional do direito Onda tridimensional exemplo
Onda tridimensional exemplo Elementos del arte textura
Elementos del arte textura Flujo unidimensional bidimensional y tridimensional
Flujo unidimensional bidimensional y tridimensional Planograma tridimensional
Planograma tridimensional Justifique a frase
Justifique a frase Practicas de prefijos y sufijos
Practicas de prefijos y sufijos Describe a laura y a elián usando los verbos recíprocos.
Describe a laura y a elián usando los verbos recíprocos. Pseint tutorial
Pseint tutorial Pronomes
Pronomes Um retrocruzamento sempre significa
Um retrocruzamento sempre significa Segundo o estudo sobre past continuous
Segundo o estudo sobre past continuous Transforme usando un pronombre posesivo
Transforme usando un pronombre posesivo Complete as sentenças usando os seguintes linkers
Complete as sentenças usando os seguintes linkers Ejercicios de verbos infinitivo
Ejercicios de verbos infinitivo Es una herramienta con estructura no secuencial
Es una herramienta con estructura no secuencial Desarrollado
Desarrollado Estructura de lewis pcl2
Estructura de lewis pcl2 Podrias romper un alambre estirandolo con las manos
Podrias romper un alambre estirandolo con las manos Estructura de una agencia publicitaria
Estructura de una agencia publicitaria Estructura del sistema financiero en colombia
Estructura del sistema financiero en colombia Presupuesto icon
Presupuesto icon Inversiones permanentes
Inversiones permanentes Hemidesmosomas
Hemidesmosomas Palabras con infijos
Palabras con infijos Letra de cambio estructura
Letra de cambio estructura Caracteristicas del evangelio de lucas
Caracteristicas del evangelio de lucas Ejemplo de un texto informativo
Ejemplo de un texto informativo Estructura general de un programa
Estructura general de un programa Corcho bajo el microscopio
Corcho bajo el microscopio Isostasia
Isostasia Organos funcionales
Organos funcionales Propiedades fisicas alcanos
Propiedades fisicas alcanos Partes de una bacteria
Partes de una bacteria Estructura de sol
Estructura de sol Estructura de lewis so4
Estructura de lewis so4 Textos funcionales periodisticos
Textos funcionales periodisticos Pseudocódigo
Pseudocódigo