Elektrokemi Elektroner i rrelse Galvanisk historia Luigi Galvani





















- Slides: 28

Elektrokemi Elektroner i rörelse

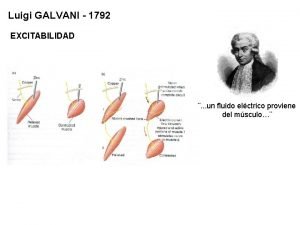
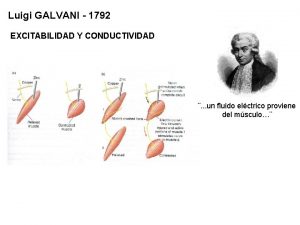
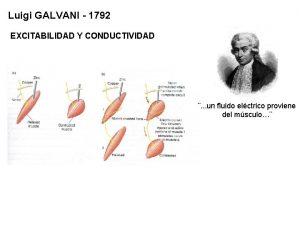
Galvanisk historia • Luigi Galvani, 1737 – 1798 Gjorde experiment med grodlår och elektricitet som ledde till dagens batterier

Atomer och joner – två sidor av samma mynt En järnspik släpps ner i en bägare med kopparsulfat och vips: Järnatomerna blir järnjoner och kopparjonerna blir kopparatomer.

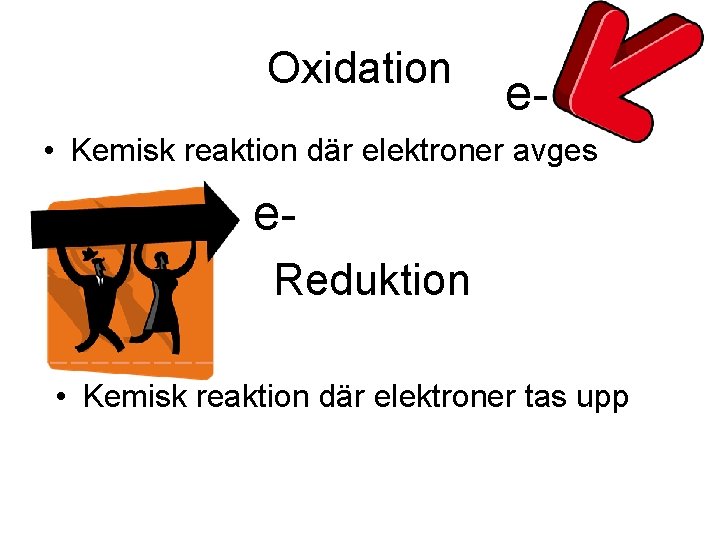
Oxidation e- • Kemisk reaktion där elektroner avges e. Reduktion • Kemisk reaktion där elektroner tas upp

Hur är det möjligt? • Fe → Fe 2+ + 2 e • Cu 2+ + 2 e- → Cu Järnatomer blir järnjoner Kopparjoner blir atomer Alltså……. Fe + Cu 2+ → Fe 2+ + Cu För att det ska bli mer begripligt så tittar vi på. . .

Redox-reaktion Kopparjonerna tar till sig e-, reduceras och järnatomerna ger ifrån sig e-, oxiderar

Spänningsserien ädla och oädla metaller • I spänningsserien ordnas metaller efter hur ädla de är. • Oädla metaller kallas väteutdrivande, därför står väte mellan de ädla (höger) och oädla metallerna (vänster). Oädla metaller Ädla metaller K Ca Na Mg Al Zn Cr Fe Ni Sn Pb H Cu Hg Ag Pt Au

Kort om spänningsserien Metallerna har olika lätt att ge ifrån sig eoch bli joner. Ju ädlare metall desto svårare att ge ifrån sig e-. En metall som är ädlare än en annan kan ta e- från den oädlare.

Varför spänningsserie? • Ordningen talar om vilka ämnen man kan använda för att tex alstra energi i ett galvaniskt element.

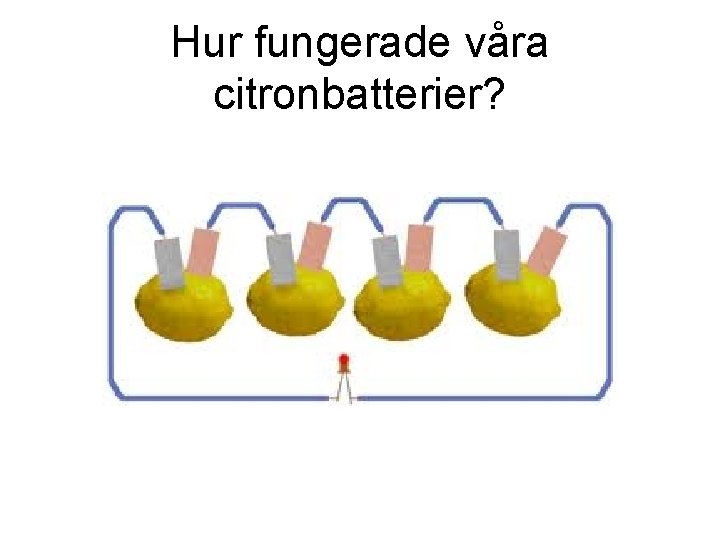
Hur fungerade våra citronbatterier?

• Zinken oxideras, alltså avger zink elektroner och bildar därmed zinkjoner och går i lösning. • Om en ledning kopplas mellan koppar- och zinkblecken så kommer de elektroner som avges av zinken att vandra genom ledningen till kopparblecket.

• Eftersom koppar är ädlare än zink, så blir kopparen positiv pol och zinken negativ pol. • Vid kopparblecket sker reduktion (elektroner tas upp). Kopparen kan inte själv reduceras, eftersom den redan är i reducerad form. Därför leds elektronerna vidare genom kopparen till något i lösningen som reduceras.

• Oxidationen, den reaktion där ett ämne avger elektroner, sker vid anoden. • I citronbatteriet är zinkblecket anod och vi får reaktionen Zn(s) " Zn 2+ + 2 e-. • Zinkatomerna går i lösning som zinkjoner, men lämnar kvar sina elektroner i metallblecket. • Överskottet av elektroner i metallblecket leds sedan bort via den elektriska ledningen i den yttre delen av strömkretsen.

• Reduktionen, den reaktion där ett ämne tar upp elektroner, sker vid katoden. • Det är inte lätt att veta vad som reduceras i citronbatteriet eftersom det finns så många ämnen i lösningen. • En kandidat är dock reaktionen 2 H+ + 2 e− −> H 2(g) eftersom citronsyran i saften gör att det finns gott om vätejoner.

• Elektronerna kommer från den elektriska ledningen i den yttre delen av strömkretsen till kopparblecket där de möter vätejonerna i vattenlösningen. • Elektronerna hoppar över till vätejonerna och bildar vätgas. 2 H+ + 2 e− −> H 2(g)

Sammanfattning • Zink mindre ädel • Zink avger elektroner = zink oxiderar • Zn(s) " Zn 2+ + 2 e-. • Elektronerna leds genom kabeln från zinket till kopparn • Koppar tar upp elektronerna och leder de vidare till citronsyran, eftersom koppar är nöjd

Litiumjonbatteri Vilka fördelar finns med elbilar Vilka nackdelar finns med elbilar

Exit pass 1. Vad borde hända om man lägger en bit zink i en lösning med silverjoner? 2. Vilken metall var pluspol i våra batterier? 3. Vilken metall var minuspol i våra batterier?

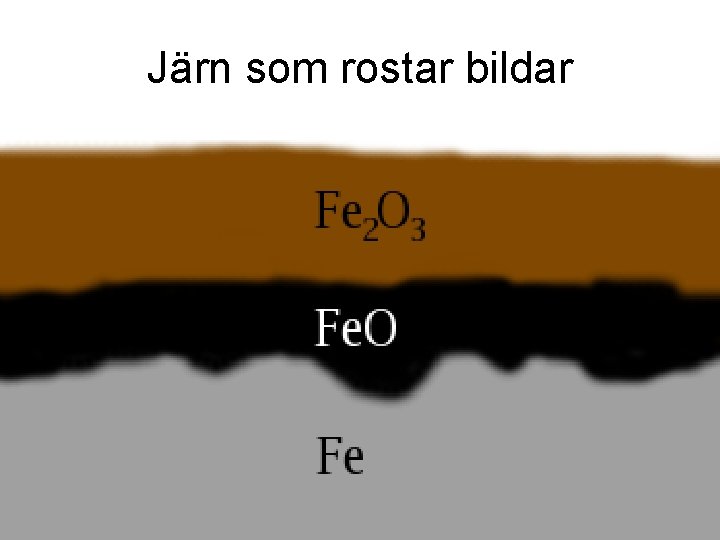
Korrosion (från franska ordet corrodere = gnaga sönder) Metaller reagerar i fuktig luft och fräter sönder

Vad är rost? • Rost av järn är ett resultat av en elektrokemisk reaktion. Det krävs både närvaro av luft (syre) och vatten. • Genom att stålet alltid innehåller små variationer i sammansättning och struktur och olika delar är olika exponerade för luftens syre, så blir vissa områden anodiska och andra katodiska, precis som i en elektrokemisk cell.

Järn som rostar bildar

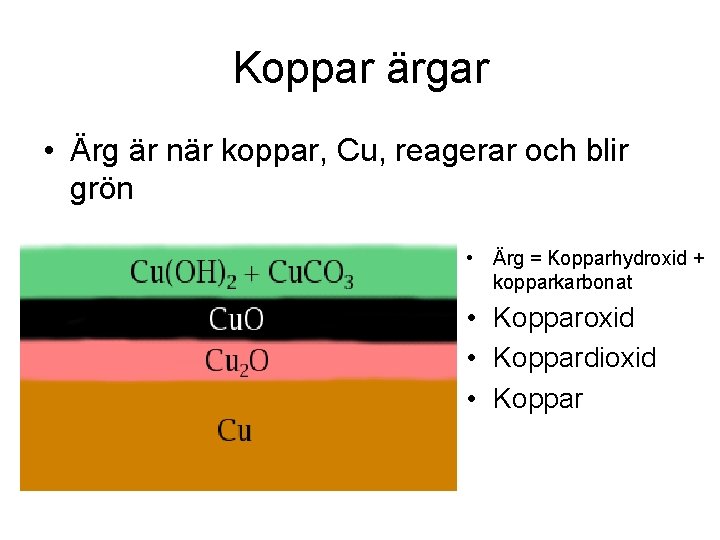
Koppar ärgar • Ärg är när koppar, Cu, reagerar och blir grön • Ärg = Kopparhydroxid + kopparkarbonat • Kopparoxid • Koppardioxid • Koppar

Varning Kopplar du ihop vattenledningar av olika metaller kan de bilda ett svagt galvaniskt element och börja läcka. .

Hur kan vi skydda oss mot rost? • Planera en undersökning där du ska skydda en bit järn från att rosta när.

Hur kan vi skydda oss mot korrosion? • Rostskydd – Lack – Vax – Fett/olja – Färg • Förzinkning • Offeranoder



 Istituto galvani bologna
Istituto galvani bologna Luigi galvani
Luigi galvani Liceo ginnasio luigi galvani
Liceo ginnasio luigi galvani Liceo linguistico galvani
Liceo linguistico galvani Galvanisk korrosion tabell
Galvanisk korrosion tabell Hur många elektroner får plats i m skalet
Hur många elektroner får plats i m skalet Skallmodellen
Skallmodellen Kci
Kci Sel elektrokimia dengan transference
Sel elektrokimia dengan transference Liceo galvani bologna
Liceo galvani bologna Galvani opromolla angri
Galvani opromolla angri Vinculos entre historia oral e historia desde abajo
Vinculos entre historia oral e historia desde abajo Dott. pier luigi bruni
Dott. pier luigi bruni Officiers luigi xiv
Officiers luigi xiv Intendenti luigi xiv
Intendenti luigi xiv Reggia di versailles storia
Reggia di versailles storia Luigi salvioni
Luigi salvioni Dr luigi meneghini
Dr luigi meneghini Campus einaudi
Campus einaudi Scuola luigi pirandello comiso
Scuola luigi pirandello comiso Luigi gaudio professore
Luigi gaudio professore Russolo
Russolo Luigi xiv taumaturgo
Luigi xiv taumaturgo Luigi pi
Luigi pi Ipsct luigi einaudi
Ipsct luigi einaudi Luigi, il gran delfino
Luigi, il gran delfino Luigi baratto
Luigi baratto Luigi rule3
Luigi rule3 Luigi xiv capo della chiesa
Luigi xiv capo della chiesa