Elektrokemi Elektroner i rrelse Vad hnder om man



















- Slides: 23

Elektrokemi Elektroner i rörelse

Vad händer om man lägger en järnspik i en kopparlösning? • Järnspiken kommer att frätas upp och det bildas koppar på botten av bägaren. • Vad har hänt? Jo, elektrokemi!

Atomer och joner – en sann kärlekssaga • Elektrokemi handlar om hur atomer blir joner och hur joner blir atomer, bara genom att lämna elektroner till varandra. Sann kärlek! • Hur det går till? Följ med till atomernas och jonernas värld!

Vad hände alltså med järnspiken och kopparlösningen? • Järnatomerna lämnade ifrån sig elektroner och blev till järnjoner. Kopparjonerna tog upp elektronerna och blev till kopparatomer. • Man kan också skriva det så här: • Fe → Fe 2+ + 2 e • Cu 2+ + 2 e- → Cu Järnatomer blir järnjoner Kopparjoner blir atomer

En kärlekssaga som kallas Redox-reaktion • En metall som tar upp elektroner reduceras. En metall som lämnar ifrån sig elektroner oxideras. • I vårt experiment: Kopparjonerna tog upp elektroner, alltså reduceras kopparn. Järnatomerna lämnade ifrån sig elektroner, alltså oxideras järnet. • När metaller lämnar elektroner till varandra blir det en redox-reaktion: Fe + Cu 2+ → Fe 2+ + Cu 2 e-

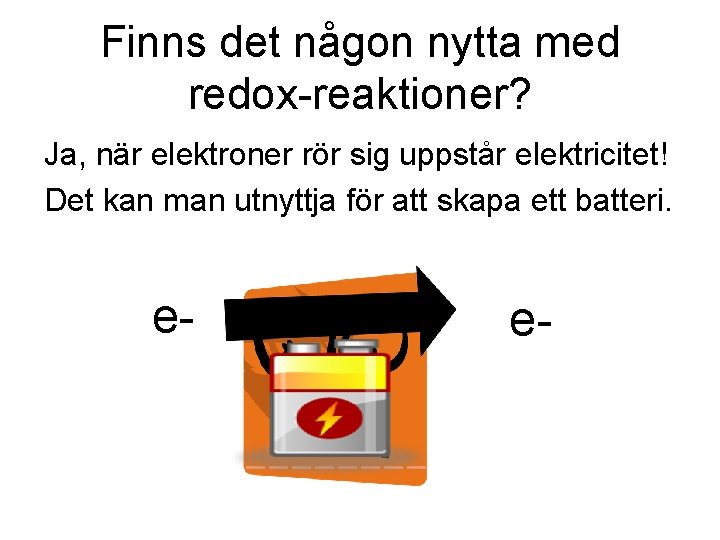
Finns det någon nytta med redox-reaktioner? Ja, när elektroner rör sig uppstår elektricitet! Det kan man utnyttja för att skapa ett batteri. e- e-

Galvanisk historia • Luigi Galvani, 1737 – 1798 Gjorde experiment med grodlår och elektricitet som ledde till dagens batterier.

Ett batteri är ett galvaniskt element e- e- Zn - Cu + Galvaniskt element = två olika metaller som sänks ner i en jonlösning. Mellan de båda metallerna får man en elektrisk spänning, spontan reaktion. Galvanism = elektriska strömmar som bildas när två olika metaller binds samman av en jonlösning.

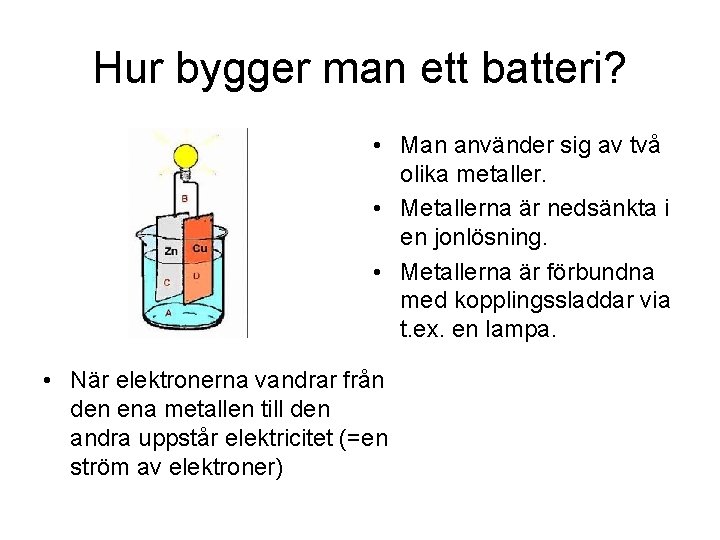
Hur bygger man ett batteri? • Man använder sig av två olika metaller. • Metallerna är nedsänkta i en jonlösning. • Metallerna är förbundna med kopplingssladdar via t. ex. en lampa. • När elektronerna vandrar från den ena metallen till den andra uppstår elektricitet (=en ström av elektroner)

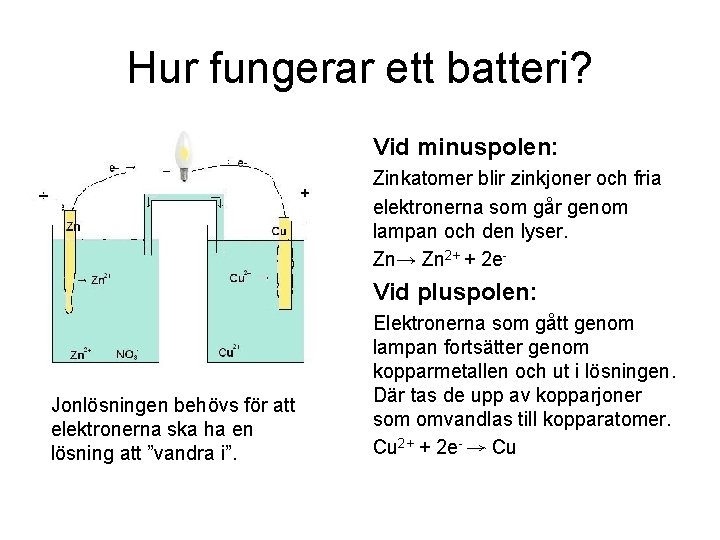
Hur fungerar ett batteri? Vid minuspolen: Zinkatomer blir zinkjoner och fria elektronerna som går genom lampan och den lyser. Zn→ Zn 2+ + 2 e- Vid pluspolen: Jonlösningen behövs för att elektronerna ska ha en lösning att ”vandra i”. Elektronerna som gått genom lampan fortsätter genom kopparmetallen och ut i lösningen. Där tas de upp av kopparjoner som omvandlas till kopparatomer. Cu 2+ + 2 e- → Cu

Hur kan det bli så? • Olika metaller har olika lätt att ge ifrån sig elektroner och bli joner: • En oädel metall ger lätt ifrån sig sina elektroner. • En ädlare metall har svårare att ge ifrån sig elektroner. • Därför kan den ädlare metallen ta elektroner från den oädlare. Den ädlare metallen påverkas inte.

Spänningsserien ädla och oädla metaller • I spänningsserien ordnas metaller efter hur ädla de är. • Ju längre till höger i spänningsserien en metall står, desto ädlare är den. • Väte (H) kan ibland uppföra sig som en metall, och ligger mellan de oädla och ädla metallerna. Oädla metaller Ädla metaller K Ca Na Mg Al Zn Cr Fe Ni Sn Pb H Cu Hg Ag Pt Au

Varför finns väte i spänningsserien? • Om man lägger en oädel metall i en syra så fräts metallen sönder = metallen omvandlas till metalljoner och fria elektroner. • En syra innehåller vätejoner (H+). Två vätejoner tar upp två fria elektronerna och det bildas vätgas (H 2). • T. ex. : Fe → Fe 2+ + 2 e- och 2 H+ + 2 e- → H 2 • Oädla metaller kallas därför väteutdrivande metaller, och är anledningen till varför väte står mellan de ädla och oädla metallerna.

Vilka metaller kan man använda i ett batteri? • En spänningsmätare talar om vilka metaller man kan använda för att alstra energi i ett galvaniskt element. • Ju längre ifrån varandra två metaller ligger i spänningsserien, desto mer ström kan batteriet ge.

Det finns olika slags batterier • Alkaliska batterier till bärbara bandspelare och cd-skivor, kameror (t. ex. AA, AAA) • Knappceller till armbandsur, miniräknare, hörapparater • Olika litiumbatterier till t. ex. mobiltelefoner

Ackumulator (latinska ordet ackumulera betyder samla) Ett laddningsbart batteri kallas ackumulator Nickel-metallhybridackumulator Blyackumulator Litiumjonbatteri

Blyackumulator Används som startbatteri i bilar, båtar, mopeder, mm

Korrosion – ett oönskat galvaniskt element När metaller utsätts för fuktig luft uppstår en spontan redox-reaktion. Metallerna kan frätas sönder. (från franska ordet corrodere = gnaga sönder)

Hur skyddas metaller från korrosion? Det är framför allt järn som vi vill skydda från korrosion (vi säger att järn rostar). Det finns olika rostskydd: • Rostfritt stål = En legering av järn + krom + nickel • Galvanisering = Ett ytlager av en metall som är oädlare än järn, t. ex. zink (förzinkning) • Offeranod = På utombordsmotorer och på stora fraktbåtar av järn sätter man ofta på plattor av zink som ”offrar” sig så att inte järnet ska rosta.

Varning! Kopplar du ihop vattenledningar av olika metaller kan de bilda ett svagt galvaniskt element och börja läcka. .

Elektrolys Joner i lösning omvandlas till atomer. Kan användas för att utvinna rena metaller, t. ex. aluminium ur bauxit. Används även för att ge metallföremål en vacker yta, t. ex. förgylla, förkroma etc.

Hur går elektrolysen till? Två stavar sänks ner i en jonlösning och kopplas till en strömkälla. Negativ - Katod Positiv - Anod På katoden kommer det att bildas en metallbeläggning, beroende på vilken metall som finns i jonlösningen.

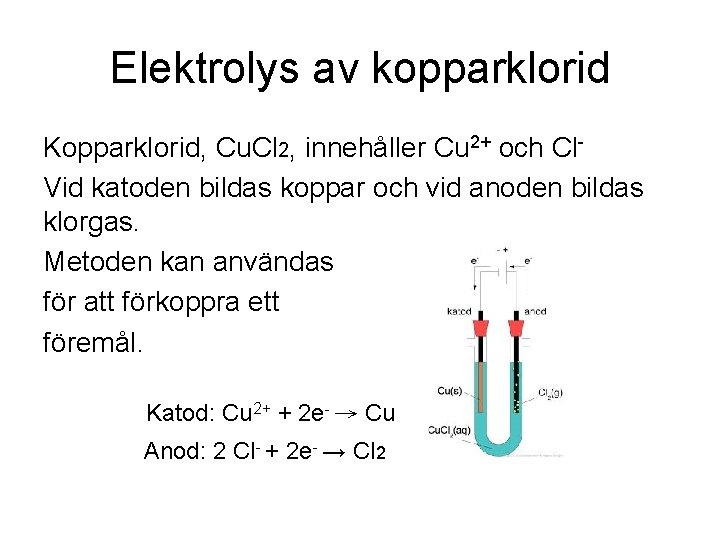
Elektrolys av kopparklorid Kopparklorid, Cu. Cl 2, innehåller Cu 2+ och Cl. Vid katoden bildas koppar och vid anoden bildas klorgas. Metoden kan användas för att förkoppra ett föremål. Katod: Cu 2+ + 2 e- → Cu Anod: 2 Cl- + 2 e- → Cl 2
 Person vs. society conflict
Person vs. society conflict Hur många elektroner får plats i m skalet
Hur många elektroner får plats i m skalet Skallmodell
Skallmodell Hnder
Hnder Hnder
Hnder Lrare
Lrare Hnder
Hnder Hnder
Hnder Urkund exempel
Urkund exempel Hur skriver man informerande tal
Hur skriver man informerande tal Volym massa densitet
Volym massa densitet Conflict literary definition
Conflict literary definition Rich man poor man bible
Rich man poor man bible A hungry man is an angry man meaning and sentence
A hungry man is an angry man meaning and sentence What is the meaning of internal conflict
What is the meaning of internal conflict Through one man sin entered
Through one man sin entered One man's burden is another man's
One man's burden is another man's Menssyklusen
Menssyklusen Old man and new man
Old man and new man Carnal man
Carnal man You live and learn
You live and learn Conflict in the cask of amontillado
Conflict in the cask of amontillado Mein gott liebt jeden menschen
Mein gott liebt jeden menschen Vad är tumgreppet
Vad är tumgreppet