Elektrokemi What Kort kemi repetition Metaller Har en













- Slides: 15

Elektrokemi What? ? ?

Kort kemi repetition Metaller! - Har en blank yta - Leder elektrisk ström - Leder värme - Böjs utan att gå av

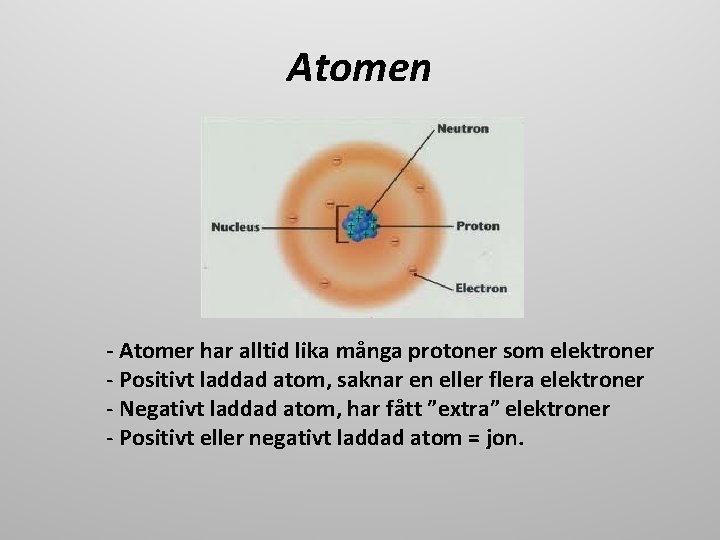
Atomen - Atomer har alltid lika många protoner som elektroner - Positivt laddad atom, saknar en eller flera elektroner - Negativt laddad atom, har fått ”extra” elektroner - Positivt eller negativt laddad atom = jon.

Joner - Joner har en elektrisk laddning och de kan leda ström. Elektrisk ström? - Är laddningar som förflyttas i ett material. Metall = elektroner som rör sig. Lösning = joner som rör sig.

Syror och baser Syror - avger vätejoner -smakar surt -p. H under 7 -frätande

Syror och baser Baser -tar upp vätejoner -baser känns hala -p. H över 7 - frätande

Oxidation Koppartak (Cu)– luft (O)? Kopparatomen oxideras= lämnar ifrån sig två elektroner, positiv jon. Cu → Cu²⁺ + 2 e⁻ Syreatomen reduceras = tar upp elektroner, blir en negativ jon. O + 2 e⁻ → O ²⁻ Varför? Antal valenselektroner avgör egenskaperna hos en atom, atomer strävar efter 8 valenselektroner i yttersta skalet. Cu har 1, O har 6. Syre vill gärna ha fler och koppar vill bli av med en. 2, 6

Redox-reaktion Det kan inte bli elektroner över! Om någon ger måste en annan ta. Ett ämne som får andra ämnen att oxideras, tar elektroner, kallas oxidationsmedel. Ämnen som ger ifrån sig elektroner, reduceras, kallas reduktions medel.

Metallernas spänningsserie • Metalljoner har ett underskott av elektroner. • De kan ta upp elektroner från andra ämnen, även metaller, ett oxidationsmedel. • Metaller har olika lätt att ge ifrån sig elektroner. Ju svårare, desto längre upp i spänningsserien, mer ädel. • Oädla metaller ligger under H, ädla över. • En ädlare metall oxiderar en mindre ädelmetall. • Väte oxiderar oädla metaller. ?

Batterier Definition av ett Batteri - Vad menas med batteri? • De flesta känner i dag till begreppet batteri. I dagligt tal är det en produkt som kan lagra energi och avge denna i form av elektricitet när ström behövs för att strömförsörja exempelvis en ficklampa. • Ordet "batteri" kommer från det franska verbet battre, vilket betyder "slå, hamra, bulta". I militära sammanhang innebär ordet batteri ett antal kanoner vilka tillsammans samverkar mot fientliga styrkor. På samma sätt definieras ett batteri inom elektrokemin, d. v. s. ett antal celler som sammankopplas för att tillsammans lämna en lämplig spänning.

Batterier Brunstensbatteri Brunsten = mangandioxid Salmiaklösning = ammoniumklorid och stärkelse

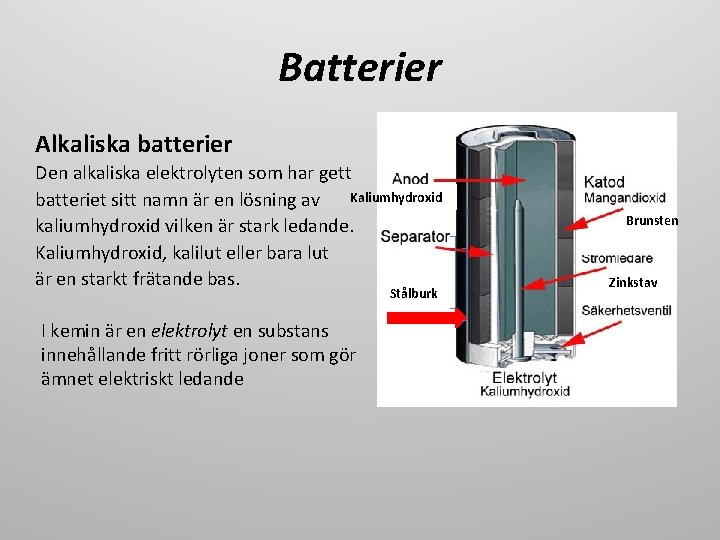
Batterier Alkaliska batterier Den alkaliska elektrolyten som har gett Kaliumhydroxid batteriet sitt namn är en lösning av kaliumhydroxid vilken är stark ledande. Kaliumhydroxid, kalilut eller bara lut är en starkt frätande bas. Stålburk I kemin är en elektrolyt en substans innehållande fritt rörliga joner som gör ämnet elektriskt ledande Brunsten Zinkstav

Batterier Om man sätter ett batteri i ex. en ficklampa startar en redox-reaktion. Vid Anoden, minuspolen: Zinkmetallen oxideras, avger elektroner och blir zinkjoner. Zn → Zn²⁺ + 2 e⁻ Vid katoden, pluspolen: Manganjonerna reduceras, tar upp elektroner. Mn⁴⁺ + 4 e⁻ → Mn Kolstaven i brunstensbatterier är bara en ledare. Leder elektronerna till mangandioxiden.

Batterier • När ett batteri kopplas till en förbrukare börjar en ström av elektroner att röra sig från den negativa polen (katoden) genom förbrukaren till den positiva polen (anoden). • Strömmen av elektroner pågår tills skillnaden i laddning mellan polerna har jämnats ut. • Elektronerna har då flyttat sig från minuspolen till pluspolen. • När batteriets spänning har jämnats ut kan inte elektronerna längre röra sig genom lampan, och batteriet har tagit slut.

Batterier Ackumulator? Lagrar elektrisk energi. Laddningsbara batterier. Hur kan man ladda batterier? Man skickar in elektrisk energi som får redox-reaktionen att gå baklänges. Reduktion vid anod, minuspol → Oxidation vid katod, pluspol Förbrukade batterier Batterier innehåller giftiga tungmetaller = särskilt miljöfarliga metaller som bly, kvicksilver, kadmium och uran. När de är förbrukade ska de lämnas in, läggas i särskilda behållare i affärer Eller på sopstationen.
 Har det här med texten
Har det här med texten Yarı metaller tel ve levha haline getirilebilir mi
Yarı metaller tel ve levha haline getirilebilir mi Değişken değerlikli metaller
Değişken değerlikli metaller Soy metaller
Soy metaller Värmeledningsförmåga metaller
Värmeledningsförmåga metaller Luigi galvani
Luigi galvani Ametaller ve sembolleri
Ametaller ve sembolleri Definition redoxreaktion
Definition redoxreaktion Leder titan ström
Leder titan ström Tepkime kendiliğinden gerçekleşiyorsa
Tepkime kendiliğinden gerçekleşiyorsa Oädla metaller
Oädla metaller Henderson eşitliği
Henderson eşitliği Oädla metaller
Oädla metaller Oädla metaller
Oädla metaller Soy metaller
Soy metaller Strösocker kemisk uppbyggnad
Strösocker kemisk uppbyggnad