COURS POUR MASTER 2 SCIENCES PHYSIQUES DES STRUCTURES
























![Avec [O] << oxygène actif >>de l’oxydant Exemple : combustion du phénol Demande théorique Avec [O] << oxygène actif >>de l’oxydant Exemple : combustion du phénol Demande théorique](https://slidetodoc.com/presentation_image_h2/55b44c390a568249e382b0d1a5c6b40d/image-28.jpg)



- Slides: 37

COURS POUR MASTER 2 SCIENCES PHYSIQUES DES STRUCTURES OPTION CHIMIE PHYSIQUE 2016 -2017 EVALUATION, TRAITEMENT CHIMIQUE ET ELECTROCHIMIQUE DE LA POLLUTION DES EAUX Professeur OUATTARA LASSINE

INTRODUCTION Constat : environnement est pollué dont les eaux Il est devenu nécessaire de s’en intéresser et même impérieux de mener des actions utiles pour les analyser puis à les traiter. Les analyses devront permettre de déterminer la qualité des eaux et de proposer des techniques efficaces et économiques pour les traiter. La composition des eaux usées s'apprécie au travers de nombreux paramètres physicochimiques et biologiques. Le choix des paramètres à analyser dépendront des objectifs recherchés. Nous présenterons ici quelques paramètres physico-chimiques et micro-biologiques qui sont généralement mesurés pour l’analyse des effluents. Les traitements chimiques et électrochimiques nécessitant des oxydants seront proposés. 2

I- EVALUATION DE LA POLLUTION DES EAUX USEES I. 1 -ECHANTILLONNAGE ET PARAMETRES DE CARACTERISATION DE LA POLLUTION DES EAUX I. 1 -1 : ECHANTILLONNAGE Le traitement efficace d’un rejet liquide demande d’abord de connaître la quantité, la qualité et les variations temporelles de la composition de l’effluent. Pour connaitre la qualité des eaux, il faut suivre deux étapes principales à savoir l’étape prélèvement de l’eau et l’étape d’analyse. Pour faire un bon prélèvement, il faut le faire après avoir élaborer une bonne stratégie d’échantillonnage. Cette stratégie consiste à réaliser l’échantillonnage en suivant plusieurs étapes: Visite préliminaire: Etape indispensable dans la démarche d’échantillonnage. La réalisation d’une visite préliminaire par l’équipe en charge des opérations sur le site a plusieurs buts : - Comprendre le fonctionnement du site ; - Acquérir des informations pour aider à l’élaboration de la stratégie d’échantillonnage : déterminer les périodes et jours opportuns pour effectuer les prélèvements dans des conditions de fonctionnement représentatives des conditions visées (ex. : rythme d’activité, lavage, …) de façon à caractériser les rejets pour répondre à la problématique - Déterminer les points de mesure et d’échantillonnage Les campagnes d’échantillonnage, pour être menées dans les meilleures conditions et dans le respect des bonnes pratiques, nécessitent une logistique importante. 3

Accord sur les différentes conditions d’accès au site et les différentes autorisations nécessaires (prise de clichés photographiques, …). La visite préliminaire doit faire l’objet d’un compte-rendu ; elle doit donc être réalisée assez tôt par rapport à la période envisagée pour la mesure. La mauvaise maîtrise de l’échantillonnage peut engendrer des résultats de mesures non fiables, biaisés, erronés, non représentatifs, ou non comparables. Ils peuvent alors mener à des conclusions inexactes, des actions inutiles et engendrer des coûts non justifiés. Les étapes d’échantillonnage, de conditionnement, de transport, de maintien à température lors du transport des échantillons au laboratoire d’analyse doivent être clairement définies en amont de toute campagne. Cela est basé sur une bonne collaboration entre les préleveurs et les analystes afin d'assurer le bon déroulement des opérations d'échantillonnage et d'analyse. Une bonne préparation permettra également de minimiser le volume à collecter, de s’assurer que la liste des paramètres à quantifier a été bien établie. 4

La mauvaise maîtrise de l’échantillonnage peut engendrer des résultats de mesures non fiables, biaisés, erronés, non représentatifs, ou non comparables. Ils peuvent alors mener à des conclusions inexactes, des actions inutiles et engendrer des coûts non justifiés. Les étapes d’échantillonnage, de conditionnement, de transport, de maintien à température lors du transport des échantillons au laboratoire d’analyse doivent être clairement définies en amont de toute campagne. Cela est basé sur une bonne collaboration entre les préleveurs et les analystes afin d'assurer le bon déroulement des opérations d'échantillonnage et d'analyse. Une bonne préparation permettra également de minimiser le volume à collecter, de s’assurer que la liste des paramètres à quantifier a été bien établie. 5

I. 1 -2 : PARAMETRES PHYSICO-CHIMIQUES Les eaux usées sont des milieux extrêmement complexes dont la caractérisation nécessite la détermination de certains paramètres qui peuvent être physiques, chimiques ou biologique. Il existe une grande variété de paramètres dont certains seront présentés ici. *la température La température joue un rôle très important dans la solubilité des sels et des paramètres d’analyse. *La conductivité mesure la capacité de l’eau à conduire le courant entre deux électrodes. La mesure de la conductivité permet d’apprécier la quantité de sels dissous dans l’eau. *Le p. H (potentiel d’hydrogène) mesure la concentration en ions H+ de l’eau. Il traduit la balance entre acide et base sur une échelle de 0 à 14. Le p. H=7 correspond à la neutralité. Ce paramètre caractérise un grand nombre d’équilibre physicochimique. En général, l'activité biologique se situe entre 6, 5 et 8 unités de p. H. 6

*La turbidité traduit la présence de particules en suspension dans l’eau (débris organiques, argiles, organismes microscopiques, …). *Les matières en suspension (MES) : c'est la quantité de pollution organique et minérale non dissoute dans l'eau. *Les ions chlorures existent dans la quasi-totalité des eaux à des concentrations très variables. *Les matières azotées: L’azote peut se trouver sous forme minérale (ammoniacal, nitrate) ou organique. On a : - Les Nitrates qui constituent le stade final de l’oxydation de l’azote. - Les Nitrites qui constituent une étape importante dans le cycle de l’azote, ils s’insèrent entre l’ammoniaque et les nitrates. - L’ammoniaque qui constitue la forme réduite de l’azote. - L’azote Kjeldahl qui comporte l’azote présent sous les formes organiques et ammoniacales à l’exclusion des nitrates et nitrites. *Les composés phosphorés Le phosphore peut également se trouver sous forme minérale (en provenance des lessives ou des rejets industriels) ou organique. Le phosphore est l’un des composants essentiels de la matière vivante. Élément indispensable à la vie des algues, la présence de phosphore entraîne un risque d’eutrophisation des cours d’eau ou des lacs, c’est à- dire que celui 7 ci peut se voir envahir par un développement excessif de la population algale.

*L’oxygène dissous L’eau absorbe autant d’oxygène que nécessaire pour que les pressions partielles d’oxygène dans le liquide et dans l’air soient en équilibre. La solubilité de l’oxygène dans l’eau est fonction de la pression atmosphérique (altitude), de la température et de la minéralisation de l’eau. . *Les matières organiques Pour caractériser la quantité de matières organiques présentes dans l’eau usée, on détermine certains paramètres comme : **La Demande Biologique en Oxygène (DBO)//Demande Biochimique en oxygène. La demande biologique en oxygène (DBO) est un paramètre global qui exprime la quantité d’oxygène qu’une biomasse épuratrice va consommer pour décomposer les matières organiques contenues dans l’effluent avec le concours des microorganismes présents dans celui-ci. La mesure avec Oxi. Top® repose sur une mesure de la pression dans un système clos. Les micro-organismes qui se trouvent dans l’échantillon consomment l’oxygène en formant du CO 2. Celui-ci est absorbé avec Na. OH. Il s’ensuit une dépression dont la mesure peut être lue directement dans la DBO en mg/l. Oxi. Top® 8

**La Demande Chimique en Oxygène (DCO). La demande chimique en oxygène (DCO) est, elle, représentative de la quantité de matières organiques oxydables par voie chimique. En d’autres termes, elle correspond effectivement à la quantité d'oxygène nécessaire pour oxyder dans des conditions opératoires définies, les matières organiques (Biodégradables ou non) présentes dans un échantillon donné. L'oxydation est réalisée ici par un réactif ayant un pouvoir d'oxydation puissant (le permanganate de potassium à chaud en milieu acide). La quantité de réactif consommé pour l'oxydation des matières organiques présentes, rapportée en mg/l d'oxygène, correspond à la DCO. Ce paramètre offre une représentation plus ou moins complète des matières oxydables présentes dans l’échantillon. **Carbone organique total (COT) C’est la quantité de carbone organique présent dans l’eau. Un échantillon d'eau résiduaire est susceptible de contenir en proportions variables du carbone organique dissous et particulaire, du carbone organique provenant de substances volatiles (carbone organique purgeable), et du carbone minéral dissous. La technique mise en œuvre pour la mesure du COT consiste successivement: -à isoler le carbone minéral sous forme de dioxyde de carbone par acidification et à l'éliminer par stripping; -à transformer en dioxyde de carbone le carbone organique par oxydation thermique catalytique à 800 -1000°C, oxydation aux UV, oxydation photochimique à froid (action conjointe de persulfate et d'un rayonnement UV), etc; -à mesurer le CO 2 issu de cette réaction soit directement, par mise en oeuvre d'un détecteur à infra-rouge, qui est la technique la plus utilisée, soit par d'autres méthodes (dosage colorimétrique, réduction en méthane et détection par ionisation de flamme, . . . ). Le résultat de la mesure est exprimé en mg de carbone par litre. 9

**Composés organohalogénés (XOT) X pour halogène. XOT exprime la quantité d’halogène organique totale de l’eau. Pour X=chlore, XOT représente le chlore organique total présent dans l’eau. Le chlore organique total est déterminé par oxydation des produits organiques et par mesure de la quantité de chlorure formé. XOT=XOP+XOE+XOA Selon la nature des composés organochlorés, on distingue trois types d’analyses: -composés organochlorés volatiles (PE<180°C) XOP (Purge) -Composés organochlorés lipophiles (solubles dans n-octane) XOE (extraction) -composés organochlorés hydrophiles (absorption sur charbon actif) XOA (adsorption) *Les hydrocarbures La mesure des hydrocarbures dans les eaux constitue une opération souvent délicate. Les hydrocarbures sont déterminables selon diverses méthodes. Par exemple : détermination par la méthode du dosage des matières organiques en suspension dans l'eau extractibles à l'hexane: c'est une méthode de mesure par absorption et floculation des matières organiques (hydrocarbures compris) dans une colonne garnie d'hydroxyde d'aluminium, extraction du floculat à l'hexane, puis dosage gravimétrique après évaporation du solvant. Cette méthode permet de mesurer les hydrocarbures insolubles et reproduit sensiblement le processus de leur épuration par des procédés physico-chimiques. *Les micro-polluants Le terme "micropolluants" désigne un ensemble de substances qui, en raison de leur toxicité, de leur persistance, de leur bio-accumulation, sont de nature à engendrer des nuisances même lorsqu'elles sont rejetées en très faibles quantités. 10

I. 1 -3 : PARAMETRES BIOLOGIQUES L’analyse biologique comprend la détermination de la demande biochimique en oxygène, la détermination des germes pathogènes, l’évaluation de la toxicité, etc… I. 1. 3. 1: La demande biochimique en oxygène Comme on l’a déjà indiqué plus haut, elle exprime la quantité d’oxygène nécessaire aux micro-organismes pour assurer l’oxydation des matières organiques présentes dans l’eau usée. I. 1. 3. 2: Les germes pathogènes En fonction des activités exercées, notamment dans le cas d'installations exerçant des activités agricoles ou agro-alimentaires, les eaux résiduaires industrielles peuvent véhiculer des organismes (bactéries, virus, protozoaires, helminthes), dont certains sont susceptibles d'être pathogènes. L'identification précise des micro-organismes pathogènes dans l'eau étant une opération longue, il est d'usage de se limiter à une numération de germes spécifiques, dits "germes tests", qui comprennent les coliformes, dont le genre Escherichia coli, et les streptocoques fécaux. 11

I. 1. 3. 3: Evaluation de la toxicité Pour estimer la toxicité d’une substance, on introduit une espèce dans une solution de la substance étudiée et on mesure les paramètres: CE 50 -t min: concentration effective du toxique entrainant une diminution de 50% de l’activité de l’espèce utilisée pour le test après un temps de contact de t min CL 50 -t min: Concentration létale qui est la concentration du toxique susceptible de faire périr 50% de la population biologique en un temps de t min Remarques: • Chaque valeur de CE 50 -t min et CL 50 -t min doit être définie par rapport à l’espèce utilisée • Les conditions du test (p. H, T…) sont indispensables à préciser pour la standardisation des tests • la réalisation des tests implique des essais effectués simultanément sur plusieurs lots : un témoin sans toxique et plusieurs lots auxquels on ajoute des concentrations croissantes de toxiques • Les tests de toxicité sont classés en deux catégories: • Tests aigus: l’exposition est courte par rapport à la vie du matériel biologique. L’effet observé est généralement une différence de comportement (CE 50 -t min) ou une mortalité (CL 50 -t min ). • Tests chroniques: L’exposition est longue par rapport à la vie du matériel biologique pouvant porter sur une génération complète 12

I. 2. NORMES DE REJETS DES EFFLUENTS Une eau sera dite polluée si les paramètres physico-chimiques et micro biologiques mesurés ont des valeurs qui dépassent certaines limites définies par les services de normalisation des pays. Ces valeurs limites dépendent des objectifs visés. Il peut s’agir de l’eau destinée à la consommation, de l’eau destinée à être rejetée dans des récepteurs comme les lagunes…. Dans certains pays comme le Sénégal, les eaux résiduaires rejetées en milieu naturel doivent respecter les valeurs limites suivantes : T<30°C 5, 5<p. H<8, 5 Selon la norme Française, les limites définies pour les rejets sont : DCO 200 mg/L MES 40 mg/L DBO 5 50 mg/L Azote total 20 mg/L Phospohore total 10 mg/L Hydrocarbures totaux 50 mg/L Arsenic 0, 2 mg/L Microbiologie Coliformes fécaux unités (nombre)/100 m. L 2000 Streptocoques fécaux ……………. . /100 m. L 1000 13

Quelques valeurs de paramètres en relation avec la qualité des eaux 14

I. 3 Calcul de quelques paramètres globaux (DCO, COT, XOT) DCO Exemple: solution 1 g/L éthanol CH 3 CH 2 OH + 3 O 2 2 CO 2 + 3 H 2 O 46 3 x 32 Remarque : L’oxydation d’un produit organique conduit toujours à une diminution de la DCO 15

Exemple : Oxydation d’une solution de 1 g/L méthanol DCO (g/L) 1. 5 % DCO éliminé - 1. 0 33 0. 49 67 0 100 Des interférences peuvent être causées par des sels minéraux titrant à la DCO comme les ions chlorures. Il faut en tenir compte 16 dans la détermination de la DCO des matières organiques

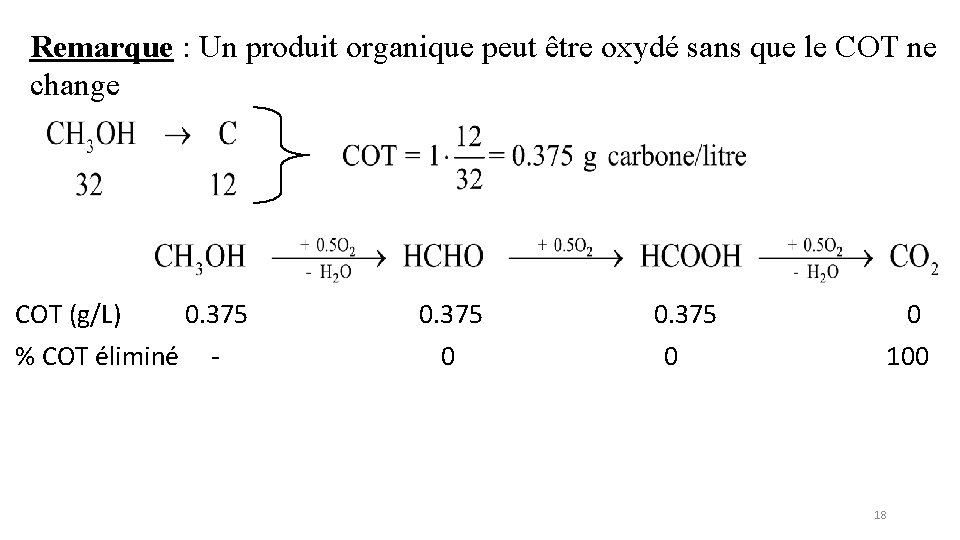
COT Exemple : Solution 1 g/L éthanol CH 3 CH 2 OH 46 g 2 C 24 g COT = 1 x 24/46= 0, 52 g/L COT* = 0. 52/12= 0, 043 mol C/L Remarque : Un produit organique peut être oxydé sans que le COT ne change 17

Remarque : Un produit organique peut être oxydé sans que le COT ne change COT (g/L) 0. 375 % COT éliminé - 0. 375 0 0 100 18

Exemple : Oxydation d’une solution de 1 g/L méthanol Exercice d’application Déterminer le COT et la DCO d’une eau contenant : 1 g/L aniline (C 6 H 5 NH 2) +0, 5 g/L Chlorophénol (C 6 H 4 OHCl)+1 g/L Na 2 CO 3 +8 mg/L O 2 NB: Le N-organique est transformé en NH 3 et le Cl-organique en HCl Solution 19

COT aniline=1 x 6 x 12/93=0. 77 g/L COT chlorophenol=0, 5 x 6 x 12/128, 5=0, 28 g/L COT=COT aniline+COTchlorophenol=0, 77+0, 28=1, 05 g/L Exemple: solution 1 g/L CCl 3 COOH 3 Cl 163, 5 106, 5 20

Exercice Déterminer le POX, EOX, AOX et le TOX d’une eau résiduaire avec la composition : Compose volatile CH 2 Cl 2 : 80 mg/L ; compose hydrophile CCl 3 COOH : 50 mg/L Compose lipophile Pentachlorobenzene: 20 g/L, Na. Cl: 100 mg/L Solution Volatile: POX=0, 08 x 2 x 35, 5/85=66, 8 mg/L Lipophile EOX=0, 02 x 5 x 35, 5/250, 5=14, 1 mg/L Hydrophile AOX=0, 05 x 3 x 35, 5/163, 5=32, 6 mg/L TOX=AOX+POX+EOX=113, 5 mg/L 21

I. 4 ETAT D’OXYDATION MOYEN DU CARBONE 1. Rappel sur les degré d’oxydation Le degré d’oxydation d’un atome contenu dans un élément est zéro. Le degré d’oxydation d’un ion monoatomique est égal à sa charge. Le degré d’oxydation de l’oxygène est de -2 dans ses composés covalents comme CO , SO 2. L’exception à cette règle concerne les peroxydes (groupement contenant O 22 - où l’on attribue un degré d’oxydation -1 à chaque atome d’oxygène. Le degré d’oxydation de l’hydrogène est +1 quand il forme un composé covalent avec un nom métal. Sauf dans les hydrures où le degré d’oxydation de l’hydrogène est -1 (Li. H ; H 2 S) Le fluor a toujours le degré d’oxydation -1 dans ses composés Dans un composé électriquement neutre, la somme des degrés d’oxydation de ses composantes vaut zéro. Dans le cas des ions, la somme des degrés d’oxydation de ses composantes est égale à la charge de l’ion. 22

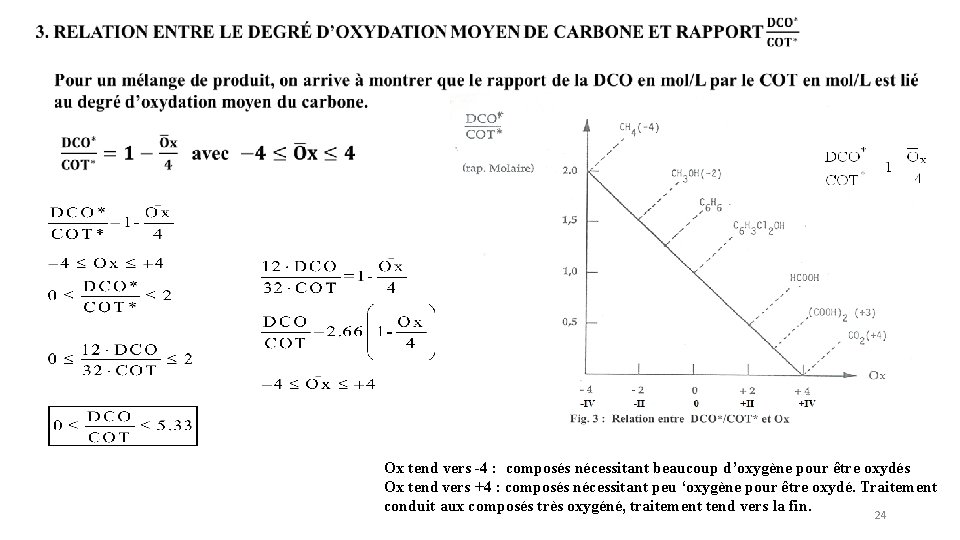
2. Détermination du degré d’oxydation moyen du carbone 23

Ox tend vers -4 : composés nécessitant beaucoup d’oxygène pour être oxydés Ox tend vers +4 : composés nécessitant peu ‘oxygène pour être oxydé. Traitement conduit aux composés très oxygéné, traitement tend vers la fin. 24

II TRAITEMENT DES EAUX USEES Le traitement des eaux usées consiste à éliminer les matières minérales et organiques en suspension et en solution, ainsi qu’un certain nombre de déchets divers afin d’obtenir une eau traitée (épurée) conforme aux normes de rejets. Le traitement des eaux usées nécessite une succession d’étapes faisant appel à des traitements physiques, physico-chimiques et biologiques. La méthode physique de traitement des eaux usées regroupe le dégrillage, la distillation, l’extraction, l’absorption, l’adsorption, l’entrainement, la concentration, la floculation, la précipitation, la filtration…. La méthode chimique de traitement des eaux regroupe l’oxydation par voie humide (OVH), l’oxydation avec l’ozone (O 3), l’oxydation avec les rayons ultraviolets, l’oxydation avec le peroxyde d’hydrogène, etc… La méthode biologique concerne la méthode dans laquelle les polluants sont dégradés par les micro-organismes avec consommation d’oxygène (procédé aérobie) ou digestion en l’absence d’oxygène (procédé anaérobie). Parmi ces méthodes, les méthodes biologiques sont les plus économiques. Les polluants industriels n’étant pas toujours tous biodégradables, nous allons nous intéresser dans le cadre de ce cours au traitement par oxydation chimique et électrochimique. 1 -Traitement des eaux usées par oxydation chimique C’est un procédé dans lequel, la dégradation des polluants se fait principalement par l’emploi d’un oxydant. Dans ce procédé, l’oxydant et les polluants sont mis en contact dans des réacteurs et dans des conditions données. L’optimisation de ce procédé nécessite un choix judicieux de l’oxydant à utiliser. 25

1 -1 -Critères pour le choix de l’oxydant L’oxydant do-un pouvoir oxydant aussi grand que possible c'est-à-dire un potentiel redox élevé -une cinétique d’oxydation des produits organiques rapide -une cinétique d’oxydation de l’eau (réaction parasite) lente -avoir un réducteur conjugué peu gênant surtout en termes de toxicité -ne conduit pas à la formation de composés toxiques -un coût compatible avec une mise en œuvre économique du procédé -un large domaine d’application Les oxydants qui répondent partiellement à ces critères sont : -le Cl 2, Cl. O 2 ou HOCl -le peroxyde d’hydrogène (H 2 O 2) -l’ozone -KMn. O 4 -Persulfates Le choix de l’oxydant dépend : -des objectifs à atteindre (pré-traitement ou traitement final) -des réactions parasites possibles (formation des produits toxiques) 26

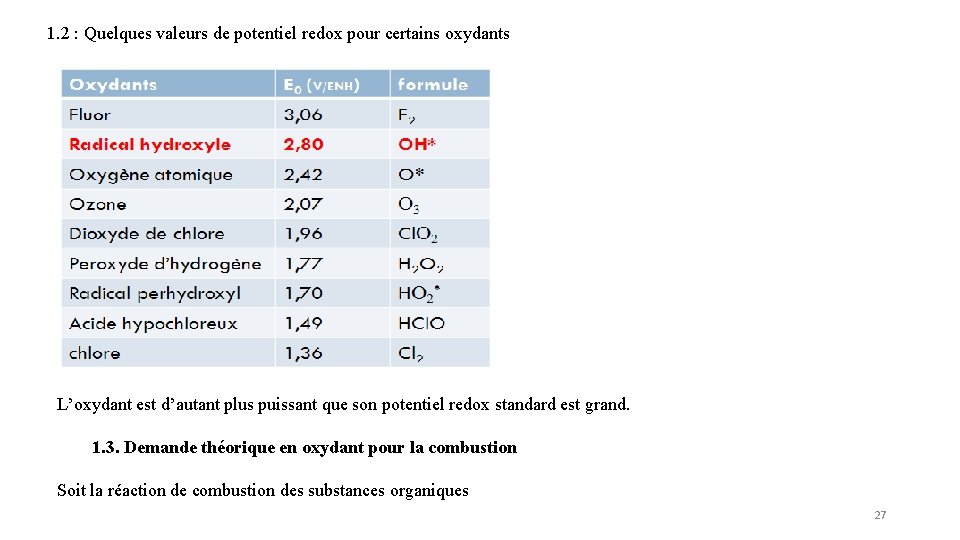
1. 2 : Quelques valeurs de potentiel redox pour certains oxydants L’oxydant est d’autant plus puissant que son potentiel redox standard est grand. 1. 3. Demande théorique en oxydant pour la combustion Soit la réaction de combustion des substances organiques 27
![Avec O oxygène actif de loxydant Exemple combustion du phénol Demande théorique Avec [O] << oxygène actif >>de l’oxydant Exemple : combustion du phénol Demande théorique](https://slidetodoc.com/presentation_image_h2/55b44c390a568249e382b0d1a5c6b40d/image-28.jpg)
Avec [O] << oxygène actif >>de l’oxydant Exemple : combustion du phénol Demande théorique en oxydant (DTO) en kg/m 3 Avec n : moles de [O] par mole d’oxydant M : masse molaire de l’oxydant (g/mol) DCO : demande chimique en oxygène (kg/m 3) 28

Exemple : oxydant H 2 O 2 1. 3. 1 -Oxydation par H 2 O 2 A température ambiante, H 2 O 2 est métastable et se décompose avec libération d’oxygène (réaction exothermique) H 2 O 2 H 2 O +1/2 O 2 Cette décomposition est catalysée par les sels des métaux. Le H 2 O 2 peut produire des radicaux hydroxyles en présence de Fe 2+ ou de Fe 3+ comme catalyseur à p. H=3 (réactif de Fenton) Ces radicaux hydroxyles sont très réactifs et peu sélectifs. 29

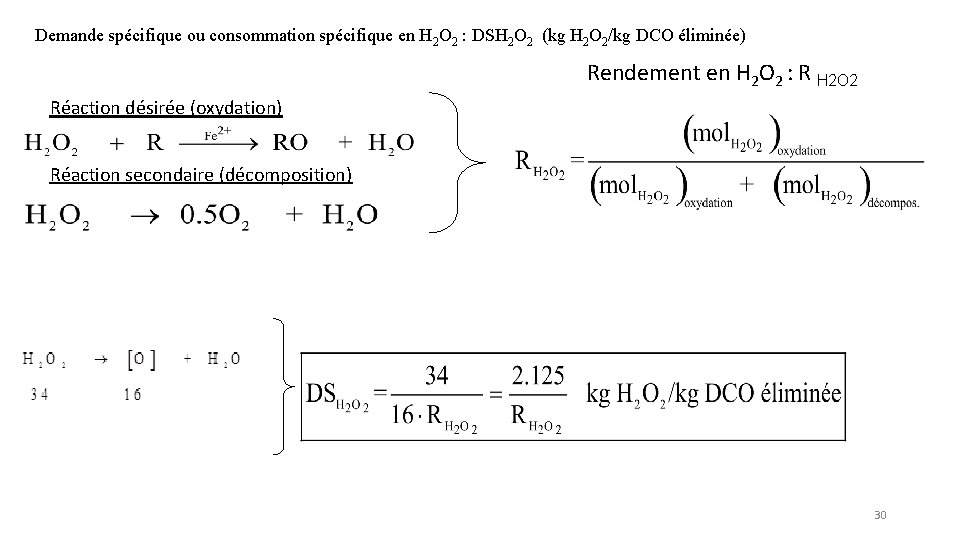
Demande spécifique ou consommation spécifique en H 2 O 2 : DSH 2 O 2 (kg H 2 O 2/kg DCO éliminée) Rendement en H 2 O 2 : R H 2 O 2 Réaction désirée (oxydation) Réaction secondaire (décomposition) 30

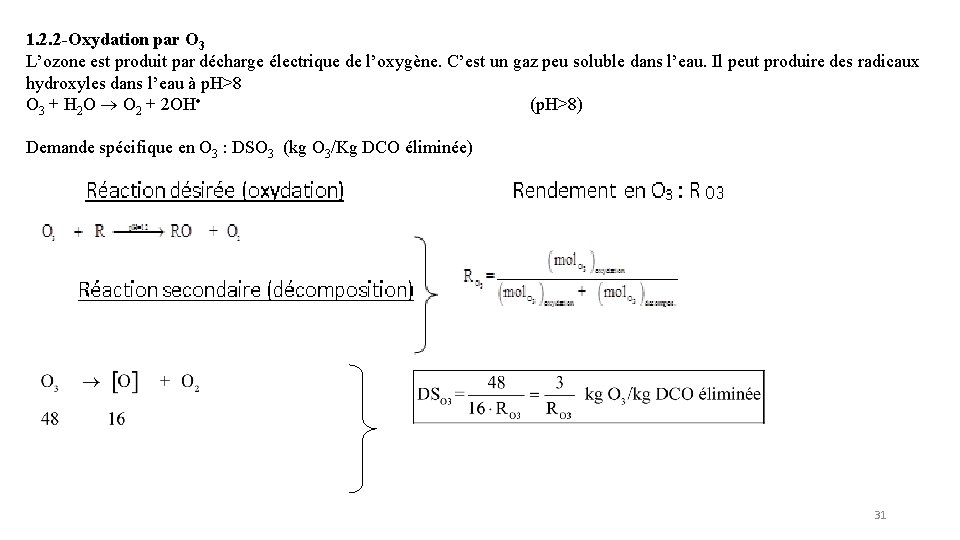
1. 2. 2 -Oxydation par O 3 L’ozone est produit par décharge électrique de l’oxygène. C’est un gaz peu soluble dans l’eau. Il peut produire des radicaux hydroxyles dans l’eau à p. H>8 O 3 + H 2 O O 2 + 2 OH (p. H>8) Demande spécifique en O 3 : DSO 3 (kg O 3/Kg DCO éliminée) 31

1. 2. 4 -Incinération des produits organiques L’incinération des produits organiques est effectuée avec de l’air à environ 1000°C Organique + O 2 CO 2 + SO 2 + NOx L’installation industrielle est complexe et nécessite une maintenance intensive. Un désavantage majeur de ce procédé est la formation d’une quantité considérable de gaz contenant du SO 2 et NO 2. Le traitement par incinération est économiquement rentable seulement pour des concentrations en DCO supérieures à 300 kg/m 3. 1. 2. 5 Désinfection de l’eau On utilise souvent des oxydants (chlore, bioxyde de chlore, ozone…. ) pour la désinfection de l’eau. Il sera donc nécessaire de: • Tenir compte de la demande chimique en oxydant pour l’oxydation de ces produits oxydables (réactions d’oxydation annexes) avant de décider de la concentration optimale de chlore à appliquer pour la désinfection proprement dite. • Identifier et quantifier (en mg/l) les produits d’oxydation et leur effet sur la qualité de l’eau. (halomethanes, chloramines, chlorophenol, trichloronitromethane…. ) Les substances oxydables majeures présentes dans les eaux naturelles sont: Cl-, Br-, Fe 2+, Mn+2, NH 4+ (NH 3), acides humiques, phénols, pesticides… Les acides humiques sont des composés organiques d’origine naturelle. 32

1. 2. 5. 1 Traitement de l’eau par chloration Deux types de produits conviennent à la chloration: • le chlore (Cl 2 liquide ou gaz ) • l’hypochlorite de sodium (solution de Na. Cl. O 130 à 150 g/l en chlore actif *) • L’hypochlorite de calcium Ca(Cl. O)2 (solid) * chlore actif (g Cl/l)= chlore dissous(Cl 2) + acide hypochloreux (HCl. O) + hypochlorite (Cl. O-) Lorsque la réaction (4) est complète, le chlore rajouté en excès se retrouve sous forme de chlore libre. 1. 2. 5. 2 Désinfection de l’eau par l’ozone Dans les stations de traitement, l’ozone est produit sur place, généralement par le procédé de décharge électrique. *La concentration d’ozone dans l’air ozoné ne dépasse pas 2 %. 33

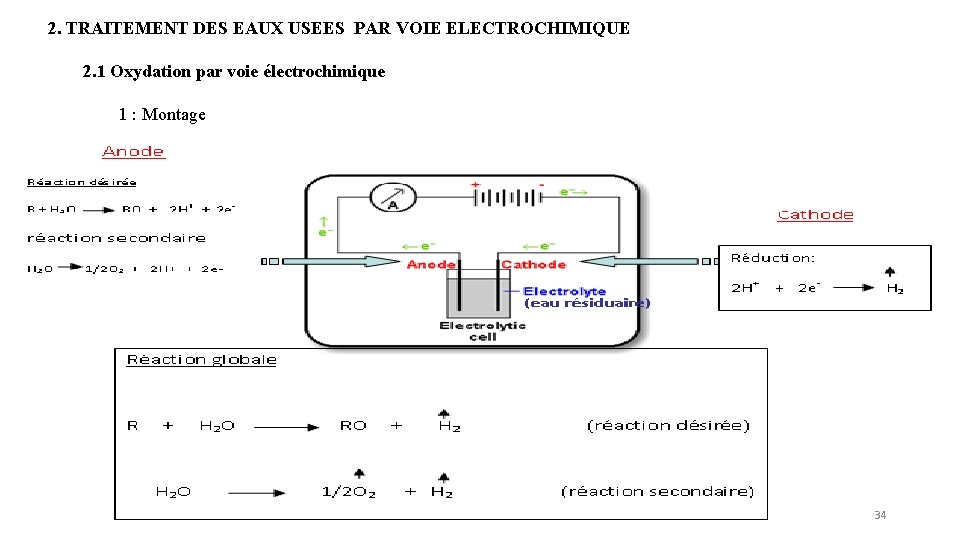
2. TRAITEMENT DES EAUX USEES PAR VOIE ELECTROCHIMIQUE 2. 1 Oxydation par voie électrochimique 1 : Montage 34

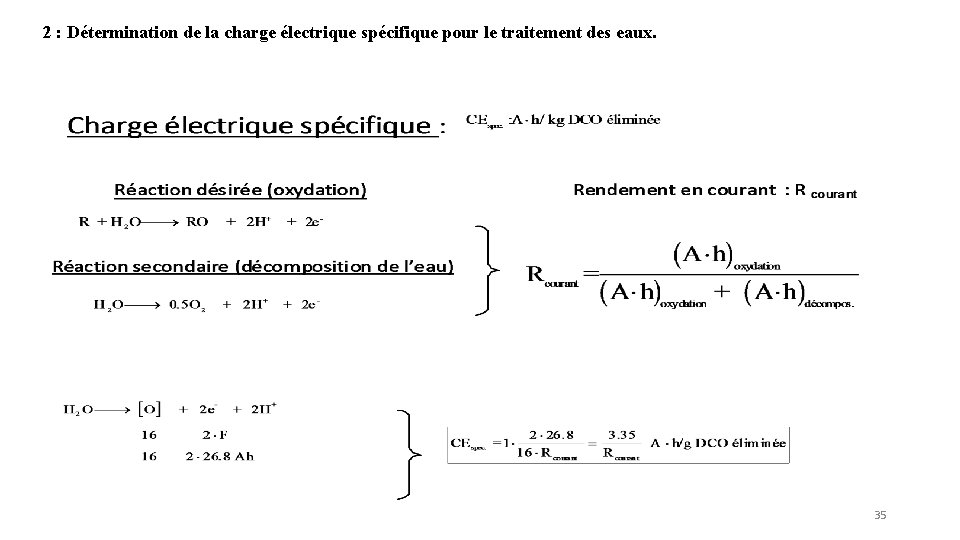
2 : Détermination de la charge électrique spécifique pour le traitement des eaux. 35

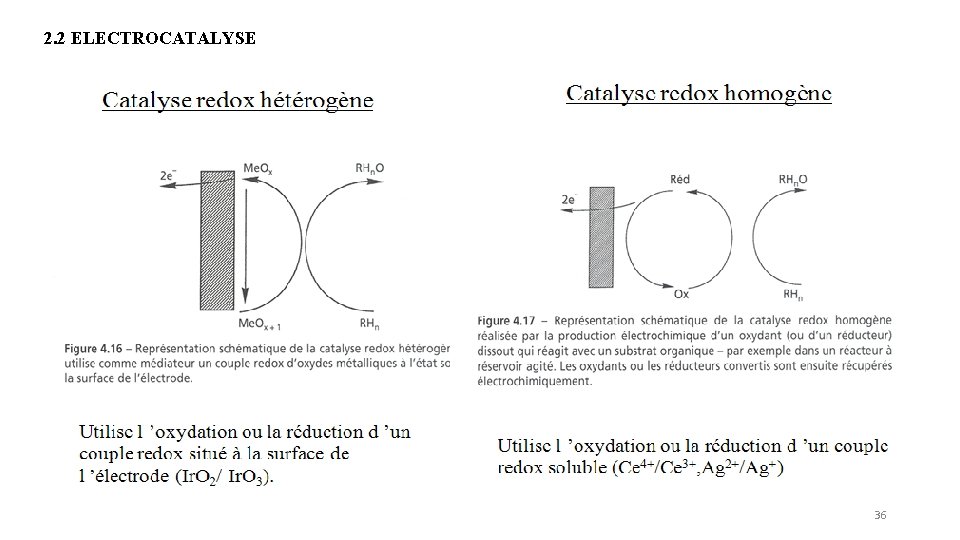
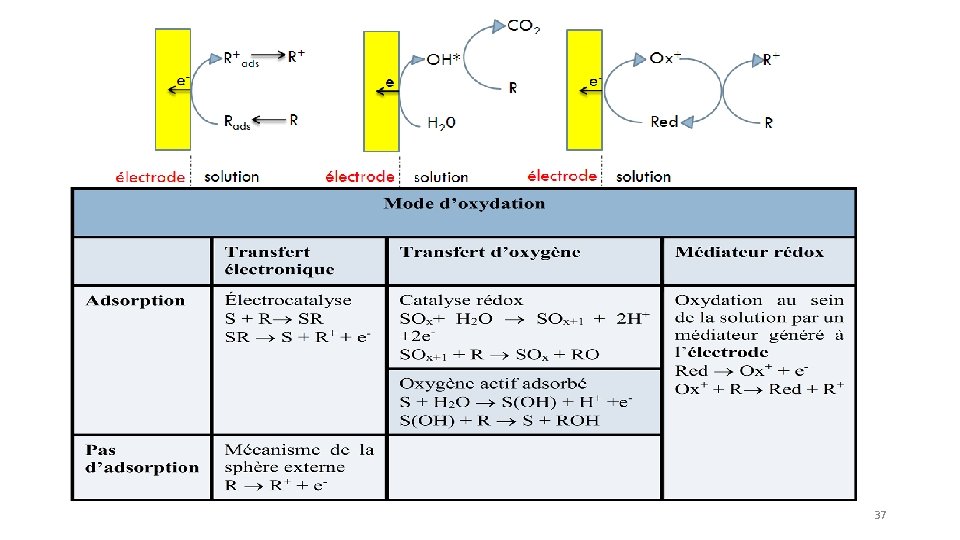
2. 2 ELECTROCATALYSE 36

37