CHIMICA GENERALE ED INORGANICA Corso di Laurea in























- Slides: 35

CHIMICA GENERALE ED INORGANICA Corso di Laurea in Scienze Agrarie, Forestali e Ambientali (SAFA) Prof. ssa Diana Rosita

ü INFORMAZIONI PRELIMINARI ü GENERALITA’ SULLA STRUTTURA ATOMICA

UNITA’ DI MISURA FONDAMENTALI S. I. GRANDEZZA Lunghezza Massa Tempo Corrente elettrica Temperatura termodinamica Quantità di sostanza Intensità luminosa UNITA’ DI MISURA SIMBOLO Metro Chilogrammo Secondo Ampere Kelvin Mole Candela m kg s A K mol Col UNITA’ DERIVATE GRANDEZZA Area Carica elettrica Densità Differenza di potenziale elettrico Energia Forza Frequenza Massa molare Pressione Resistenza elettrica Volume UNITA’ DI MISURA SIMBOLO Metro quadrato Coulomb Kg per m 3 m 2 C kg m-3 Volt V Joule Newton Hertz Kg per mole Pascal ohm Metro cubo J N Hz kg mol-1 Pa Ω m 3 Conversione: 1 dm 3=1 L 1 cm 3=1 m. L Una proprietà fisica è una caratteristica che può essere osservata e misurata senza cambiare l’identità della sostanza in esame. Una proprietà chimica si riferisce all’attitudine di una sostanza a mutarsi in un’altra.

MATEMATICA DA CONOSCERE 1) Logaritmi ed operazioni tra logaritmi (Log) Log a + Log b = Log (a b) Log a – Log b = Log (a/b) 2) Esponenziali ed operazioni (in particolare in base 10) 10 a · 10 b = 10(a+b) 10 a / 10 b = 10(a-b) 3) Equazioni di I grado Equazioni di II grado Sistemi di equazione di I grado Disequazioni di I grado Equazioni di II grado, formula risolutiva per complete e pure

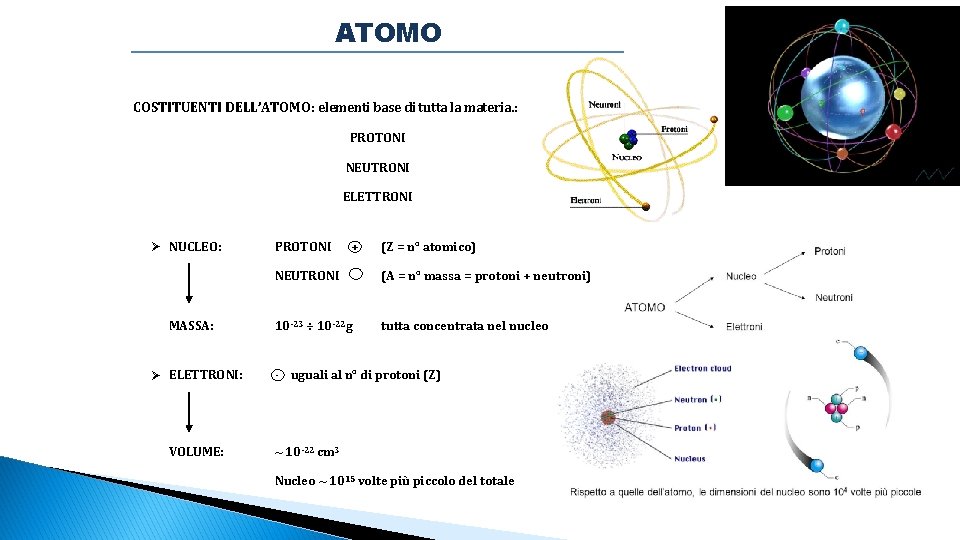
ATOMO COSTITUENTI DELL’ATOMO: elementi base di tutta la materia. : PROTONI NEUTRONI ELETTRONI Ø NUCLEO: MASSA: Ø ELETTRONI: VOLUME: PROTONI + (Z = n° atomico) NEUTRONI (A = n° massa = protoni + neutroni) 10 -23 ÷ 10 -22 g tutta concentrata nel nucleo - uguali al n° di protoni (Z) ~ 10 -22 cm 3 Nucleo ~ 1015 volte più piccolo del totale

Gli atomi sono costituiti da questi tre “ingredienti” base. I vari atomi differiscono tra loro per il n° di tali costituenti. Gli elettroni più esterni (di VALENZA) rispetto al nucleo sono fondamentali per determinare le differenze e/o affinità di comportamento tra gli atomi. La materia, in ogni suo stato – SOLIDO, LIQUIDO, GASSOSO – è costituita da ATOMI ISOTOPI: ELEMENTI CHE DIFFERISCONO SOLO PER IL NUMERO DI NEUTRONI.

MATTONE DI BASE DELLA MATERIA: ATOMO COMPOSTI gruppi di atomi legati da vari tipi di legame. (molecole, unità formula, complessi etc…) • Preparazione dei composti • Analisi dei composti • Trasformazione dei composti CHIMICA


Teoria atomica: «Tutta la materia consta di varie combinazioni di forme semplici dette elementi chimici. Un elemento è una sostanza costituita da un tipo di atomi. » Ø Tutti gli atomi di un dato elemento sono identici Ø Gli atomi di elementi diversi possiedono massa differente Ø Un composto è una specifica combinazione di atomi di più di un elemento Ø In una reazione chimica gli atomi non vengono creati o distrutti, ma semplicemente cambiano «partner»

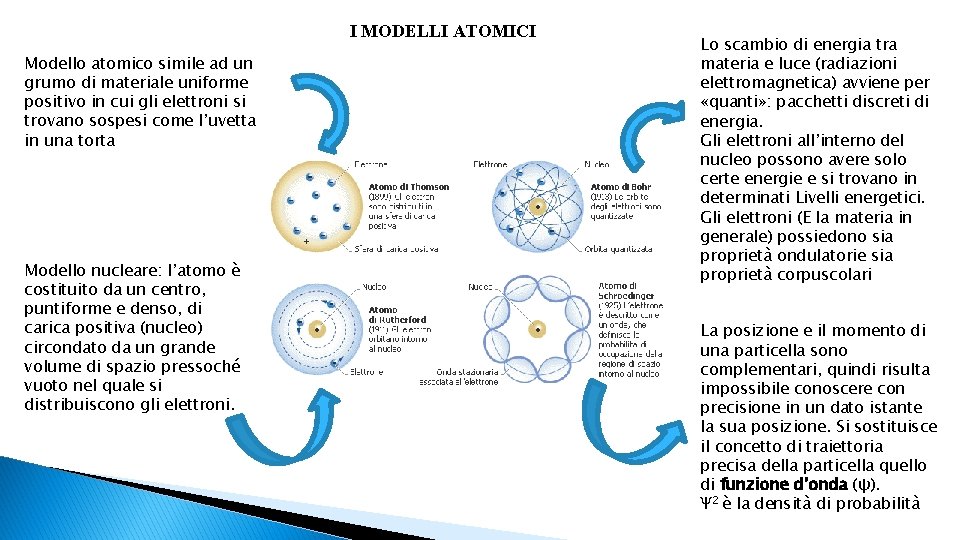
I MODELLI ATOMICI Modello atomico simile ad un grumo di materiale uniforme positivo in cui gli elettroni si trovano sospesi come l’uvetta in una torta Modello nucleare: l’atomo è costituito da un centro, puntiforme e denso, di carica positiva (nucleo) circondato da un grande volume di spazio pressoché vuoto nel quale si distribuiscono gli elettroni. Lo scambio di energia tra materia e luce (radiazioni elettromagnetica) avviene per «quanti» : pacchetti discreti di energia. Gli elettroni all’interno del nucleo possono avere solo certe energie e si trovano in determinati Livelli energetici. Gli elettroni (E la materia in generale) possiedono sia proprietà ondulatorie sia proprietà corpuscolari La posizione e il momento di una particella sono complementari, quindi risulta impossibile conoscere con precisione in un dato istante la sua posizione. Si sostituisce il concetto di traiettoria precisa della particella quello di funzione d’onda (ψ). Ψ 2 è la densità di probabilità

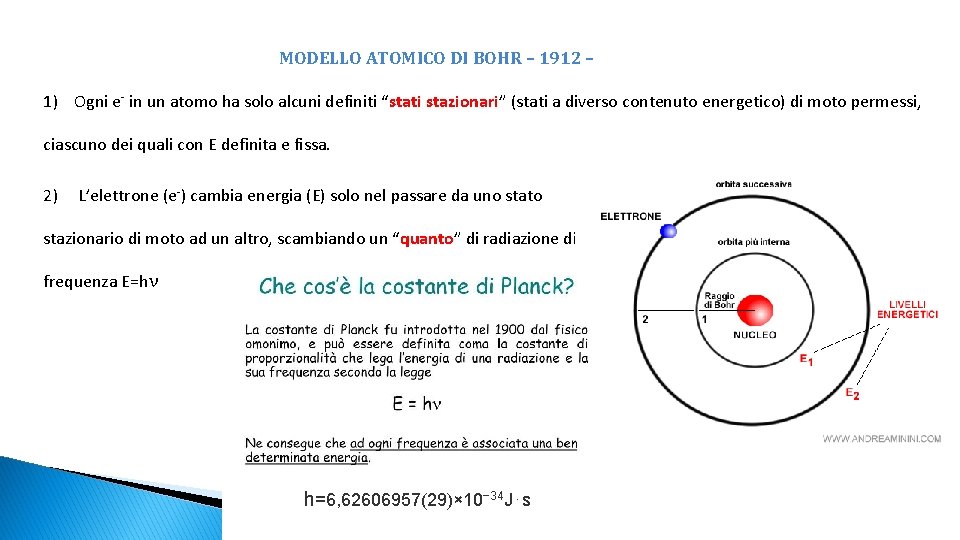
MODELLO ATOMICO DI BOHR – 1912 – 1) Ogni e- in un atomo ha solo alcuni definiti “stati stazionari” (stati a diverso contenuto energetico) di moto permessi, ciascuno dei quali con E definita e fissa. 2) L’elettrone (e-) cambia energia (E) solo nel passare da uno stato stazionario di moto ad un altro, scambiando un “quanto” di radiazione di frequenza E=hν h=6, 62606957(29)× 10− 34 J⋅s

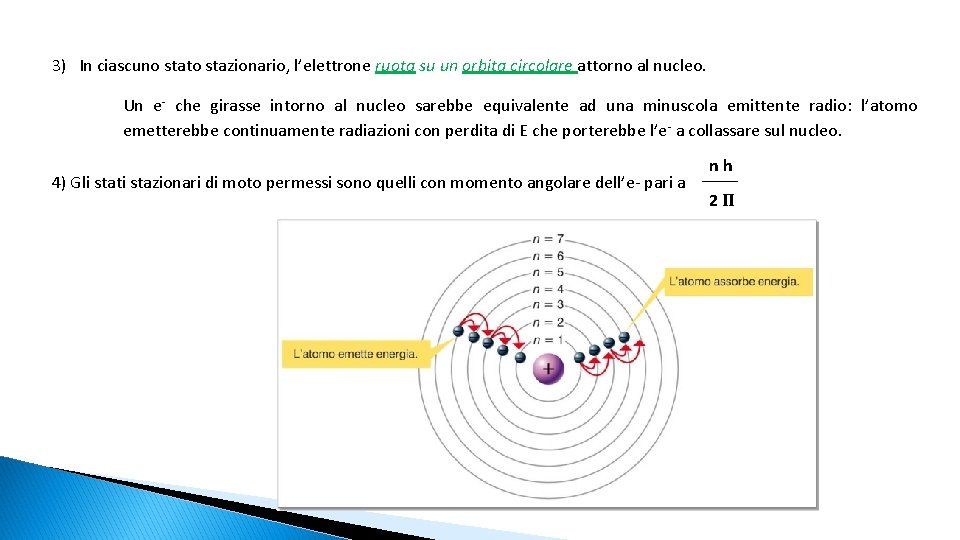
3) In ciascuno stato stazionario, l’elettrone ruota su un orbita circolare attorno al nucleo. Un e- che girasse intorno al nucleo sarebbe equivalente ad una minuscola emittente radio: l’atomo emetterebbe continuamente radiazioni con perdita di E che porterebbe l’e - a collassare sul nucleo. 4) Gli stati stazionari di moto permessi sono quelli con momento angolare dell’e- pari a nh 2Π

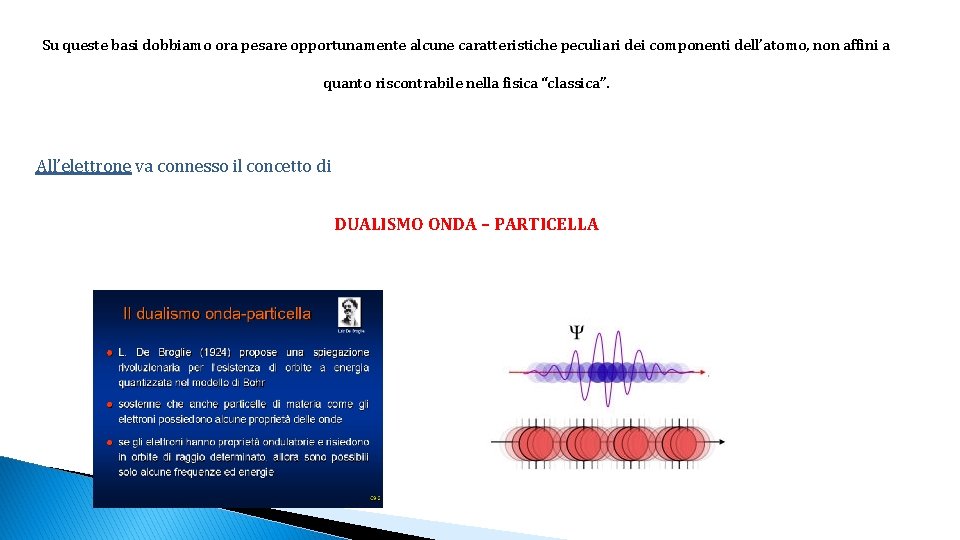
Su queste basi dobbiamo ora pesare opportunamente alcune caratteristiche peculiari dei componenti dell’atomo, non affini a quanto riscontrabile nella fisica “classica”. All’elettrone va connesso il concetto di DUALISMO ONDA – PARTICELLA

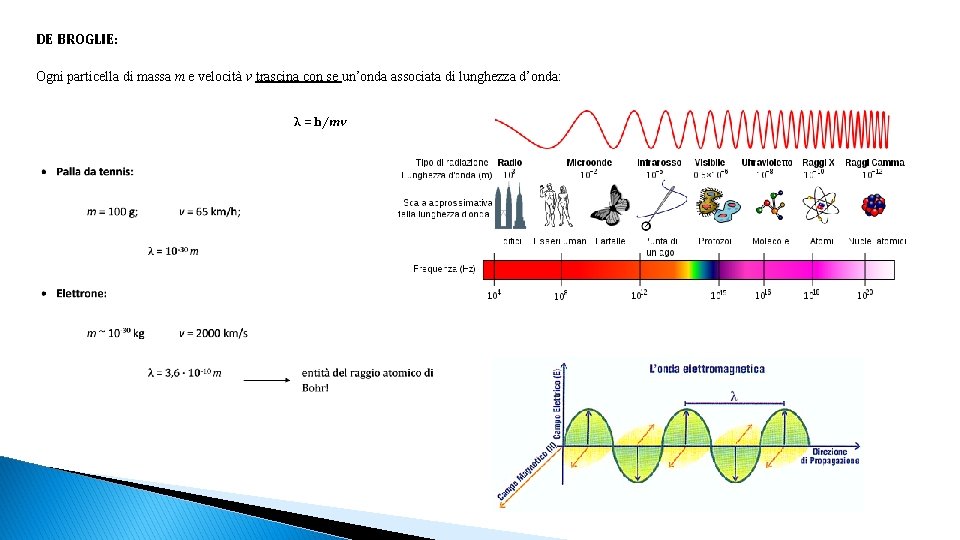
DE BROGLIE: Ogni particella di massa m e velocità v trascina con se un’onda associata di lunghezza d’onda: λ = h/mv

PRINCIPIO DI INDETERMINAZIONE DI HEISENBERG ∆x · ∆px ≥ h/2Π · ½ = h/4Π Il prodotto dell’errore ∆x che accompagna la misura della componente x della posizione della particella per l’errore ∆px che accompagna la misura della componente lungo x della quantità di moto px (=mvx) è almeno = a h/4Π. Relazione di inversa proporzionalità E’ impossibile definire un’orbita come traiettoria percorsa da un e-. Esempio: Sia nota la posizione con ∆x~10 -13 m ∆px ≥ 10 -21 Jsm-1 ∆vx = ∆px/m ≥ 109 m/s La velocità è tale che non possiamo fare nessun calcolo che ci faccia prevedere la traiettoria della particella l’istante successivo! Analogamente definendo nota la posizione, nessun calcolo ci permetterà di ottenere con un grado sufficiente di confidenza, la velocità della particella

UN MODELLO ATTUALE PER L’ATOMO DI IDROGENO-MECCANICA QUANTISTICA 1) L’E TOT dell’atomo (che può essere assorbita o emessa) è quantizzata ( vedi spettro di righe H). 2) La carica elettrica è quantizzata (vedi Millikan). 3) Per alcuni atomi la struttura interna è tale che le cariche elettriche in movimento possiedono un momento angolare e un momento magnetico quantizzati (Stern e Gerlach) Modello (H)

MODELLO: In questo modello visualizziamo l’e- come una particella che in un generico istante t si trova a distanza r dal nucleo, in un sistema cartesiano di riferimento con coordinate x, y, z. E potenziale di interazione col nucleo + E cinetica per il moto intorno al nucleo sono interdipendenti in modo tale che, per ogni istante, la loro somma (E TOT) = costante. E TOT varia solo se cediamo a o preleviamo dall’atomo energia (dall’esterno). Un'onda stazionaria è una perturbazione periodica di un mezzo materiale, le cui oscillazioni sono limitate nello spazio: in pratica non c'è propagazione lungo una certa direzione nello spazio, ma solo un'oscillazione nel tempo.

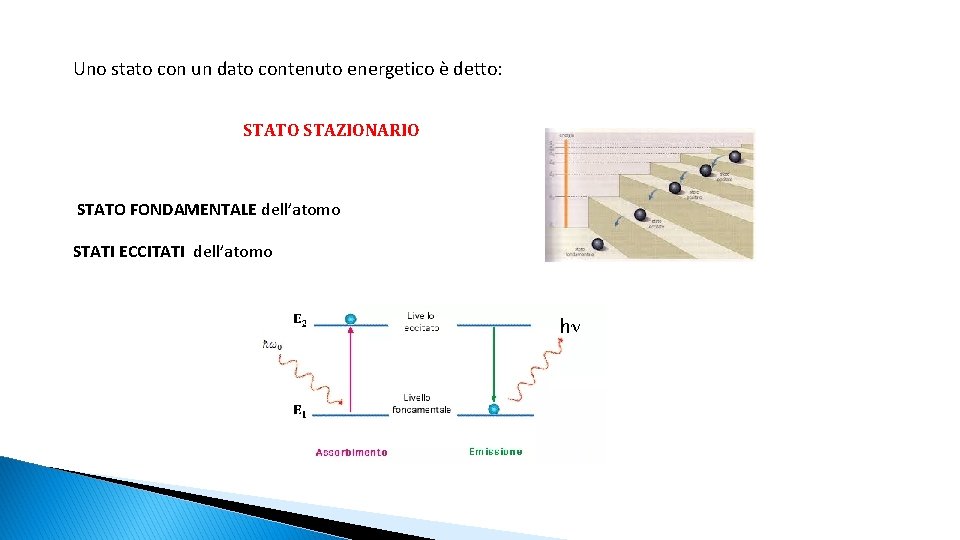
Uno stato con un dato contenuto energetico è detto: STATO STAZIONARIO STATO FONDAMENTALE dell’atomo STATI ECCITATI dell’atomo

E allora come si può dare una rappresentazione “interna” non erronea dell’atomo? Il problema è impostato matematicamente mediante un’equazione che mette in relazione le coordinate dell’e- con l’E TOT dell’atomo EQUAZIONE DI SCHROEDINGER, 1926 H Ψ= E Ψ Questa equazione matematica è atta a rappresentare il comportamento interno di un oggetto, come l’atomo di H (il più semplice). La soluzione di detta equazione è possibile solo per particolari valori dell’E dell’atomo (quantizzazione).

FUNZIONI D’ONDA ORBITALE (Ψ) Le funzioni d’onda sono appunto soluzioni dell’eq. di S. e corrispondono a valori particolari di E TOT, cioè descrivono ciascuna uno stato stazionario del sistema.

AUFBAU Le varie funzioni d’onda o orbitali differiscono per la forma matematica e per il valore di 3 parametri che sono numeri interi e possono servire a classificarle. NUMERI QUANTICI

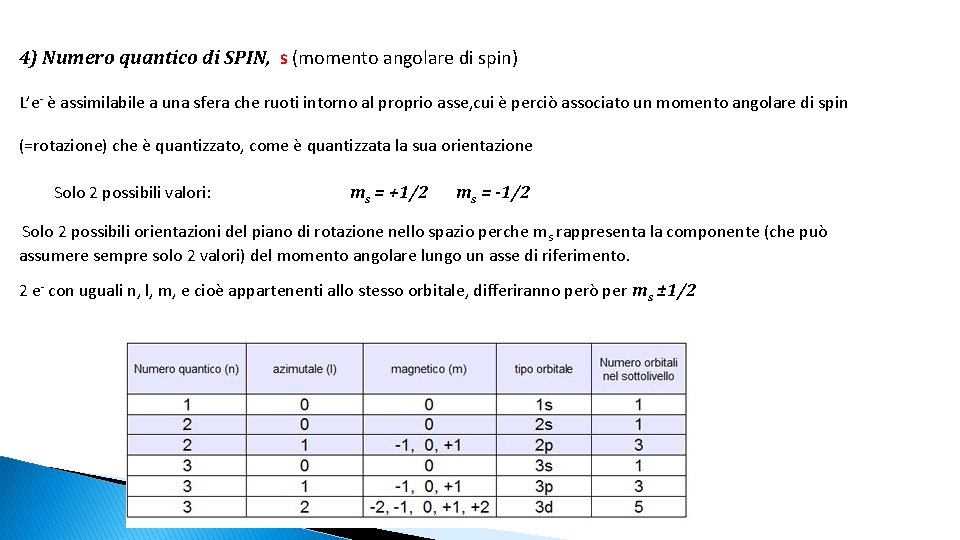
2) Numero quantico secondario o azimutale o del momento angolare: (forma e degenerazione). E’ legato al fatto che l’e- “circola” intorno al nucleo e la grandezza fisica connessa con tale moto, il momento angolare, è quantizzata l = 0 n-1 l=0 deg. 1 l=1 deg. 3 l=2 deg. 5 3)Numero quantico magnetico: m (orientazione). Legato all’orientazione spaziale – quantizzata – dei sottolivelli l m: - l + l ovvero 2 l + 1 orientazioni

4) Numero quantico di SPIN, s (momento angolare di spin) L’e- è assimilabile a una sfera che ruoti intorno al proprio asse, cui è perciò associato un momento angolare di spin (=rotazione) che è quantizzato, come è quantizzata la sua orientazione Solo 2 possibili valori: ms = +1/2 ms = -1/2 Solo 2 possibili orientazioni del piano di rotazione nello spazio perche ms rappresenta la componente (che può assumere sempre solo 2 valori) del momento angolare lungo un asse di riferimento. 2 e- con uguali n, l, m, e cioè appartenenti allo stesso orbitale, differiranno però per ms ± 1/2

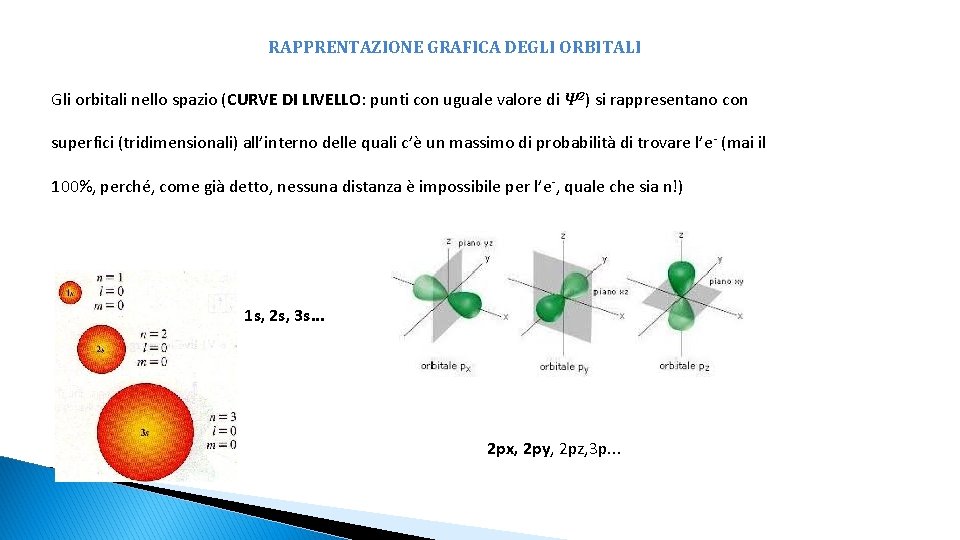
RAPPRENTAZIONE GRAFICA DEGLI ORBITALI Gli orbitali nello spazio (CURVE DI LIVELLO: punti con uguale valore di Ψ 2) si rappresentano con superfici (tridimensionali) all’interno delle quali c’è un massimo di probabilità di trovare l’e - (mai il 100%, perché, come già detto, nessuna distanza è impossibile per l’e-, quale che sia n!) 1 s, 2 s, 3 s. . . 2 px, 2 py, 2 pz, 3 p. . .

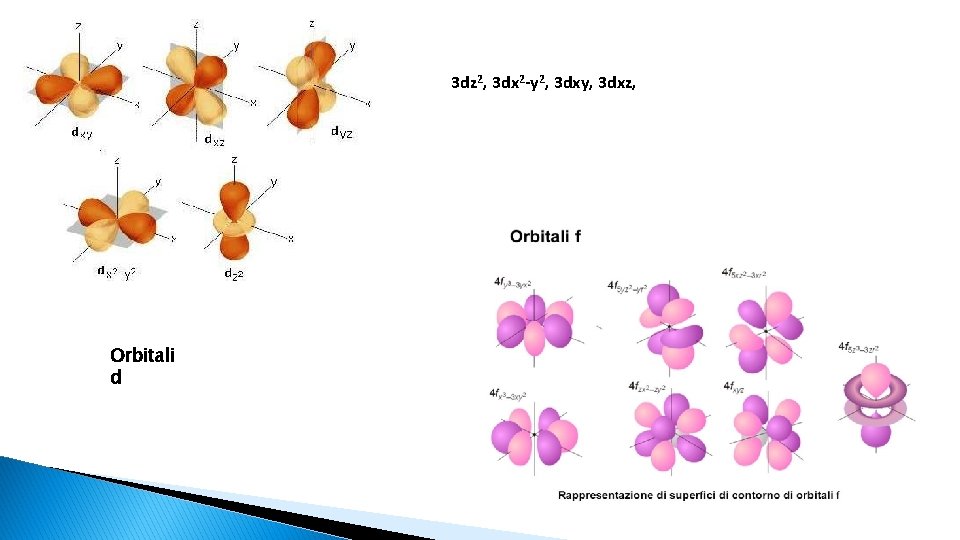
3 dz 2, 3 dx 2 -y 2, 3 dxy, 3 dxz, Orbitali d



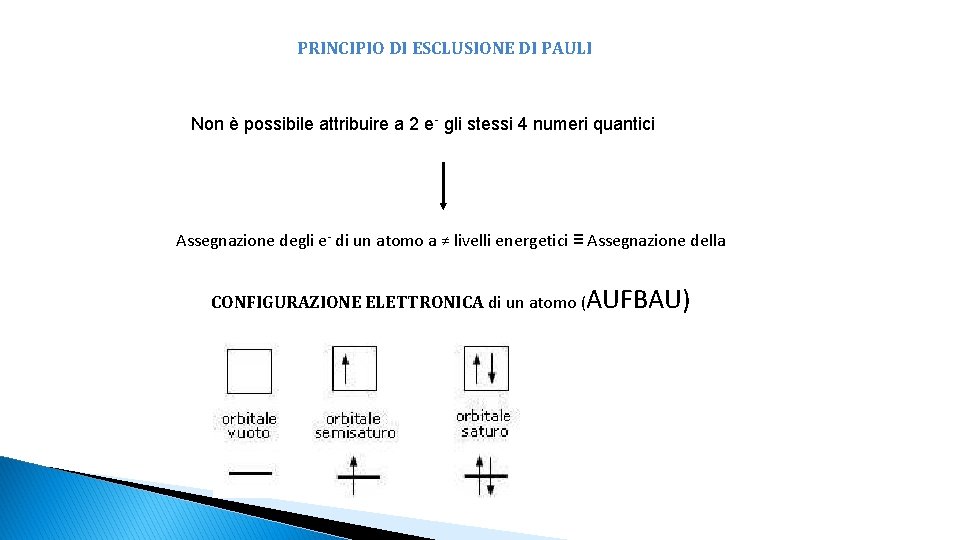
PRINCIPIO DI ESCLUSIONE DI PAULI Non è possibile attribuire a 2 e- gli stessi 4 numeri quantici Assegnazione degli e- di un atomo a ≠ livelli energetici ≡ Assegnazione della CONFIGURAZIONE ELETTRONICA di un atomo (AUFBAU)

REGOLA DI HUND Avendo a disposizione più orbitali della stessa E, gli e- tendono ad occuparli con spin paralleli fino ad esaurimento degli orbitali vuoti Esempio:

Negli atomi polielettronici c’è da considerare l’effetto di SCHERMO da parte degli altri e- relativamente ad un dato e-. L’effetto di schermo è legato alle interazioni fra gli e- tra loro e dipende dalla forma (n° quantico l) dell’orbitale l’energia dell’orbitale dipende da l. Ora siamo in grado di eseguire una assegnazione della configurazione elettronica Per esempio vediamo le configurazioni elettroniche si ricavano per alcuni elementi: B: 1 s 2 2 p 1 2 s 2 C: 1 s 2 2 p 2 2 s 2




ATOMO: valutazioni quantitative 1 UMA (mu) = unità di massa atomica = 12 a parte della massa del 12 C 1 UMA = m 12 C/12 = 1. 66053 · 10 -24 MASSA ATOMICA RELATIVA: rapporto tra la massa di un atomo e la UMA (12 a parte della massa del 12 C). La massa atomica relativa espressa in g rappresenta la massa di una mole di quegli atomi (massa molare). La massa atomica relativa si esprime dunque in genere come [g/mol] ed è detta In un atomo: In una molecola: PESO ATOMICO [g/mol] PESO MOLECOLARE = Σ pesi atomici H N CH 4 g/mol = Pa oppure mol = g/Pa (formula inversa) Pa = 14 Pa = 16 1 mole = 1 g 1 mole = 14 g 1 mole = 16 g

 Corso di laurea in scienze della formazione primaria
Corso di laurea in scienze della formazione primaria Presidente corso di laurea
Presidente corso di laurea Corso generale sicurezza sul lavoro
Corso generale sicurezza sul lavoro Quimica inorganica nomenclatura
Quimica inorganica nomenclatura Materia inorgánica
Materia inorgánica Basura organica
Basura organica Analisi qualitativa inorganica
Analisi qualitativa inorganica Como se llama el compuesto
Como se llama el compuesto Parte organica e inorganica do osso
Parte organica e inorganica do osso Dibuja los recursos naturales
Dibuja los recursos naturales Matriz inorgánica del hueso
Matriz inorgánica del hueso Linguaggio di programmazione cruciverba
Linguaggio di programmazione cruciverba Laurea finna
Laurea finna Turun amk siirtohaku
Turun amk siirtohaku Opiskelijahaku
Opiskelijahaku L-39 laurea
L-39 laurea Laurea specialistica informatica
Laurea specialistica informatica Base laurea
Base laurea Tiina ranta laurea
Tiina ranta laurea Kaisa tsupari
Kaisa tsupari Laurea in immunologia
Laurea in immunologia Laurea finna
Laurea finna Laurea magistrale editoria e giornalismo
Laurea magistrale editoria e giornalismo Laurea specialistica informatica
Laurea specialistica informatica Laurea amk
Laurea amk Calcolo voto laurea unisalento
Calcolo voto laurea unisalento Enpam riscatto laurea
Enpam riscatto laurea Unito scienze motorie magistrale
Unito scienze motorie magistrale Modellistica energetica
Modellistica energetica Corso dirigente accompagnatore basket
Corso dirigente accompagnatore basket Carlo bosna
Carlo bosna Formazione dirigenti sicurezza ppt
Formazione dirigenti sicurezza ppt Corso linguistica computazionale
Corso linguistica computazionale Gru mobile autocarrata
Gru mobile autocarrata Materiale didattico per corso haccp ppt
Materiale didattico per corso haccp ppt Corso allenatore di base basket
Corso allenatore di base basket