5 2 Neerslagreacties Reactievergelijkingen Oplosvergelijking van s naar



















- Slides: 26

§ 5. 2 - Neerslagreacties

Reactievergelijkingen • Oplosvergelijking: van (s) naar (aq) – KI (s) K+ (aq) + I- (aq) – Mg. Cl 2 (s) Mg 2+ (aq) + 2 Cl- (aq) • Indampvergelijking: van (aq) naar (s) – 3 Na+ (aq) + PO 43 - (aq) Na 3 PO 4 (s)

NEERSLAGREACTIES

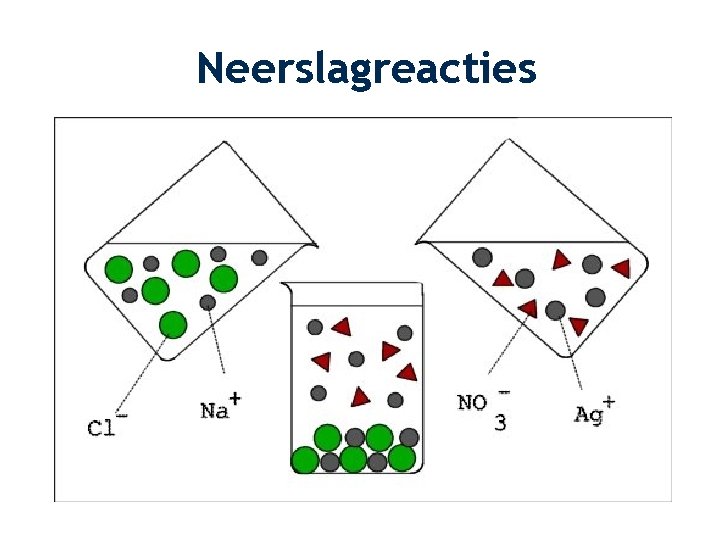
Neerslagreacties


Neerslagvergelijking 1. Deeltjes inventariseren 2. Mini-tabel 45 A 3. Neerslagreactie opschrijven 4. Kloppend maken 5. Check: deeltjes + lading

Neerslagvergelijking We voegen bij elkaar: Een oplossing van lood(II)nitraat en natriumjodide 1. 2. 3. 4. 5. Deeltjes 45 A reactie Kloppend Check Pb 2+ (aq), NO 3 - (aq), Na+ (aq), I- (aq) NO 3 - I- Pb 2+ g s Na+ g g Pb 2+ (aq) + 2 I- (aq) Pb. I 2 (s)

Weetjes • Neerslagreacties zijn dynamische, heterogene evenwichten, daarom schrijven we een dubbele pijl op • Alle natrium-, kalium-, ammonium- en nitraat- zouten zijn altijd goed oplosbaar • De ionen die samen geen neerslag vormen noemen we: tribune- ionen.

5. 3 Rekenen aan reacties

4 Cu. O + CH 4 4 Cu + CO 2 + 2 H 2 O Bereken hoeveel dm 3 methaan heeft gereageerd met 4, 0 g koper(II)oxide bij 298 K en p= p 0

Rekenen aan zouten Oplossing A: 25, 0 g koper(II)nitraat in 500 m. L water. Oplossing B: 2, 8 gram natriumsulfide in 250 m. L water De twee oplossingen worden samengevoegd. Er onstaat een neerslag. Bereken overmaat koper(II)- ionen.

5. 4 Toepassingen van neerslagreacties

De toepassingen: • Het verwijderen van ionen uit een oplossing • Het maken van zouten • Het aantonen van ionen in een oplossing

Het verwijderen van ionen uit een oplossing

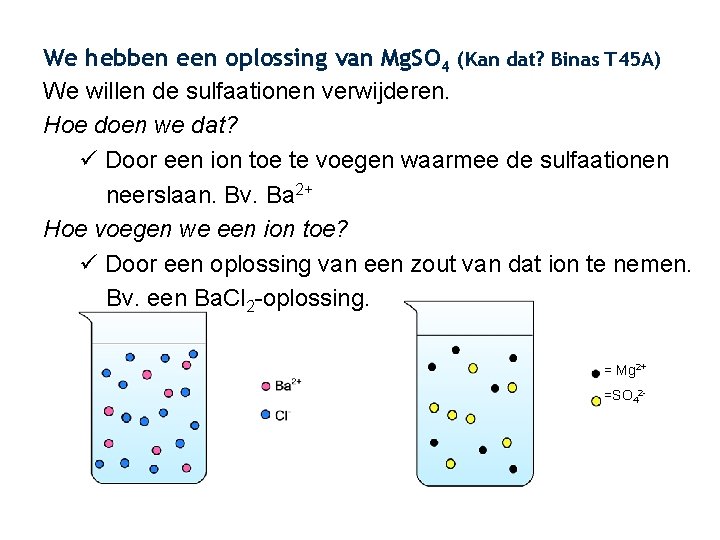
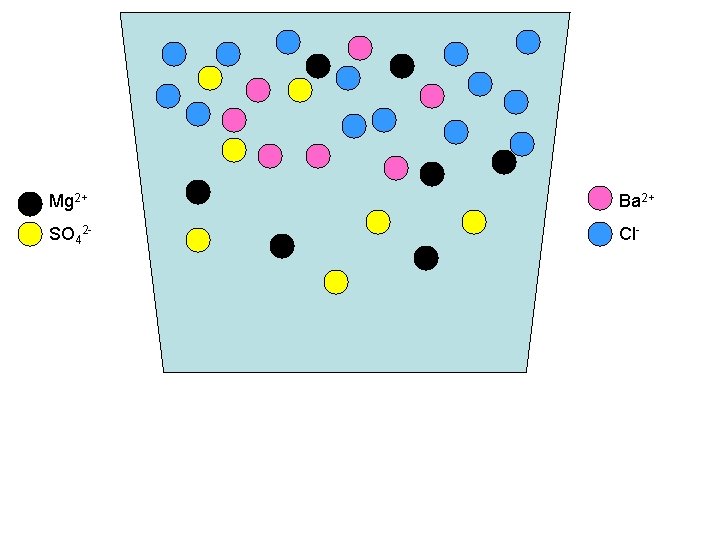
We hebben een oplossing van Mg. SO 4 (Kan dat? Binas T 45 A) We willen de sulfaationen verwijderen. Hoe doen we dat? ü Door een ion toe te voegen waarmee de sulfaationen neerslaan. Bv. Ba 2+ Hoe voegen we een ion toe? ü Door een oplossing van een zout van dat ion te nemen. Bv. een Ba. Cl 2 -oplossing. = Mg 2+ =SO 42 -

Mg 2+ Ba 2+ SO 42 - Cl-

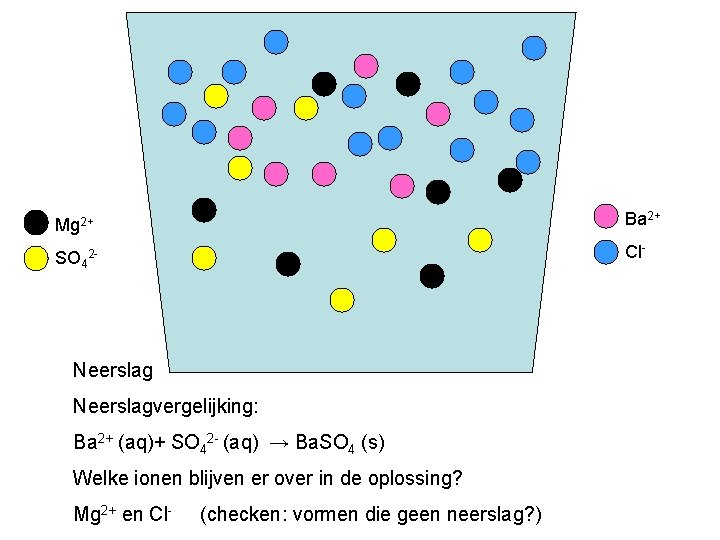
Mg 2+ Ba 2+ SO 42 - Cl- Neerslagvergelijking: Ba 2+ (aq)+ SO 42 - (aq) → Ba. SO 4 (s) Welke ionen blijven er over in de oplossing? Mg 2+ en Cl- (checken: vormen die geen neerslag? )

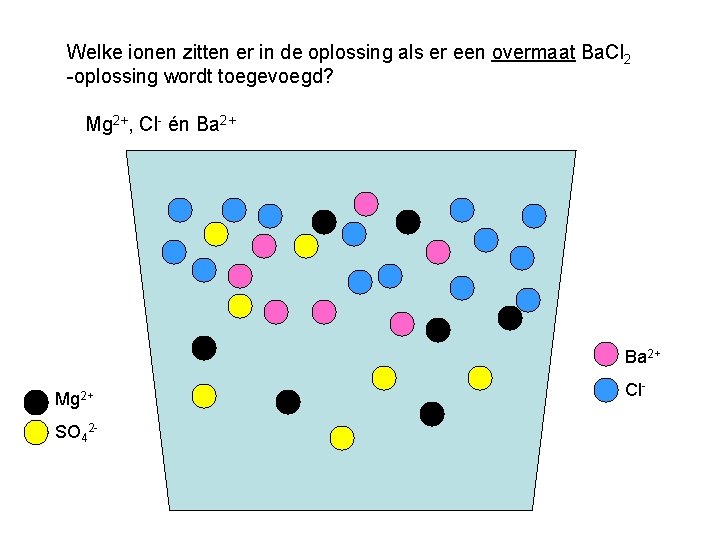
Welke ionen zitten er in de oplossing als er een overmaat Ba. Cl 2 -oplossing wordt toegevoegd? Mg 2+, Cl- én Ba 2+ Mg 2+ SO 42 - Cl-

Het maken van zouten • Slecht oplosbaar zout Twee zout- oplossingen bij elkaar en filtreren: het residu is het slecht zout. • Goed oplosbaar zout Twee zout- oplossingen bijelkaar, filtreren en het filtraat indampen

Het aantonen van ionen in een oplossing Ionen aantonen Je voegt een zout-oplossing toe wat met het ion wat je wil aantonen een neerslag vormt.

Het aantonen van ionen Hoe kun je onderscheid maken tussen natriumchloride of bariumchloride? In dit geval zit het verschil in het positieve ion. Je moet dan op zoek naar een negatief- ion dat met het ene ion een neerslag vormt en met de andere niet. Let op! Naast een negatief- ion krijg je dan ook een extra positief ion in de oplossing. Deze mag dan geen neerslag vormen. In dit geval kiezen we bijvoorbeeld voor een natriumsulfaatoplossing.


Hard water Uitleg hard water

Hard Water • Bevat veel Mg 2+ - of Ca 2+- ionen • Ontstaan: Ca. CO 3 + H 2 O + CO 2 Ca 2+ + 2 HCO 3 -

Nadelen • Kalkaanslag (wit: Ca. CO 3) • Meer zeep nodig: Ca 2+ + CH 3 COO- Ca(CH 3 COO)2 “kalkzeep”

ontharden • Verhitten • Toevoegen van natronloog (neerslag): Ca 2+ + HCO 3 - + OH- Ca. CO 3 + H 2 O
 Voorbeelden neerslagreacties
Voorbeelden neerslagreacties Neerslagreactie
Neerslagreactie Neerslagvergelijking
Neerslagvergelijking Reactievergelijkingen kloppend maken oefenen
Reactievergelijkingen kloppend maken oefenen Reactievergelijkingen maken
Reactievergelijkingen maken Molecuulformule
Molecuulformule Reactievergelijkingen opstellen
Reactievergelijkingen opstellen Het streven van vorsten naar absolute macht
Het streven van vorsten naar absolute macht Registreermijnmerk
Registreermijnmerk Van eiland naar wijland
Van eiland naar wijland Van a naar beter
Van a naar beter Cm naar dm
Cm naar dm Beter zeist
Beter zeist Hart van aanbidding tekst
Hart van aanbidding tekst Van goed verzorgd naar zelfredzaam
Van goed verzorgd naar zelfredzaam Van papier naar digitaal
Van papier naar digitaal Van km/h naar m/s oefenen
Van km/h naar m/s oefenen Van idee naar product
Van idee naar product Van bios naar uefi
Van bios naar uefi Goedemorgen allemaal, hebben jullie lekker geslapen
Goedemorgen allemaal, hebben jullie lekker geslapen Ander
Ander Mol naar massa
Mol naar massa Indoctrinatie
Indoctrinatie Chocolade met een boodschap
Chocolade met een boodschap Oplosvergelijking natriumfosfaat
Oplosvergelijking natriumfosfaat Oplosvergelijking voorbeeld
Oplosvergelijking voorbeeld Oplosbaarheidstabel
Oplosbaarheidstabel