Opstellen reactievergelijkingen Geef de reactievergelijking van de vorming














- Slides: 16

Opstellen reactievergelijkingen Geef de reactievergelijking van de vorming van keukenzout uit natrium en chloor Stap 1: schrijf de genoemde reactie op met de stoffen op in symbolen Na + Cl 2 Na. Cl 1

Opstellen reactievergelijkingen • Stap 2: controleer of voor en na de pijl hetzelfde aantal atomen Natrium staan (je weet dat elementen niet kunnen verdwijnen of uit het niets gevormd kunnen worden, ze blijven altijd bestaan (dus ook bij een reactie !) Na + 1 losse Na voor reactie Cl 2 Na. Cl 1 Na in de Na. Cl na reactie Het aantal natriumatomen voor en na de reactie is gelijk gebleven dus daar hoeven we nu niets aan te doen ! 2

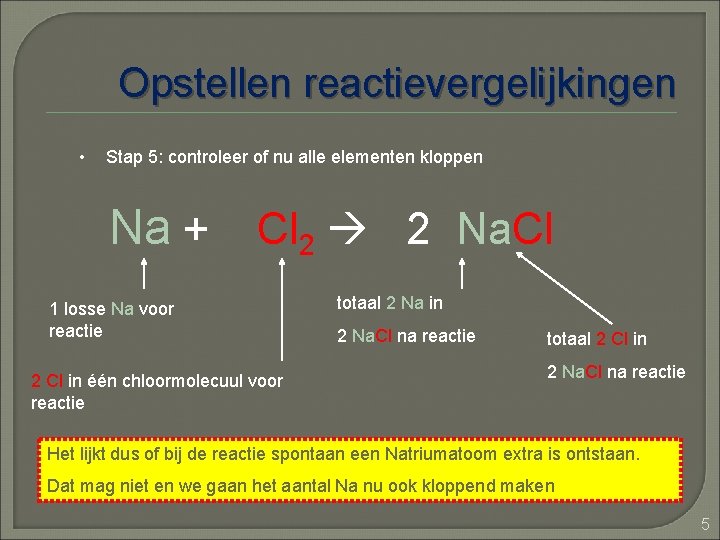
Opstellen reactievergelijkingen • Stap 3: controleer of voor en na de pijl hetzelfde aantal atomen Chloor staat (je weet dat elementen niet kunnen verdwijnen of uit het niets gevormd kunnen worden, ze blijven altijd bestaan (dus ook bij een reactie !) Na + Cl 2 2 Cl in één chloormolecuul voor reactie Na. Cl 1 Cl in de Na. Cl na reactie Het lijkt nu dus of er 1 Cl verdwenen bij de reactie en dat mag niet. We gaan er nu voor zorgen dat de aantallen voor en na de pijl, dus voor en na de reactie, gelijk zijn. 3

Opstellen reactievergelijkingen • Stap 4: in de formule van een stof mag je nooit iets veranderen want dan ‘maak’ je er een andere stof van. Je mag alleen het aantal veranderen door voor de stof een vermenigvuldigingsfactor te zetten: de coëfficiënt Na + Cl 2 2 Na. Cl 2 Cl in één chloormolecuul voor reactie Er moeten ook 2 Cl staan na de reactie vermenigvuldig Na. Cl *2 Er zijn nu 2 Na. Cl na reactie en per Na. Cl is er 1 Cl totaal 2 Cl in 2 Na. Cl na reactie 4

Opstellen reactievergelijkingen • Stap 5: controleer of nu alle elementen kloppen Na + Cl 2 2 Na. Cl 1 losse Na voor reactie 2 Cl in één chloormolecuul voor reactie totaal 2 Na in 2 Na. Cl na reactie totaal 2 Cl in 2 Na. Cl na reactie Het lijkt dus of bij de reactie spontaan een Natriumatoom extra is ontstaan. Dat mag niet en we gaan het aantal Na nu ook kloppend maken 5

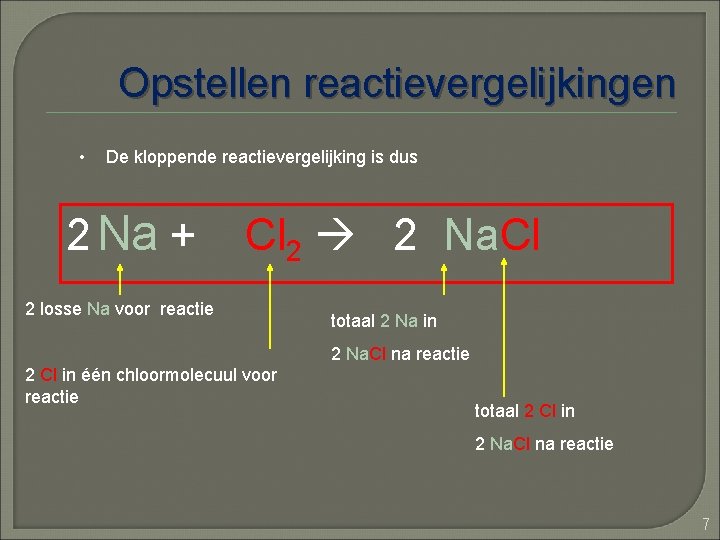
Opstellen reactievergelijkingen Stap 6: als een elementenaantal niet klopt zorg er dan voor dat deze weer kloppend wordt 2 Na + Cl 2 2 Na. Cl 1 losse Na voor reactie totaal 2 Na in *2 2 Na. Cl na reactie 2 losse Na voor reactie totaal 2 Cl in 2 Na. Cl na reactie 2 Cl in één chloormolecuul voor reactie 6

Opstellen reactievergelijkingen • De kloppende reactievergelijking is dus 2 Na + Cl 2 2 Na. Cl 2 losse Na voor reactie totaal 2 Na in 2 Na. Cl na reactie 2 Cl in één chloormolecuul voor reactie totaal 2 Cl in 2 Na. Cl na reactie 7

Opstellen reactievergelijkingen • Maak een kloppende reactie vergelijking bij de reactie van methaan met zuurstof tot kooldioxide en water Stap 1: CH 4 + O 2 → CO 2 + H 2 O Stap 2: aantal C voor: 1 Stap 3: aantal H voor: 4 aantal C na: 1 aantal H na: 2 8

Opstellen reactievergelijkingen CH 4 + 2 O 2 → CO 2 + 2 H 2 O Stap 4: aantal H voor: 4 aantal H na: 2 H 2 O * 2 aantal H na: 4 Stap 5: aantal O voor: 2 aantal O na: 4 nl. 2 O uit CO 2 + 2 O uit 2 H 2 O *2: aantal O: 4 Controle voor: C: 1 H: 4 O: 4 na: C: 1 H: 4 O: 4 9

Opstellen reactievergelijkingen Stap 6: Om ook voor de pijl 4 O te hebben moet je O 2 met een factor 2 vermenigvuldigen. De kloppende reactievergelijking wordt dan CH 4 + 2 O 2 CO 2 + 2 H 2 O 10

Opstellen reactievergelijkingen • Maak een kloppende reactie vergelijking bij de reactie van ijzer met chloor tot ijzerchloride (Fe. Cl 3) Stap 1: Fe + Cl 2 Stap 2+3: Fe + 1, 5 Cl 2 Fe. Cl 3 voor reactie na reactie 1 Fe en 3 Cl 2 Cl Gelijk maken Cl voor en na reactie voor reactie Cl 2 * 1, 5 11

Opstellen reactievergelijkingen Stap 4, 5, 6: Fe + 1, 5 Cl 2 Fe. Cl 3 Halve atomen of moleculen bestaan niet factor 1, 5 wegwerken door hele vergelijking *2 2 Fe + 3 Cl 2 2 Fe. Cl 3 12

Opstellen reactievergelijkingen Geef de kloppende reactievergelijking voor de verbranding van C 4 H 7 S + O 2 4 CO 2 + 3, 5 H 2 O + SO 2 1: C kloppend maken 2 a: H kloppend maken 2 b: Halve moleculen bestaan niet alles *2 2 C 4 H 7 S + 2 O 2 8 CO 2 + 7 H 2 O + 2 SO 2 13

Opstellen reactievergelijkingen 2 C 4 H 7 S + 2 O 2 8 CO 2 + 7 H 2 O + 2 SO 2 3: O kloppend maken 3 a: 4 O voor reactie 3 b: 16 + 7 + 4 = 27 O na reactie 4: nodig voor reactie = 27 O 13, 5 O 2 2 C 4 H 7 S + 13, 5 O 2 8 CO 2 + 7 H 2 O + 2 SO 2 5: Halve moleculen bestaan niet alles *2 4 C 4 H 7 S + 27 O 2 16 CO 2 + 14 H 2 O + 4 SO 2 14

Opstellen reactievergelijkingen Stel de kloppende reactievergelijkingen op van de volgende reacties: A: volledige verbranding van hexaan (=C 6 H 14) 2 C 6 H 14 + 19 O 2 12 CO 2 +14 H 2 O B: volledige verbranding van hepteen (=C 7 H 14) C 7 H 16 + 11 O 2 7 CO 2 + 8 H 2 O C: onvolledige verbranding van hepteen (=C 7 H 14) 2 C 7 H 16 + 15 O 2 14 CO + 16 H 2 O D: volledige verbranding van 1 -butanol (=C 4 H 9 OH) 2 C 4 H 9 OH +12 O 2 8 CO 2 + 10 H 2 O 15

Nog meer oefening Prachtige site waar je invuloefeningen hebt die meteen worden nagekeken!