V A grupas elementi Preiu Valsts imnzija mija
















- Slides: 19

V A grupas elementi Preiļu Valsts ģimnāzija Ķīmija Skolotājs: Francis Livmanis 1 10/27/2020

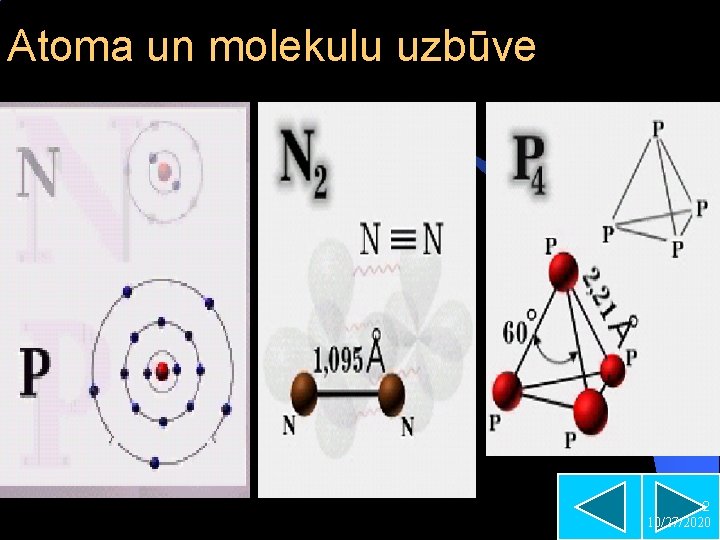
Atoma un molekulu uzbūve 2 10/27/2020

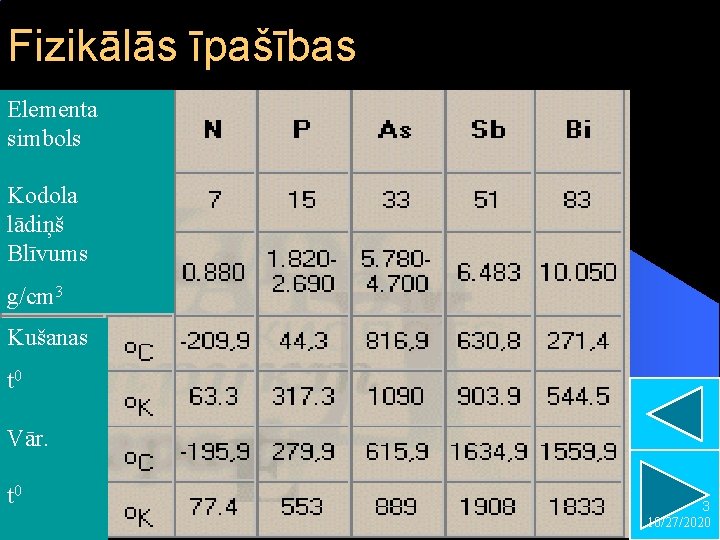
Fizikālās īpašības Elementa simbols Kodola lādiņš Blīvums g/cm 3 Kušanas t 0 Vār. t 0 3 10/27/2020

Oksidēšanās pakāpes 4 10/27/2020

Slāpekļa iegūšana laboratorijā Sadalot slāpekļa savienojumus, karsējot Iegūst tīru 5 10/27/2020

Slāpekļa ķīmiskās īpašības Istabas temperatūrā slāpeklis reaģē tikai ar litiju. Kopumā tas ir inerts savienojums un reakcijās iesaistās tikai augstās temperatūrās, pozitīvas oksidēšanās pakāpes slāpeklim ir tikai savienojumos ar fluoru un skābekli. 6 10/27/2020

Fosfora iegūšana Ca 3(PO 4)2 +5 C +3 Si. O 2 3 Ca. Si. O 3 +5 CO + 2 P 7 10/27/2020

Fosfora ķīmiskās īpašības Ja reakcijā piedalās baltais fosfors, tad raksta P 4, ja sarkanais – tikai P; baltais fosfors ir ļoti indīgs, kā pretindi lieto 2%Cu. SO 4 šķīdumu. 8 10/27/2020

Amonjaks Rūpniecībā amonjaku iegūst: N 2 + 3 H 2 2 NH 3 + Q Laboratorijā amonjaku iegūst no amonija sāļiem un citās reakcijās Hidrazīnu un slāpekļa ūdeņražpaskābi var iegūt 9 10/27/2020

Amonjaka ķīmiskās īpašības Ūdenī amonjaks veido vāju bāzi, tas reaģē ar skābēm Amonija sāļi labi šķīst ūdenī, bet hidrolizējas Vide skāba Karsējot amonija sāļi sadalās 10 10/27/2020

Amonjaka ķīmiskās īpašības 2 Amonjaks iesaistās arī oksidēšanās reducēšanās reakcijās Amonjaks reaģē ar metāliem, veidojot amīdus, imīdus, nitrīdus Nitrīdu reakcijas 11 10/27/2020

Fosfīns un fosfora halogenīdi Tiešā sintēzē No metālu fosfīdiem Īpašības Hidrolizējoties tie veido uzreiz divas skābes PH 3 ar ūdeni nereaģē, bet tikai a ar stiprām skābēm Tas viegli oksidējas Ar ūdeni var veidoties arī fosfora oksohlorīds 12 10/27/2020

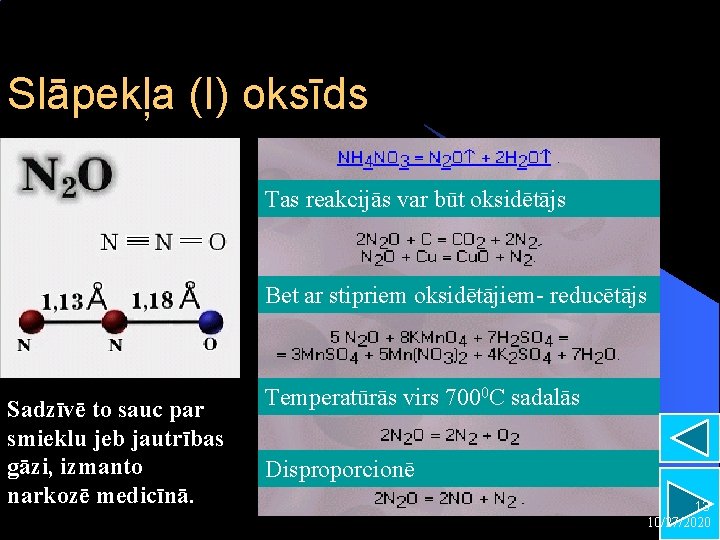
Slāpekļa (I) oksīds Tas reakcijās var būt oksidētājs Bet ar stipriem oksidētājiem- reducētājs Sadzīvē to sauc par smieklu jeb jautrības gāzi, izmanto narkozē medicīnā. Temperatūrās virs 7000 C sadalās Disproporcionē 13 10/27/2020

Slāpekļa (II) oksīds Rūpniecībā iegūst katalītiski oksidējot amonjaku, bet laboratorijā Cu +30% HNO 3 NO viegli oksidējas ar gaisa skābekli Var būt arī oksidētājs Sārmu šķīdumos disproporcionējas 14 10/27/2020

Slāpekļa (III) savienojumi N 2 O 3 ir slāpekļpaskābes anhidrīds HNO 2 ūdenī un sildot sadalās Tā var būt oksidētājs Ar spēcīgiem oksidētājiem uzrāda reducētāja īpašības Tā var disocēt divejādi 15 10/27/2020

Nitrīti ir indīgi savienojumi, tie var uzrādīt gan oksidētāja gan reducētāja īpašības 16 10/27/2020

Slāpekļa (IV) savienojumi 17 10/27/2020

NO 2 ķīmiskās īpašības Šķīdinot ūdenī, veidojas divas skābes, ja sakarst HNO 2 sadalās Skābekļa klātbūtnē veidojas tikai viena skābe Reaģē ar sārmiem Var būt oksidētājs Ozons to oksidē tālāk Šķidrā slāpekļa dioksīdā šķīst tādi metāli kā varš 18 10/27/2020

Slāpekļa ( V ) savienojumi Šķīdinot ūdenī, veido slāpekļskābi 4 HNO 3 4 NO 2 + 2 H 2 O 19 10/27/2020
 Preiu
Preiu Mija kalija
Mija kalija Innovacell biotechnologie
Innovacell biotechnologie Mija van der wege
Mija van der wege Kā sauc ūdenī šķīstošas bāzes
Kā sauc ūdenī šķīstošas bāzes Olbaltumvielu veidošanās no aminoskābēm
Olbaltumvielu veidošanās no aminoskābēm Savrupinājumi 9 klase
Savrupinājumi 9 klase Divdabja galotnes
Divdabja galotnes Protistu valsts
Protistu valsts Iekšējās kontroles birojs
Iekšējās kontroles birojs Nodarbintbas valsts agentura riga
Nodarbintbas valsts agentura riga Valsts jaunatnes programma logo
Valsts jaunatnes programma logo Nodarbintbas valsts agentura vakances
Nodarbintbas valsts agentura vakances Nodarbintbas valsts agentura
Nodarbintbas valsts agentura Valsts kadastra likums
Valsts kadastra likums Elementi strutturali coperture
Elementi strutturali coperture Elementi biznis plana
Elementi biznis plana Halogeni elementi prezentacija
Halogeni elementi prezentacija Comunicazione efficace slide
Comunicazione efficace slide Elementi di logica matematica
Elementi di logica matematica