Disperss sistmas Preiu Valsts imnzija mija Skolotjs Francis













- Slides: 18

Dispersās sistēmas Preiļu Valsts ģimnāzija Ķīmija Skolotājs: Francis Livmanis

Cietas vielas Daliņas cietā ķermenī ir novietotas sakārtotā režģī. Tām ir maza kinētiskā enerģija, tās nedaudz svārstās ap savu līdzsvara stāvokli. Potenciālā enerģija maza, jo tās atrodas tuvu viena otrai. Cietas, kristāliskas vielas var veidoties ar dažāda tipa saitēm.

Šķidrumi Šķidrumos daliņas ir diezgan sakārtotas nelielos attālumos, bet lielākos attālumos kārtības nav. Daliņām ir lielāka potenciālā enerģija nekā cietās vielās, jo daliņu kustība noārda kristālisko režģi. Potenciālā energija arī ir daudz lielāka nekā cietās vielās, jo daliņas atrodas tālāk viena no otras.

Vielu agregātstāvokļi Gāzveida Daļiņas gāzēs kustas haotiski. Tām piemīt augsta kinētiskā enerģija. Tās atrodas tālu viena no otras, tāpēc tām piemīt liela potenciānālā enerģija. Starp gāzu molekulām ir mazi starpmolekulārie pievilkšanās spēki.

Dispersās sistēmas ir ar mainīgu sastāvu un tās veido divi vairāki komponenti. Šķīdinātājs- kvantitatīvi ir parākumā un atrodas tādā pat agregātstāvoklī kā šķīdums.

Sistēmu stabilitāti nosaka izkliedēto daļiņu lielums. -9 10 m Molekulāri, īsti šķīdumi ( elektrolītu un neelektrolītu šķīdumi).

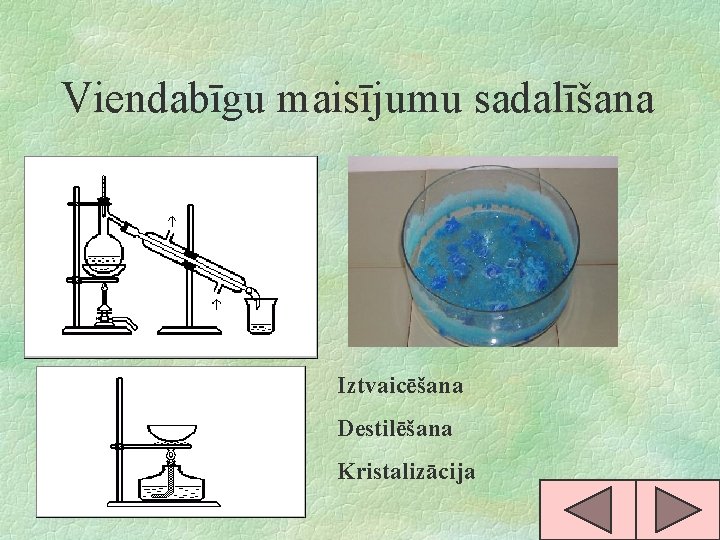
Viendabīgu maisījumu sadalīšana Iztvaicēšana Destilēšana Kristalizācija

Sistēmu stabilitāti nosaka izkliedēto daliņu lielums 10 -7 m Koloīdie šķīdumi Tindāla efekts : daliņas ir pietiekoši lielas, lai atstarotu gaismas vilņus. Viendabīgos maisījumos gaismas stars nav redzams. Līmes, piens ūdenī, upes un ezera ūdens. . .

Sistēmu stabilitāti nosaka izkliedēto daliņu lielums Suspensijas (nešķīstošas vielas šķidrumā) 10 -5 -10 -4 m Daliņas ir lielas uz tām iedarbojas gravitācijas spēks, daliņu sadursmes to nekompensē. Maisījumus var diezgan viegli sadalīt, izmantojot gravitācijas spēku un daliņu lielumu

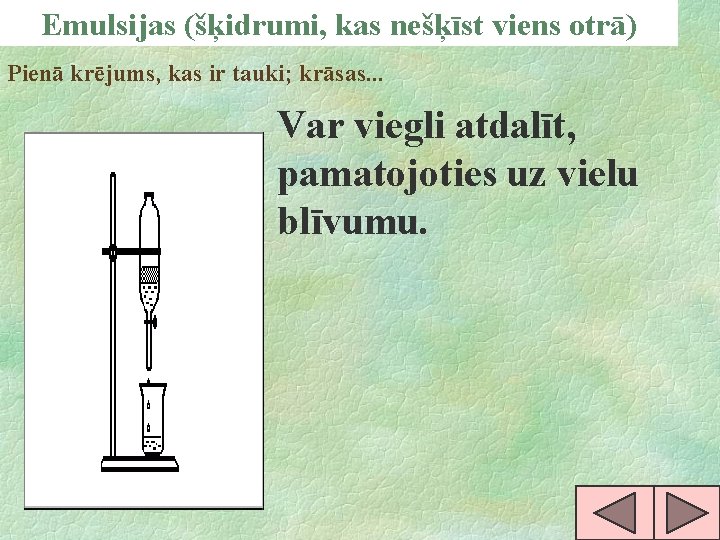
Emulsijas (šķidrumi, kas nešķīst viens otrā) Pienā krējums, kas ir tauki; krāsas. . . Var viegli atdalīt, pamatojoties uz vielu blīvumu.

Kvantitatīvie raksturlielumi Vielas masas daļa šķīdumā ir izšķīdušās vielas masas attiecība pret kopējo šķīduma masu. W=m 1 vielai : m 2 šķīdumam m šķīdumam= m vielai + m šķīdinātājam Taču šķīdumus parasti nesver, bet mēra to tilpumus. Šķīdinot vielu ūdenī, izmainās šķīduma blīvums . (g/ml) Šķīduma masu nosaka blīvuma un šķīduma tilpuma reizinājums: mšķ. = . V

Kvantitatīvie raksturlielumi § Ja izšķīdinātās vielas daudzumu attiecina pret kopējo šķīduma tilpumu, tad tā ir šķīduma koncentrācija. § Molārā koncentrācija ir izšķīdinātās vielas molu skaits vienā litrā (1000 ml) šķīduma. § C=nvielai : V šķīdumam (mol/l) § 1 M H 2 SO 4 tas nozīmē, ka 1000 ml šķīduma satur 1 molu (98 g) sērskābes.

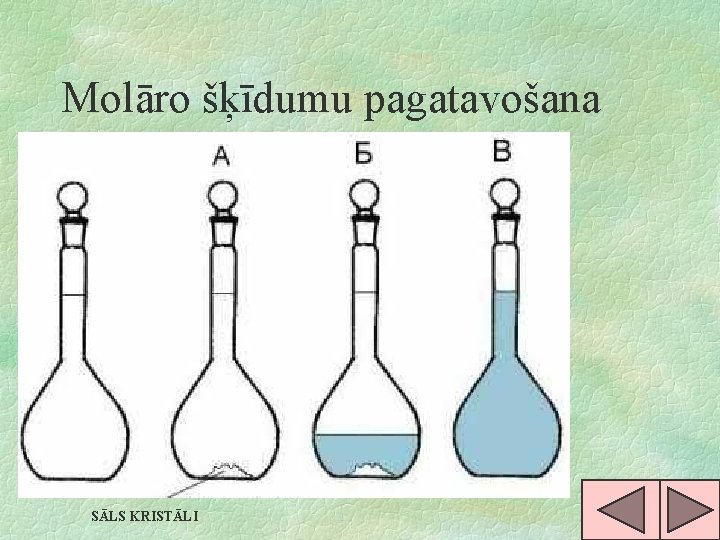
Molāro šķīdumu pagatavošana SĀLS KRISTĀLI

Kvalitatīvie raksturlielumi § Atšķaidīti šķīdumi: šķīdumā ir relatīvi mazs izšķīdinātās vielas saturs. § Koncentrēti škīdumi: šķīdumā ir relatīvi augsts izšķīdinātās vielas saturs. § Bet 98% H 2 SO 4 un 38% HCl ir koncentrētas skābes.

Šķīdība, šķīšana (līdzīgs šķīst līdzīgā) Šķīšana Kristāliska viela Viela šķīdumā Kristalizācija Līdzsvars: piesātināts šķīdums. Piesātināta šķīduma koncentrācija- vielas šķīdības mērs; vielas spēja šķīst dotajā šķīdinātājā. Šķīdības koeficents: pie 180 C 100 g H 2 O izšķīst 35, 9 g Na. Cl K šķ. =35, 9

Faktori, kas ietekmē šķīdību Vielas daba; temperatūra, bet gāzēm arī spiediens. Ja, šķīdinot vielu ūdenī, siltums izdalās, tad paaugstinot temperatūru šīs vielas šķīdība samazinās. Ja, šķīdinot vielu ūdenī, siltums tiek patērēts( šķīdums atdziest), tad paaugstinot temperatūru šīs vielas šķīdība palielinās. Gāzes parasti labāk šķīst aukstā ūdenī. Palielinoties gāzu parciālajam spiedienam gāzu šķīdība paaugstinās. Šķīšana ir fizikāli - ķīmisks process, jo tiek noārdīts vielas kristāliskais režģis, bet vielas daliņas reaģē ar ūdeni.

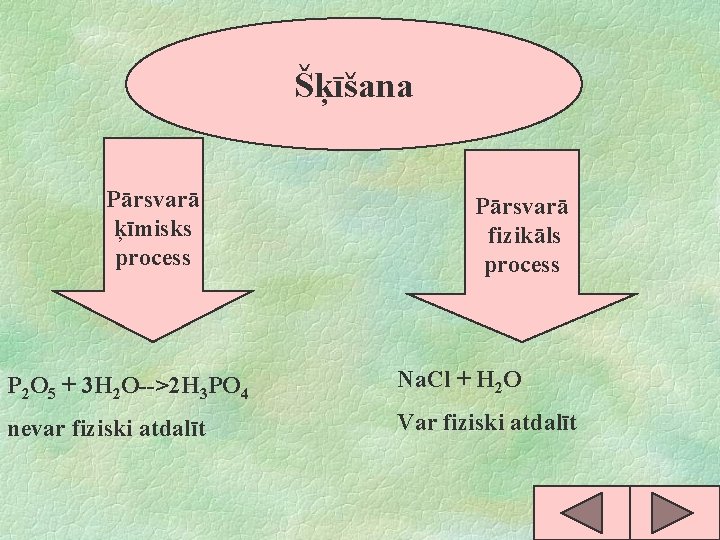
Šķīšana Pārsvarā ķīmisks process Pārsvarā fizikāls process P 2 O 5 + 3 H 2 O-->2 H 3 PO 4 Na. Cl + H 2 O nevar fiziski atdalīt Var fiziski atdalīt

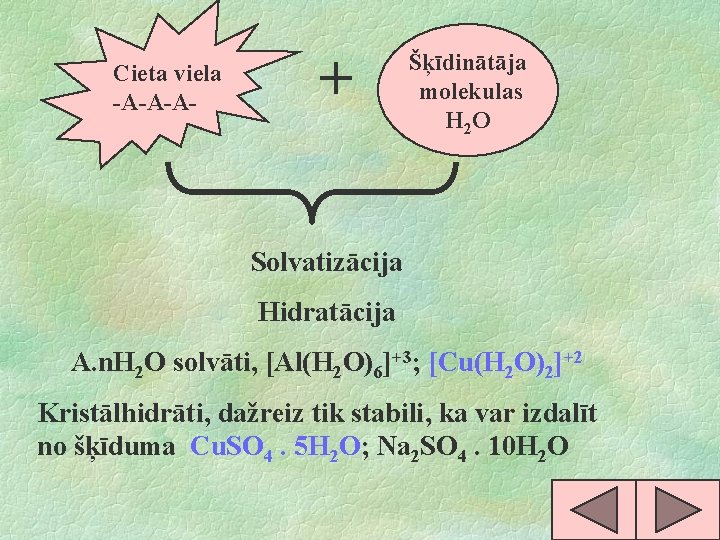
Cieta viela -A-A-A- + Šķīdinātāja molekulas H 2 O Solvatizācija Hidratācija A. n. H 2 O solvāti, [Al(H 2 O)6]+3; [Cu(H 2 O)2]+2 Kristālhidrāti, dažreiz tik stabili, ka var izdalīt no šķīduma Cu. SO 4. 5 H 2 O; Na 2 SO 4. 10 H 2 O
 Preiu
Preiu Innovacell
Innovacell Mija van der wege
Mija van der wege Fe(oh)3 nosaukums
Fe(oh)3 nosaukums Mija kalija
Mija kalija Valsts policijas iekšējās kontroles birojs
Valsts policijas iekšējās kontroles birojs Nodarbintbas valsts agentura riga
Nodarbintbas valsts agentura riga Valsts jaunatnes programma logo
Valsts jaunatnes programma logo Nodarbintbas valsts agentura vakances
Nodarbintbas valsts agentura vakances Nodarbintbas valsts agentura
Nodarbintbas valsts agentura Valsts kadastra likums
Valsts kadastra likums Opsonizācija
Opsonizācija Swamp fox francis marion
Swamp fox francis marion Dmgv0
Dmgv0 Francis bacon plate tectonics
Francis bacon plate tectonics Francis vs spain
Francis vs spain Saint francis
Saint francis Francis scott key fitzgerald biography
Francis scott key fitzgerald biography Charles coughlin criticism of the new deal
Charles coughlin criticism of the new deal