Unidades do Sistema Internacional SI Existem dois tipos




















- Slides: 36

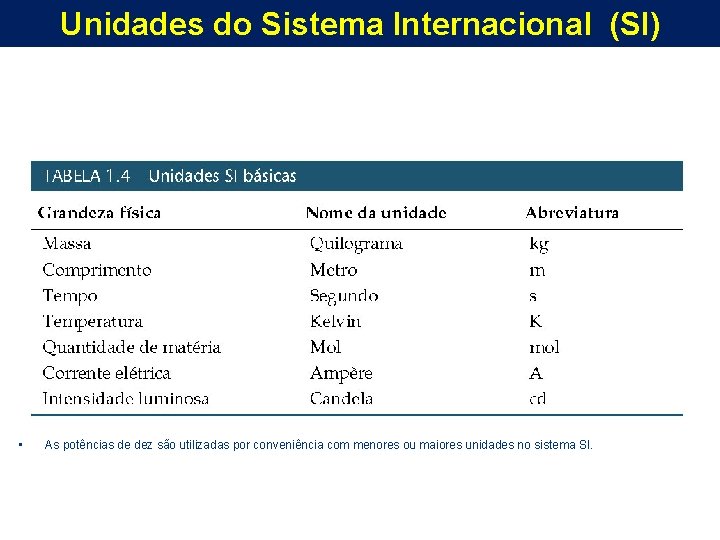
Unidades do Sistema Internacional (SI) • Existem dois tipos de unidades: – Unidades fundamentais (ou básicas); – Unidades derivadas. • Existem 7 unidades básicas no sistema SI.

Unidades do Sistema Internacional (SI) • As potências de dez são utilizadas por conveniência com menores ou maiores unidades no sistema SI.

Unidades do Sistema Internacional

Unidades do Sistema Internacional (SI) • Observe que a unidade SI para comprimento é o metro (m), enquanto a unidade SI para massa é o quilograma (kg). – 1 kg equivale a 2, 2046 lb.

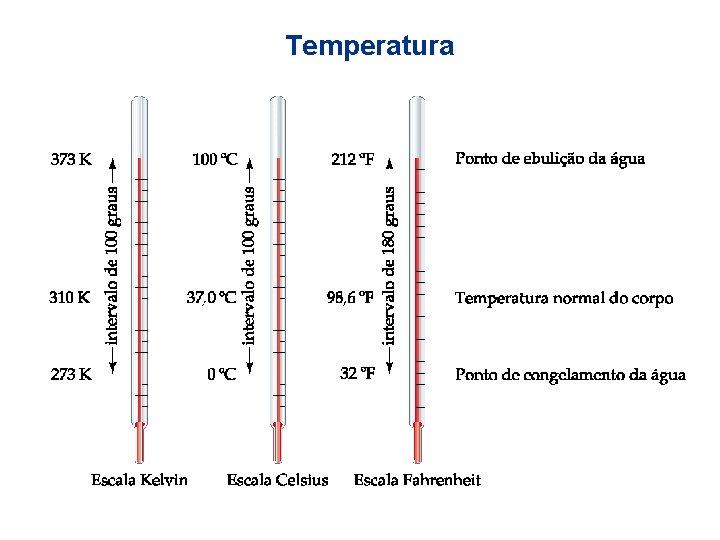
Unidades do Sistema Internacional (SI) • Temperatura Existem três escalas de temperatura: • Escala Kelvin – Usada em ciência. – Mesmo incremento de temperatura como escala Celsius. – A menor temperatura possível (zero absoluto) é o zero Kelvin. – Zero absoluto: 0 K = -273, 15 o. C.

Temperatura • Escala Celsius – Também utilizada em ciência. – A água congela a 0 o. C e entra em ebulição a 100 o. C. Para converter: K = o. C + 273, 15.

Temperatura • Escala Fahrenheit – Geralmente não é utilizada em ciência. – A água congela a 32 o. F e entra em ebulição a 212 o. F. – Para converter:

Temperatura

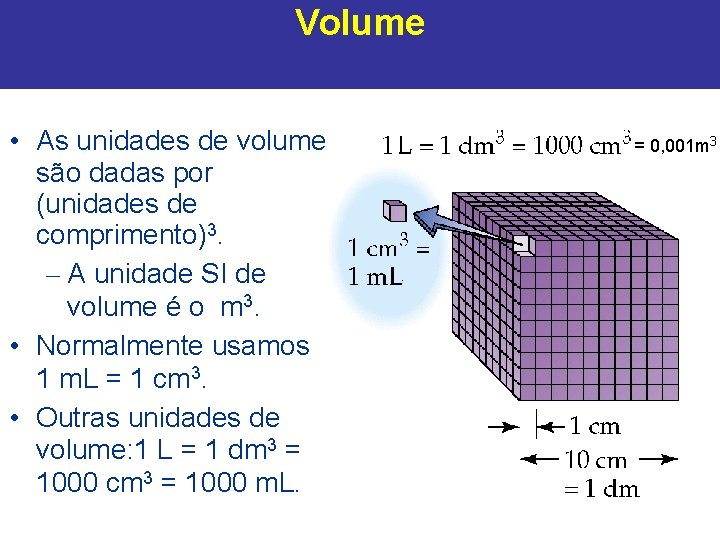
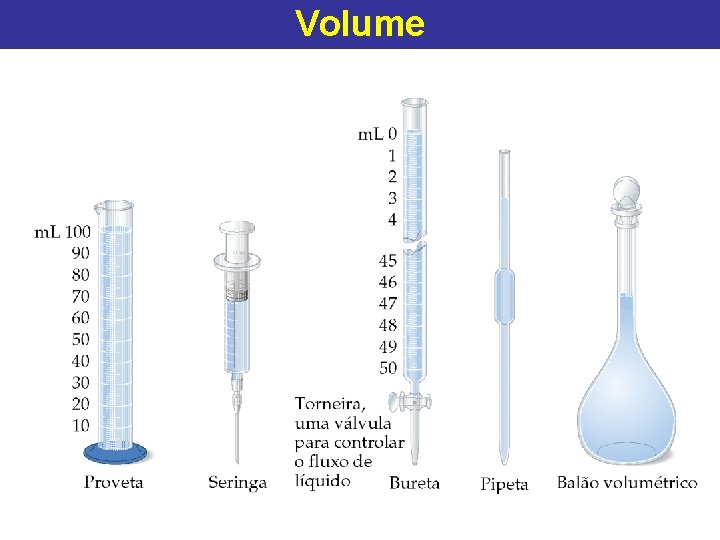
Volume • As unidades de volume são dadas por (unidades de comprimento)3. – A unidade SI de volume é o m 3. • Normalmente usamos 1 m. L = 1 cm 3. • Outras unidades de volume: 1 L = 1 dm 3 = 1000 cm 3 = 1000 m. L. = 0, 001 m 3

Volume

Densidade Usada para caracterizar as substâncias. Definida como massa dividida por volume: Unidades: g/cm 3. Originalmente a densidade foi definida como a massa de 1, 00 m. L de água pura à 25°C. • A densidade é dependente da temperatura. • Densidade versus Peso • •

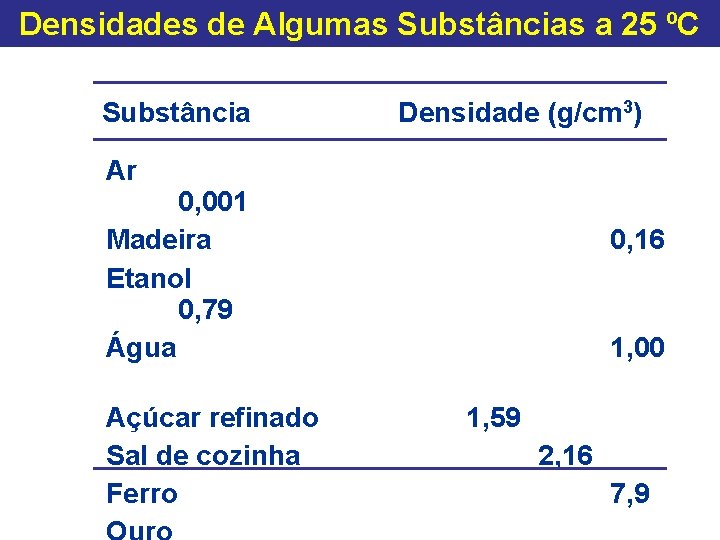
Densidades de Algumas Substâncias a 25 ºC Substância Densidade (g/cm 3) Ar 0, 001 Madeira Etanol 0, 79 Água Açúcar refinado Sal de cozinha Ferro 0, 16 1, 00 1, 59 2, 16 7, 9

Teoria atômica da matéria • John Dalton: 1803 -1807 – Cada elemento é composto de átomos. – Todos os átomos de um elemento são idênticos. – Nas reações químicas, os átomos não são alterados. – Os compostos são formados quando átomos de mais de um elemento se combinam.

Lei das Proporções Múltiplas: Estabelecida por John Dalton em 1803. Quando vários compostos são formados a partir dos mesmos elementos, suas composições relativas guardam proporções múltiplas entre si; A lei das proporções múltiplas pode ser constatada diretamente comparando-se as fórmulas dos compostos; por exemplo, a proporção entre os números de átomos de H e O é de 2: 1 na água e 1: 1 no peróxido de hidrogênio.

A descoberta da estrutura atômica • Os gregos antigos foram os primeiros a postular que a matéria é constituída de elementos indivisíveis. • Mais tarde, os cientistas constataram que o átomo era constituído de entidades carregadas.

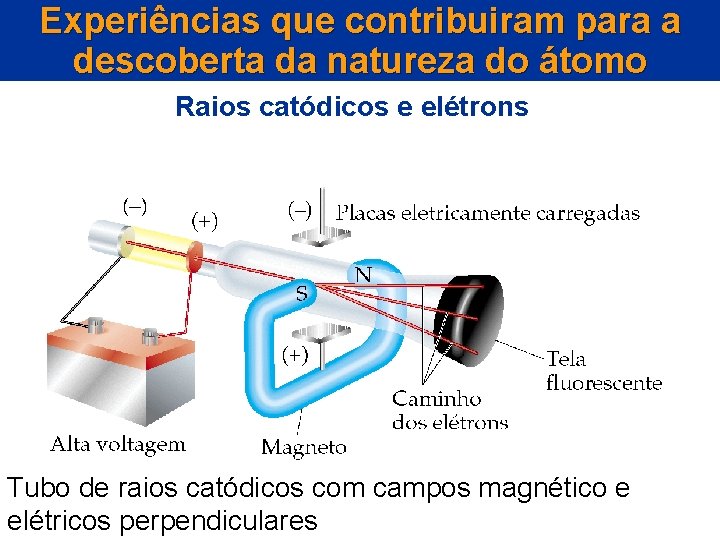
Experiências que contribuiram para a descoberta da natureza do átomo Raios catódicos e elétrons • Um tubo de raios catódicos (CRT) é um recipiente com um eletrodo em cada extremidade. • Uma voltagem alta é aplicada através dos eletrodos, observando-se uma descarga elétrica fluindo como um feixe a partir do catodo.

- Experiências que contribuiram para a descoberta da natureza do átomo catodo TUBO DE RAIOS CATÓDICOS : A RADIAÇÃO EMANAVA DO POLO NEGATIVO OU CATODO, DO TUBO. COMO SE VISUALIZA A TRAJETÓRIA DO FEIXE DE RAIOS CATÓDICOS? + anodo

Tubo de Raios Catódicos Submetido a Baixas Pressões O FEIXE SE PROPAGA EM LINHA RETA. ELE PODE SER DESVIADO? Quando uma alta voltagem é aplicada entre os eletrodos ocorre uma descarga elétrica fluindo como um feixe de elétrons que se desloca. Os gases no interior do tubo emitem luz quando atingidos pelos raios catódicos.

Experiências que contribuiram para a descoberta da natureza do átomo Raios catódicos e elétrons Tubo de raios catódicos com campos magnético e elétricos perpendiculares

Experiências que contribuiram para a descoberta da natureza do átomo Raios catódicos e elétrons • A voltagem faz com que partículas negativas se desloquem do eletrodo negativo para o eletrodo positivo. • Os gases no interior do tubo, quando atingidos pelo feixe, emitem luz e dessa forma, permitem que a trejetória do feixe seja visualizada.

Experiências que contribuiram para a descoberta da natureza do átomo Raios catódicos e elétrons • A trajetória dos elétrons pode ser alterada pela presença de um campo magnético. – Se eles interagirem com um campo magnético perpendicular a um campo elétrico aplicado, os raios catódicos podem sofrer diferentes desvios.

Experiências que contribuiram para a descoberta da natureza do átomo Raios catódicos e elétrons – A magnitude do desvio dos raios catódicos depende dos campos magnético e elétrico aplicados. – Por sua vez, a magnitude do desvio também depende da proporção carga-massa do elétron.

Experiências que contribuiram para a descoberta da natureza do átomo Raios catódicos e elétrons • Em 1897, Thomson determinou que a relação entre a carga e a massa do elétron é 1, 76 108 C/g. • Objetivo: encontrar a carga no elétron para determinar sua massa.

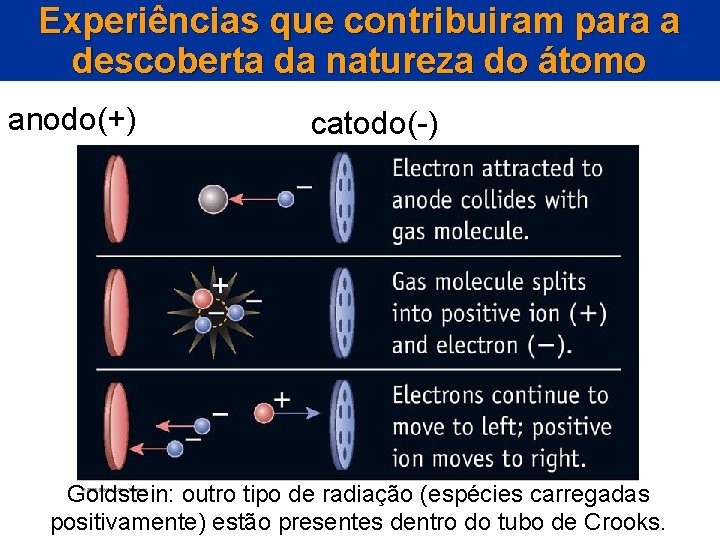
Experiências que contribuiram para a descoberta da natureza do átomo anodo(+) catodo(-) Goldstein: outro tipo de radiação (espécies carregadas positivamente) estão presentes dentro do tubo de Crooks.

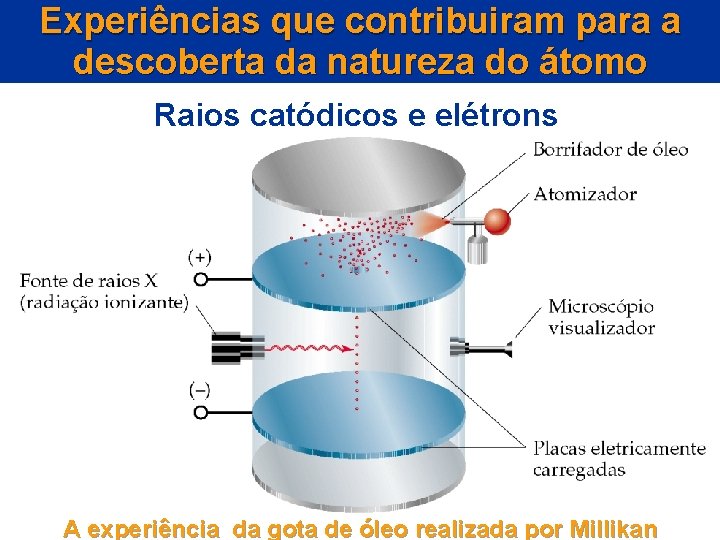
Experiências que contribuiram para a descoberta da natureza do átomo Raios catódicos e elétrons A experiência da gota de óleo realizada por Millikan

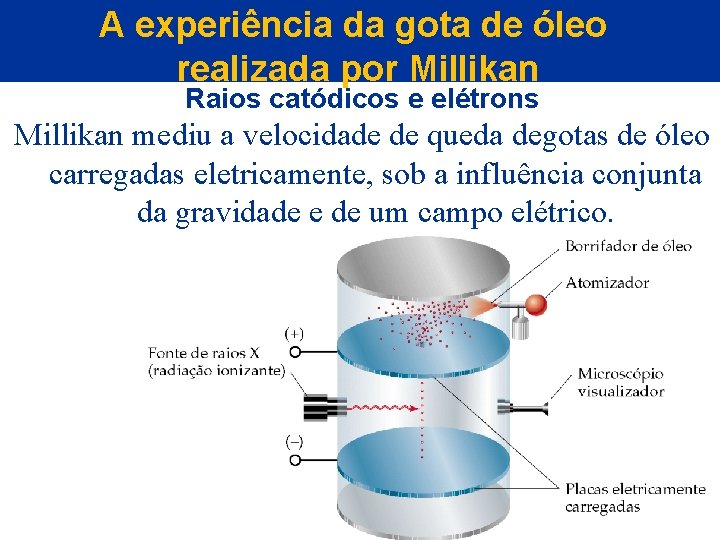
A experiência da gota de óleo realizada por Millikan Raios catódicos e elétrons Millikan mediu a velocidade de queda degotas de óleo carregadas eletricamente, sob a influência conjunta da gravidade e de um campo elétrico.

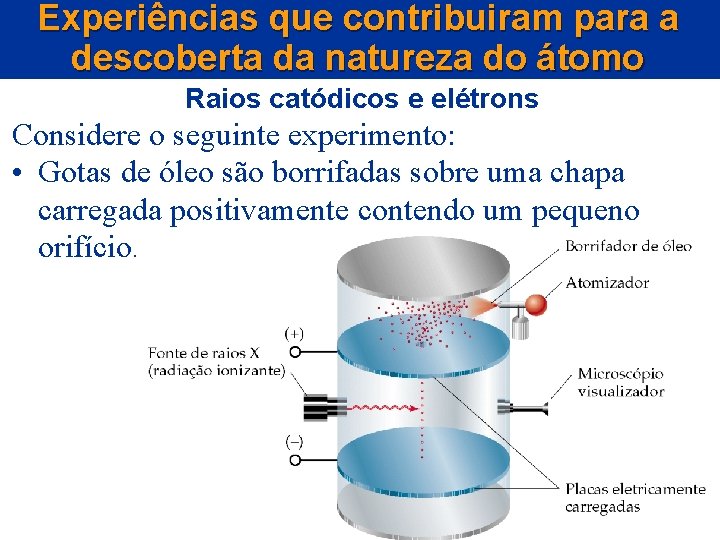
Experiências que contribuiram para a descoberta da natureza do átomo Raios catódicos e elétrons Considere o seguinte experimento: • Gotas de óleo são borrifadas sobre uma chapa carregada positivamente contendo um pequeno orifício.

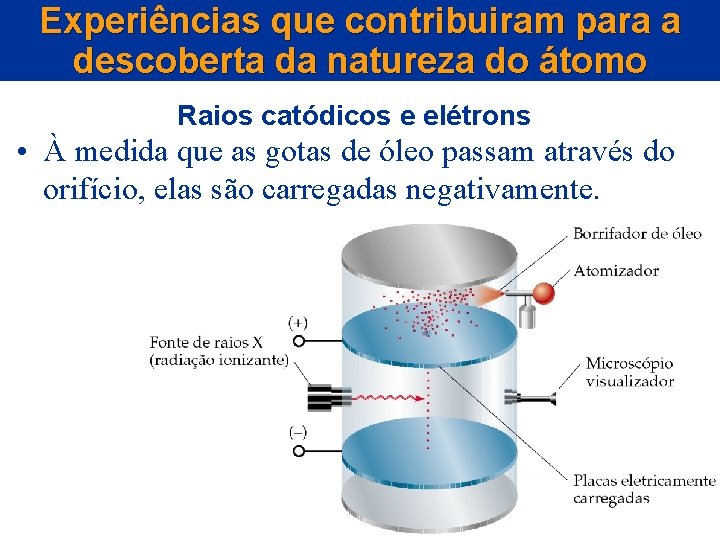
Experiências que contribuiram para a descoberta da natureza do átomo Raios catódicos e elétrons • À medida que as gotas de óleo passam através do orifício, elas são carregadas negativamente.

Experiências que contribuiram para a descoberta da natureza do átomo Raios catódicos e elétrons • A gravidade força as gotas para baixo. O campo elétrico aplicado força as gotas para cima. Quando uma gota está perfeitamente equilibrada, seu peso é igual à força de atração eletrostática entre a gota e a placa positiva.

A descoberta da estrutura atômica Raios catódicos e elétrons • Utilizando este experimento, Millikan determinou que a carga no elétron é 1, 60 x 10 -19 C. • Conhecendo a proporção carga-massa, 1, 76 x 108 C/g, Millikan calculou a massa do elétron: 9, 10 x 10 -28 g. • Com números mais exatos, concluimos que a massa do elétron é 9, 10939 x 10 -28 g.

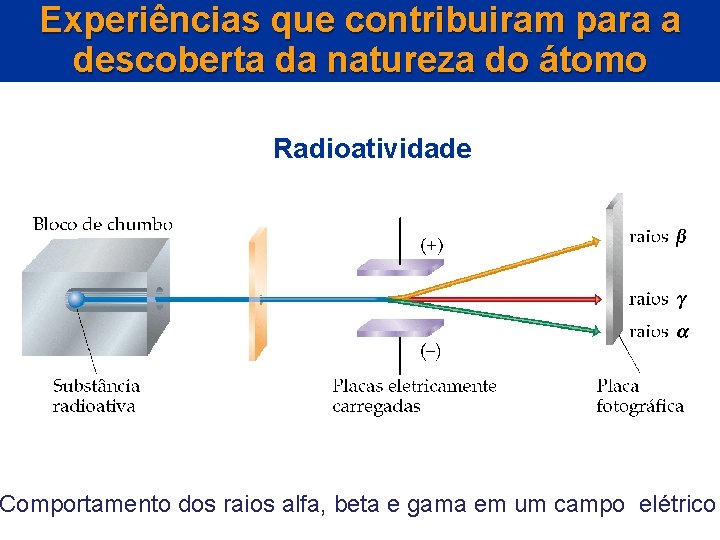
A descoberta da estrutura atômica Radioatividade Considere o seguinte experimento: • Uma substância radioativa é colocada em um anteparo contendo um pequeno orifício de tal forma que um feixe de radiação seja emitido pelo orifício. • A radiação passa entre duas chapas eletricamente carregadas e é detectada.

A descoberta da estrutura atômica Radioatividade • Três pontos são observados no detector: – um ponto no sentido da chapa positiva, – um ponto que não é afetado pelo campo elétrico, – um ponto no sentido da chapa negativa.

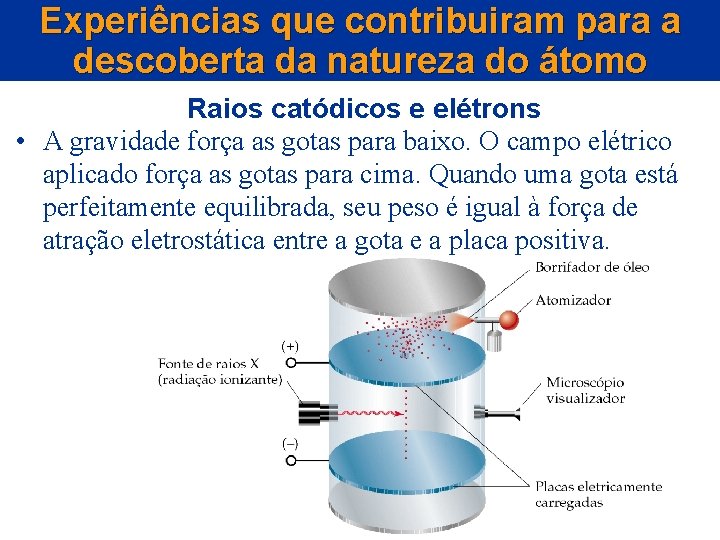
Experiências que contribuiram para a descoberta da natureza do átomo Radioatividade Comportamento dos raios alfa, beta e gama em um campo elétrico

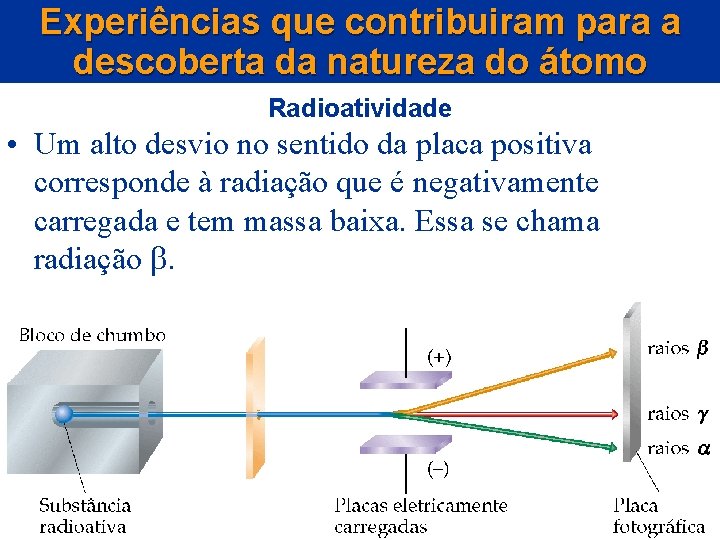
Experiências que contribuiram para a descoberta da natureza do átomo Radioatividade • Um alto desvio no sentido da placa positiva corresponde à radiação que é negativamente carregada e tem massa baixa. Essa se chama radiação .

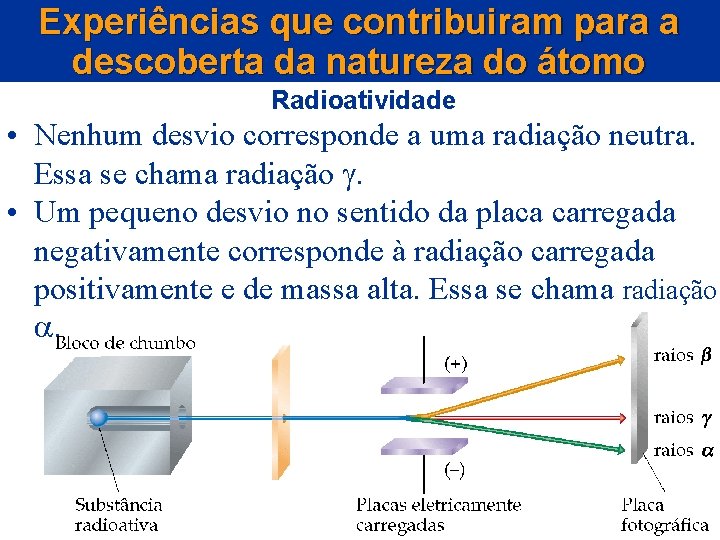
Experiências que contribuiram para a descoberta da natureza do átomo Radioatividade • Nenhum desvio corresponde a uma radiação neutra. Essa se chama radiação • Um pequeno desvio no sentido da placa carregada negativamente corresponde à radiação carregada positivamente e de massa alta. Essa se chama radiação .

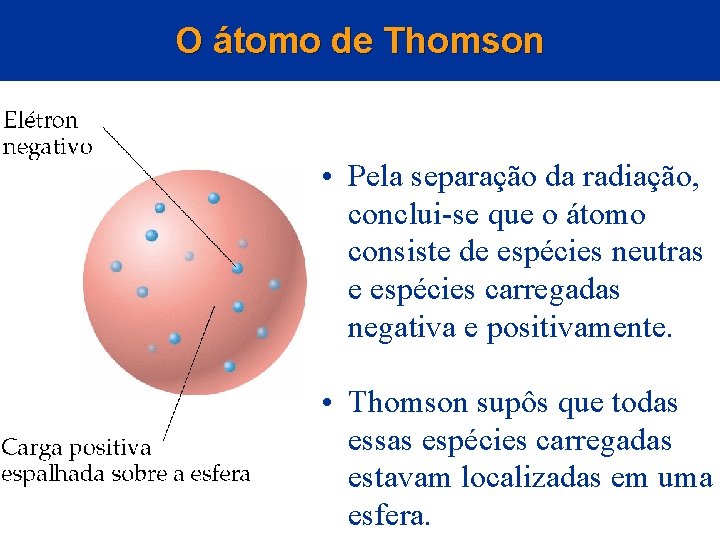
O átomo de Thomson • Pela separação da radiação, conclui-se que o átomo consiste de espécies neutras e espécies carregadas negativa e positivamente. • Thomson supôs que todas essas espécies carregadas estavam localizadas em uma esfera.
 Existem dois tipos de amigos
Existem dois tipos de amigos Objetivos de las unidades de medida
Objetivos de las unidades de medida Site:slidetodoc.com
Site:slidetodoc.com Unidad derivada del sistema internacional
Unidad derivada del sistema internacional Inm
Inm Unidades derivadas
Unidades derivadas Unidades mili micro nano pico
Unidades mili micro nano pico Unidad de mil
Unidad de mil Relido o poema de dois quartetos e dois tercetos
Relido o poema de dois quartetos e dois tercetos Orações subordinada
Orações subordinada Unidades basicas del idioma
Unidades basicas del idioma Mapa conceptual de longitud masa y tiempo
Mapa conceptual de longitud masa y tiempo Sistema de unidades
Sistema de unidades Propiedad termodinamica
Propiedad termodinamica Unidades fundamentales
Unidades fundamentales J martin rochester
J martin rochester Estructura sistema financiero internacional
Estructura sistema financiero internacional Sistema internacional contemporaneo
Sistema internacional contemporaneo Sistema monetario internacional ensayo
Sistema monetario internacional ensayo Esther barbe sistema internacional
Esther barbe sistema internacional Calor especifico del hierro
Calor especifico del hierro Unidades de coulomb
Unidades de coulomb Existem pessoas em nossas vidas que nos deixam felizes
Existem pessoas em nossas vidas que nos deixam felizes Existem coisas na vida
Existem coisas na vida Existem 3 amores na vida
Existem 3 amores na vida Quantas pessoas existem no mundo
Quantas pessoas existem no mundo Morfologia
Morfologia Ef05ma
Ef05ma Quantos continentes existem
Quantos continentes existem Cuál son los tipos de textos expositivos
Cuál son los tipos de textos expositivos Fsica
Fsica Cavidad craneal
Cavidad craneal Tejidos linfoides
Tejidos linfoides Metodo de proyeccion europeo
Metodo de proyeccion europeo Unilever kodaikanal
Unilever kodaikanal Sistemas continuos definicion
Sistemas continuos definicion Sistema semashko o sistema centralizado
Sistema semashko o sistema centralizado