TERMODYNAMIKA PODSUMOWANIE WIADOMOCI Magdalena Staszel informatyka 2 PROGRAM















- Slides: 19


TERMODYNAMIKA – PODSUMOWANIE WIADOMOŚCI Magdalena Staszel informatyka + 2

PROGRAM WYKŁADU 1. Bilans cieplny 2. Przemiany fazowe 3. Model gazu doskonałego 4. Przemiany gazowe 5. I zasada termodynamiki 6. Cykle termodynamiczne 7. II zasada termodynamiki informatyka + 3

BILANS CIEPLNY Zerowa zasada termodynamiki: Jeżeli dwa ciała mają tę samą temperaturę, wówczas nie ma między nimi przepływu ciepła; lub, równoważnie, gdy dwa ciała są w równowadze cieplnej z trzecim, są w równowadze cieplnej ze sobą. Energia wewnętrzna U to całkowita energia układu fizycznego związana z wewnętrznymi ruchami jego mikroskopowych składników i ich wzajemnymi oddziaływaniami. informatyka + 4

BILANS CIEPLNY Zmiana energii wewnętrznej U układu jest równa sumie pracy W wykonanej nad układem (lub przez układ) oraz ciepła Q, czyli ilości energii dostarczonej do układu (lub pobranej z niego) na sposób cieplny, czyli na skutek różnicy temperatur. Jest to treść uogólnionej zasady zachowania energii – pierwszej zasady termodynamiki. Zasadę zachowania energii dla zjawisk, w których zachodzi tylko wymiana ciepła, nazywamy bilansem cieplnym. Czyli w układzie izolowanym cieplnie od otoczenia ilość ciepła pobranego przez ciało o niższej temperaturze jest równa ilości ciepła oddanego przez ciało o wyższej temperaturze: Q (pobrane) = Q (oddane). informatyka + 5

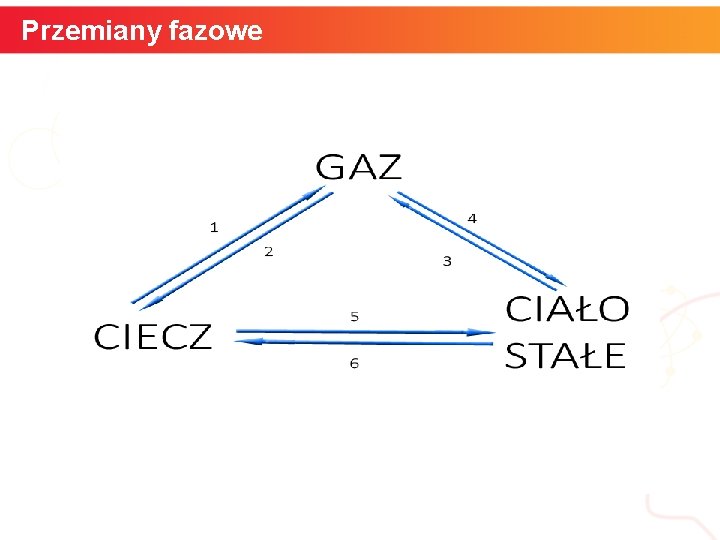
Przemiany fazowe informatyka + 6

Przemiany fazowe Przejścia między fazami: stałą, ciekłą i gazową: Ciecz → gaz: parowanie (1) Gaz → ciecz: skraplanie (2) Ciało stałe → gaz: sublimacja (3) Gaz → ciało stałe: resublimacja (4) Ciecz → ciało stałe: krzepnięcie (5) Ciało stałe → ciecz: topnienie (6) Podczas topnienia, parowania i sublimacji następuje pochłanianie energii, a podczas krzepnięcia, skraplania i resublimacji – wydzielanie energii. informatyka + 7

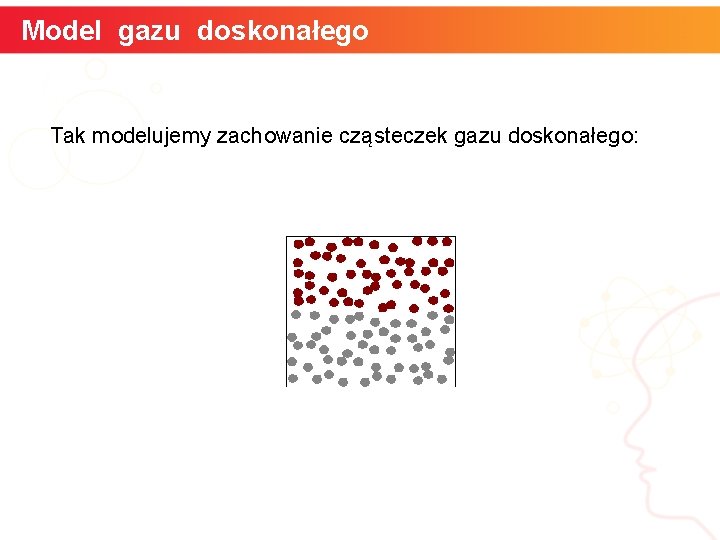
Model gazu doskonałego Założenia, jakie spełnia gaz doskonały: A. Składa się z ogromnej liczby cząsteczek, które zajmują zaniedbywalnie małą objętość B. Siły oddziaływania między cząsteczkami są pomijalnie małe C. Cząsteczki gazu są w ciągłym chaotycznym ruchu i podlegają prawom dynamiki Newtona D. Cząsteczki zderzają się ze sobą i ze ściankami zbiornika wyłącznie sprężyście informatyka + 8

Model gazu doskonałego Tak modelujemy zachowanie cząsteczek gazu doskonałego: informatyka + 9

Model gazu doskonałego Opis matematyczny: Temperatura bezwzględna gazu, T, jest wprost proporcjonalna do średniej energii kinetycznej <Ek> cząsteczek gazu <Ek> = 3/2 k. B T. Stała k. B jest to tzw. stała Boltzmanna; jej wartość wynosi 1, 38 • 10 -23 J/K. Gaz doskonały spełnia równanie stanu gazu doskonałego, znane też jako równanie Clapeyrona. Przedstawia ono zależność między ciśnieniem p gazu, jego objętością V i temperaturą bezwzględną T: p V = n R T, gdzie n jest liczbą moli rozważanego gazu. Wielkość R jest tzw. uniwersalną stałą gazową, R = 8, 314 J/ mol • K. informatyka + 10

Przemiany gazowe Rozważmy 3 szczególne przypadki równania Clapeyrona: 1. T = const; zmiana ciśnienia i objętości gazu doskonałego przy stałej temperaturze - przemiana izotermiczna (prawo Boyle’a- Mariotte’a) 2. p = const; zmiana objętości gazu doskonałego pod wpływem zmiany temperatury przy stałym ciśnieniu – przemiana izobaryczna (prawo Gay. Lussaca) 3. V = const: zmiana ciśnienia gazu doskonałego pod wpływem zmiany temperatury przy stałej objętości – przemiana izochoryczna (prawo Charlesa). informatyka + 11

I zasada termodynamiki jest ogólniejszą postacią zasady zachowania energii, uwzględniającą także zjawiska cieplne. Zmiana energii wewnętrznej U układu jest równa sumie pracy W wykonanej nad układem (lub przez układ) oraz ciepła Q, czyli energii dostarczonej do układu (lub pobranej z niego) na sposób cieplny (tj. na skutek różnicy temperatury): ΔU=W+Q W przypadku układu izolowanego cieplnie od otoczenia zasada ta mówi, że zmiana energii wewnętrznej równa się wykonanej pracy, W = ΔU. Jeśli otoczenie wykonuje pracę nad układem, to W>0; gdy układ wykonuje pracę nad otoczeniem, to W<0. W braku izolacji cieplnej układ wymienia z otoczeniem energię na sposób cieplny. Może ona być dostarczana do układu (Q>0) lub oddawana przez układ (Q<0). informatyka + 12

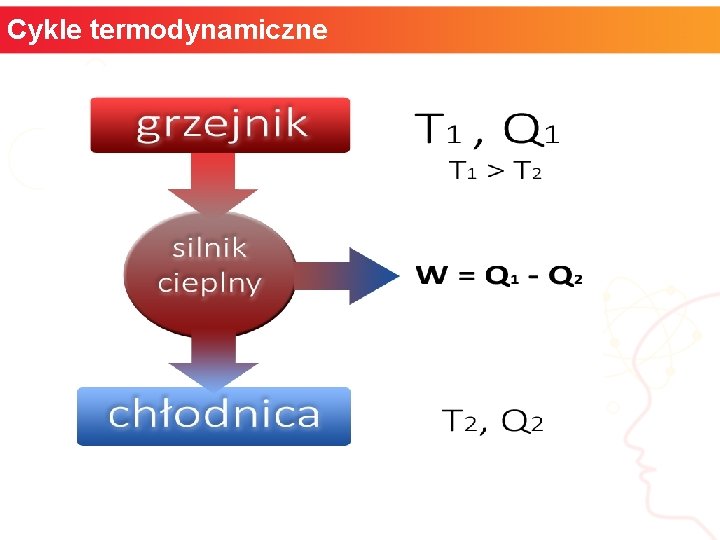
Cykle termodynamiczne Jeśli kilka przemian następuje po sobie, a po ostatniej z nich parametry układu wracają do wartości początkowych, mówimy o cyklu termodynamicznym. Każda krzywa zamknięta w płaszczyźnie (p, V) przedstawia taki cykl. W procesie przechodzenia przez taki cykl układ może np. pobrać ciepło i wykonać pracę nad otoczeniem, wiec działać jak silnik cieplny. Silnik cieplny pobiera ciepło Q 1 ze zbiornika ciepła (grzejnika) o temperaturze T 1. Część tego ciepła zamieniana jest na pracę W, a reszta Q 2 =Q 1 - W jest oddawana do zbiornika ciepła o temperaturze T 2 < T 1 (chłodnicy). Sprawność silnika cieplnego wynosi η = W / Q 1 = 1 – Q 2/ Q 1. Na rysunku przedstawiony jest schematyczny obraz przekazu energii w cyklu silnika cieplnego. informatyka + 13

Cykle termodynamiczne Schemat działania silnika cieplnego informatyka + 14

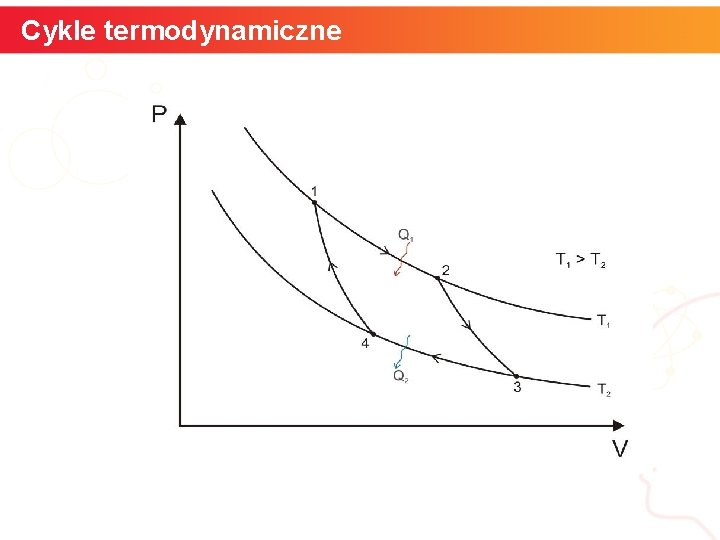
Cykle termodynamiczne Cykl Carnota Jest to najwydajniejszy cykl działania odwracalnego silnika cieplnego. Składa się on z 4 przemian, którym podlegałoby ciało robocze w silniku: a. Rozprężanie izotermiczne w temp. T 1 z pobraniem ciepła Q 1 b. Rozprężanie adiabatyczne ze spadkiem temperatury z T 1 do T 2 c. Sprężanie izotermiczne w temperaturze T 2 z oddaniem ciepła Q 2 d. Sprężanie adiabatyczne ze wzrostem temperatury od T 2 do T 1. Sprawność silnika Carnota wynosi η = 1 – T 2 / T 1 Carnot udowodnił, że jest to najwyższa możliwa sprawność dla cyklu termodynamicznego. informatyka + 15

Cykle termodynamiczne informatyka + 16

II zasada termodynamiki jest zasadą zachowania energii, ale nic nie mówi o kierunku zachodzenia procesów termodynamicznych. Pozwala na zajście wszystkich procesów, w których energia jest zachowana, ale wiemy, że niektóre z nich nie zachodzą. Dopuszcza też pełną równoważność energii w postaci ciepła i pracy, choć z rozważań dotyczących silników wiemy, że tylko część dostarczonego ciepła możemy zamienić na pracę. Potrzebna jest nam więc jeszcze jedna zasada - II zasada termodynamiki. Znamy kilka sformułowań II pochodzących od różnych fizyków: zasady termodynamiki, 1. Nie istnieje proces termodynamiczny, którego jedynym skutkiem byłoby pobranie ciepła ze zbiornika o temperaturze niższej i przekazanie go do zbiornika o temperaturze wyższej (sformułowanie Clausiusa) informatyka + 17

II zasada termodynamiki 2. Nie jest możliwy proces, którego jedynym skutkiem byłoby pobranie pewnej ilości ciepła ze zbiornika i jego zamiana w równoważną ilość pracy (sformułowanie Kelvina). 3. Nie można zbudować perpetuum mobile II rodzaju 4. W samorzutnej ewolucji układu izolowanego entropia zawsze rośnie. informatyka + 18

 Paweł staszel
Paweł staszel Sprawozdanie z pracy psychologa szkolnego 2021
Sprawozdanie z pracy psychologa szkolnego 2021 Prezentacja o czworokątach
Prezentacja o czworokątach Podsumowanie pracy przedszkola za ii półrocze
Podsumowanie pracy przedszkola za ii półrocze Stawonogi i mięczaki podsumowanie
Stawonogi i mięczaki podsumowanie Cykl lekcji latarnik
Cykl lekcji latarnik Podsumowanie lekcji ok
Podsumowanie lekcji ok Zasady pisania rozprawki
Zasady pisania rozprawki Ciepło utajone
Ciepło utajone Gaz idealny
Gaz idealny Termodynamika powtórzenie
Termodynamika powtórzenie Praca w przemianie izotermicznej
Praca w przemianie izotermicznej L
L Mechanizmy reakcji organicznych
Mechanizmy reakcji organicznych Liczba reynoldsa
Liczba reynoldsa Termodynamika
Termodynamika Silnik otta
Silnik otta Termodynamika statystyczna
Termodynamika statystyczna Translacja informatyka
Translacja informatyka Archiwizacja i kompresja danych
Archiwizacja i kompresja danych