Temperatura e Calore Per eventuali approfondimenti o chiarimenti


















- Slides: 21

Temperatura e Calore Per eventuali approfondimenti o chiarimenti contattare Prof. Vincenzo De Leo – vincenzo. deleo@ca. infn. it Temperatura e Calore

Definizione Operativa Di Temperatura n n n È possibile associare allo stato termico di un corpo un numero chiamato tempe-ratura Questo indice numerico può essere definito descrivendo gli strumenti che lo misurano È possibile realizzare tali strumenti sfruttando le proprietà dei corpi che dipendono dalla temperatura Temperatura e Calore 2

Definizione Operativa Di Temperatura e Calore GAS SBARRA n Il volume di un liquido, la pressione di un gas a volume costante e la lunghezza di una sbarra sono tutte proprietà dei corpi che dipendono dalla temperatura Gli strumenti che le utilizzano sono detti termometri LIQUIDO n 3

Definizione Operativa Di Temperatura n Il principio che permette la misura è che due corpi a diverso stato termico (e quindi a diversa temperatura) messi a contatto raggiungono in un certo intervallo di tempo uno stato di equilibrio detto equilibrio termico (Principio Zero Della Termodinamica) Termodinamica 30 o. C 34 35 o. C 30 31 32 33 35 o. C 40 39 38 37 36 Temperatura e Calore 4

Scale Termometriche n Termometro a liquido: q n Il volume del liquido e quindi la lunghezza della colonna liquida nel capillare varia con la temperatura dello strumento in modo direttamente proporzionale (in prima approssimazione) La taratura dello strumento viene fatta stabilendo due temperature fisse di riferimento Temperatura e Calore 5

Scale Termometriche Nella scala Celsius (o cen-tigrada) si assegna il valore di 0 o. C alla prima e di 100 o. C alla seconda Temperatura e Calore 100 o. C Mercurio n Per consuetudine si considerano le tem-perature del ghiaccio fondente e dei vapori di acqua bollente alla pressione di 1 atm Mercurio n 0 o. C 6

Scale Termometriche n Scale Réamur e Fahrenheit: n 180 parti 212 o. F 80 parti 80 o. R 100 parti Mercurio 100 o. C 0 o. R 32 o. F Relazione tra le diverse scale: Temperatura e Calore 7

Richiami Sulle Leggi Dei Gas: Legge Di Boyle, Leggi Di Gay-Lussac, Equazione Di Stato n n n A differenza dei liquidi i gas sono facilmente comprimibili Fissata la temperatura, il loro volume dipende dalla pressione agente La relazione tra volume e pressione è espressa dalla legge di Boyle: P (atm) Isoterma Temperatura e Calore V (cm 3) 8

Richiami Sulle Leggi Dei Gas: Legge Di Boyle, Leggi Di Gay-Lussac, Equazione Di Stato Nel 1661 Robert Boyle pubblicò il suo famoso libro The sceptical chymist (Il chimico scettico) che è stato, forse, il primo libro di chimica. Boyle dimostrò che non c'erano prove sperimentali a sostegno delle idee di Aristotele sperimentali a sostegno delle ideeche di considerava Aristotele che considerava ogni materia formata dadaterra, aria, fuoco e ogni materia fuoco e acqua (le quattro acqua (leallora quattro sostanze allora Per ritenute sostanze ritenute elementari). Boyle la materia era elementari). formata da particelle e tutte le sostanze erano costituite da atomi diversi. Il suo modello della materia era sorprendentemente simile a quello oggi accettato dalla comunità scientifica. Bisognò attendere quasi cinquant’anni perché quelle idee rivoluzionarie potessero avere diritto di cittadinanza. Boyle contribuì in maniera decisiva allo sviluppo della scienza. Temperatura e Calore 9

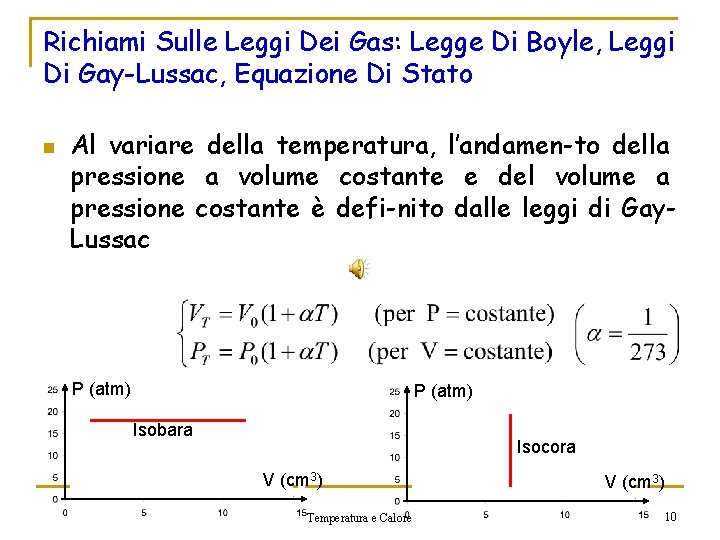
Richiami Sulle Leggi Dei Gas: Legge Di Boyle, Leggi Di Gay-Lussac, Equazione Di Stato n Al variare della temperatura, l’andamen-to della pressione a volume costante e del volume a pressione costante è defi-nito dalle leggi di Gay. Lussac P (atm) Isobara Isocora V (cm 3) Temperatura e Calore V (cm 3) 10

Richiami Sulle Leggi Dei Gas: Legge Di Boyle, Leggi Di Gay-Lussac, Equazione Di Stato n n Un gas che soddisfa sia la legge di Boyle che le leggi di Gay-Lussac si dice gas perfetto P 0, V 0, 0 o. C P, V, T P (atm) Isobara P 0, V ’, T P 0, V 0, 0 o. C Equazione di Stato dei Gas Perfetti Iso term a P, V, T Temperatura e Calore V (cm 3) 11

Temperatura Assoluta n Dalla legge di Gay-Lussac: P (atm) 1, 366 1 T (o. C) - 273, 2 n 0 100 -273, 2 o. C = Zero Assoluto Temperatura e Calore 12

Temperatura Assoluta n Mantenendo immutato l’intervallo di 1 grado e spostando lo zero centigrado a 273, 2 o. C si ottiene una nuova scala detta scala assoluta o scala Kelvin, Kelvin la cui relazione con la scala centigrada è data da: Temperatura e Calore 13

Temperatura Assoluta n n Per definizione, un Kelvin è 1/273, 16 della temperatura del punto triplo dell’acqua Utilizzando la scala Kelvin le equazioni di Gay-Lussac diventano più semplici: Temperatura e Calore 14

Temperatura Assoluta n n Anche l’equazione di stato dei gas per-fetti assume una nuova forma utilizzan-do la scala di temperature assolute: La parte costante dell’equazione viene indicata con R e si ha: Dunque per una mole di gas si ha: Per n moli: Equazione di Stato dei Gas Perfetti nella scala di temperature assolute Temperatura e Calore 15

Legge Fondamentale Della Calorimetria n n n Abbiamo visto che, per il principio zero della termodinamica, due corpi a tempe-rature Ta > Tb assumono nel tempo una temperatura T intermedia tra le due Fra i due corpi è stata dunque scambiata una certa quantità di calore Essa è misurabile tramite un calorimetro Temperatura e Calore 16

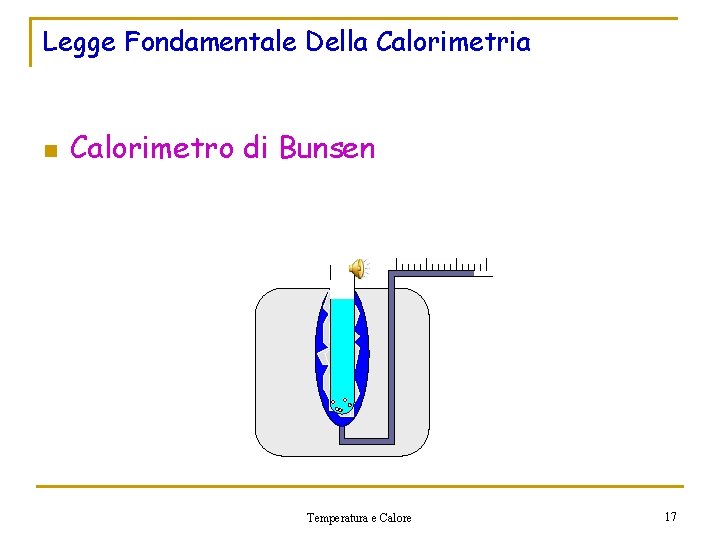
Legge Fondamentale Della Calorimetria n Calorimetro di Bunsen Temperatura e Calore 17

Legge Fondamentale Della Calorimetria n Sperimentalmente si osserva che: q q q La quantità di calore ceduta da un corpo aumenta all’aumentare della sua temperatura Due corpi della stessa sostanza mantenuti alla stessa temperatura cedono due diverse quantità di calore se hanno massa diversa; in particolare ne cede di più quello di massa maggiore A parità di condizioni, la quantità di calore ceduta da un corpo dipende dalla natura del corpo Legge fondamentale della Calorimetria Temperatura e Calore 18

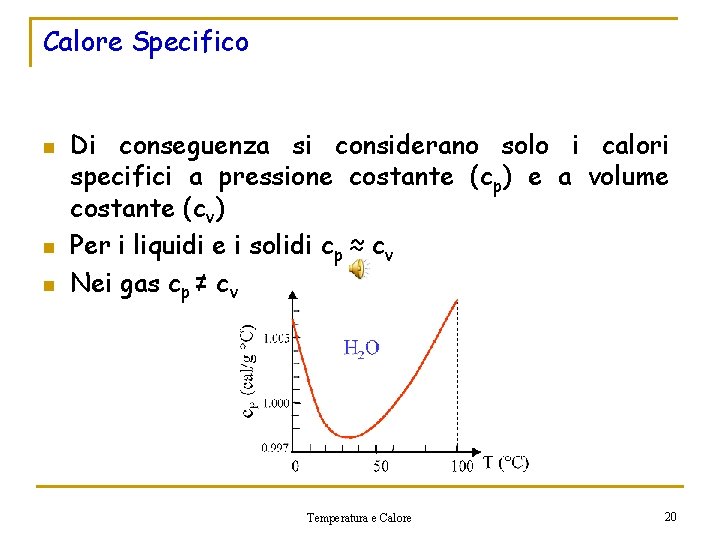
Calore Specifico n Dalla legge fondamentale della calorimetria si ricava che: Calore Specifico n Non ha senso parlare di calore specifico di un corpo se non sono precisate le condizioni sotto cui lo riscaldiamo o raffreddiamo Temperatura e Calore 19

Calore Specifico n n n Di conseguenza si considerano solo i calori specifici a pressione costante (cp) e a volume costante (cv) Per i liquidi e i solidi cp ≈ cv Nei gas cp ≠ cv Temperatura e Calore 20

Unità Di Misura Della Quantità Di Calore n n Siccome il calore è una forma di energia la sua unità di misura può essere la stessa dell’energia meccanica, cioè Joule o erg In origine era la caloria (cal), definita come la quantità di calore che si deve fornire alla massa di 1 g di acqua per elevare la sua temperatura da 14. 5 o. C a 15. 5 o. C Temperatura e Calore 21
 Ciclo di carnot
Ciclo di carnot Capacità termica e calore specifico zanichelli
Capacità termica e calore specifico zanichelli Calore e temperatura zanichelli
Calore e temperatura zanichelli Equazione di boltzmann
Equazione di boltzmann Propagazione per conduzione
Propagazione per conduzione Dilatazione termica mappa concettuale
Dilatazione termica mappa concettuale Vampate di calore cause
Vampate di calore cause Equivalente termico del lavoro
Equivalente termico del lavoro Calorimetria esercizi
Calorimetria esercizi Analisi dimensionale joule
Analisi dimensionale joule Teorema di clausius
Teorema di clausius Resistenza convettiva
Resistenza convettiva Contabilizzazione calore varese
Contabilizzazione calore varese Cavia zeug
Cavia zeug Calore latente formule inverse
Calore latente formule inverse Spotting ovulazione
Spotting ovulazione Strategia di controllo di fumo e calore
Strategia di controllo di fumo e calore Condensazione passaggio di stato
Condensazione passaggio di stato Differenza tra capacità termica e calore specifico
Differenza tra capacità termica e calore specifico Mappe concettuali energia
Mappe concettuali energia Esempio calcolo cop pompa di calore
Esempio calcolo cop pompa di calore Attacchi di panico sintomi
Attacchi di panico sintomi