SS 2002 Experimentalvortrag Wasserstoffperoxid 19 06 02 Gliederung























- Slides: 36

SS 2002 Experimentalvortrag Wasserstoffperoxid 19. 06. 02

Gliederung 1. Allgemeine Eigenschaften 2. Vorkommen 3. Physiologische Wirkung 4. Historie 5. Darstellung 6. Verwendung

1. Allgemeine Eigenschaften • Summenformel H 2 O 2 • farb- und geruchlose Flüssigkeit • im wasserfreiem Zustand: sirupartig • mit Wasser in allen Mengenverhältnissen mischbar • 30%iges H 2 O 2 kommt als „Perhydrol“ in den Handel • sehr schwache Säure H 2 O 2 (aq) + H 2 O HO 2 - (aq) + H 3 O+ (aq)

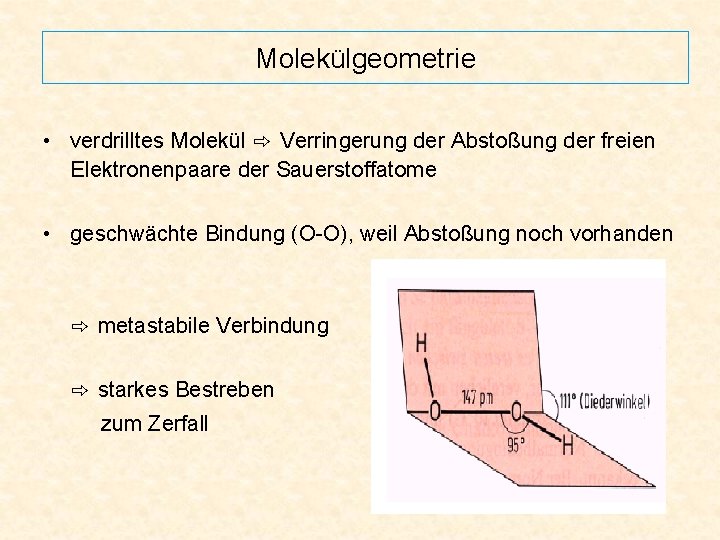
Molekülgeometrie • verdrilltes Molekül ⇨ Verringerung der Abstoßung der freien Elektronenpaare der Sauerstoffatome • geschwächte Bindung (O-O), weil Abstoßung noch vorhanden ⇨ metastabile Verbindung ⇨ starkes Bestreben zum Zerfall

Allgemeine Eigenschaften • hohes Zerfallsbestreben unter großer Wärmeentwicklung: -1 -2 0 2 H 2 O 2 (aq) → 2 H 2 O + O 2 (g) ↑ ∆H° = - 98 k. J/mol • Zerfall wird initiiert durch Bildung von OH-Radikalen: HOOH → 2 HO∙ ∆H° = 211 k. J/mol HO∙ + H 2 O 2 → H 2 O + HO 2∙ + H 2 O 2 → H 2 O + O 2 + HO∙ • jedoch sehr langsam bei Zimmertemperatur

Allgemeine Eigenschaften • Erhöhung der Zersetzungsgeschwindigkeit durch Katalysatoren (z. B. Schwermetalle, Alkalien oder andere Verunreinigungen) ⇨ Versuch 1 • Deshalb: Zugabe geringer Mengen (ca. 100 - 1000 ppm) an Stabilisatoren z. B. Chelatbildner, Stannate oder Phosphate, die Metallionen komplexieren

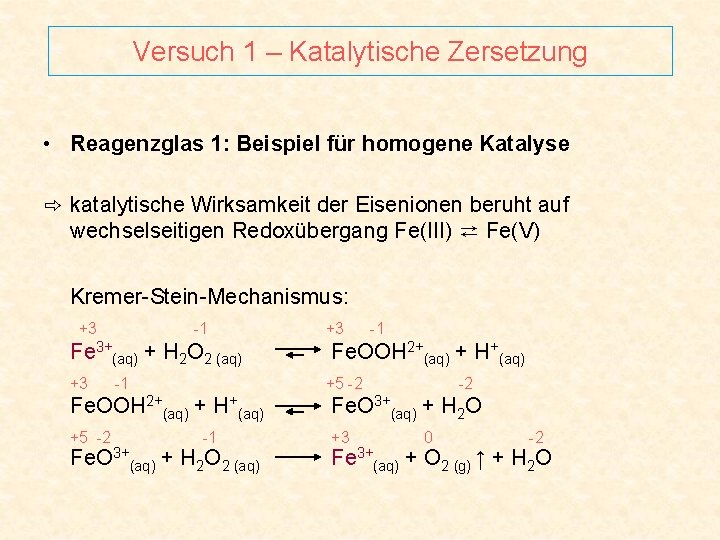
Versuch 1 – Katalytische Zersetzung • Reagenzglas 1: Beispiel für homogene Katalyse ⇨ katalytische Wirksamkeit der Eisenionen beruht auf wechselseitigen Redoxübergang Fe(III) ⇄ Fe(V) Kremer-Stein-Mechanismus: +3 -1 Fe 3+(aq) + H 2 O 2 (aq) +3 -1 Fe. OOH 2+(aq) + H+(aq) +5 -2 -2 Fe. OOH 2+(aq) + H+(aq) Fe. O 3+(aq) + H 2 O +5 -2 +3 -1 Fe. O 3+(aq) + H 2 O 2 (aq) 0 -2 Fe 3+(aq) + O 2 (g) ↑ + H 2 O

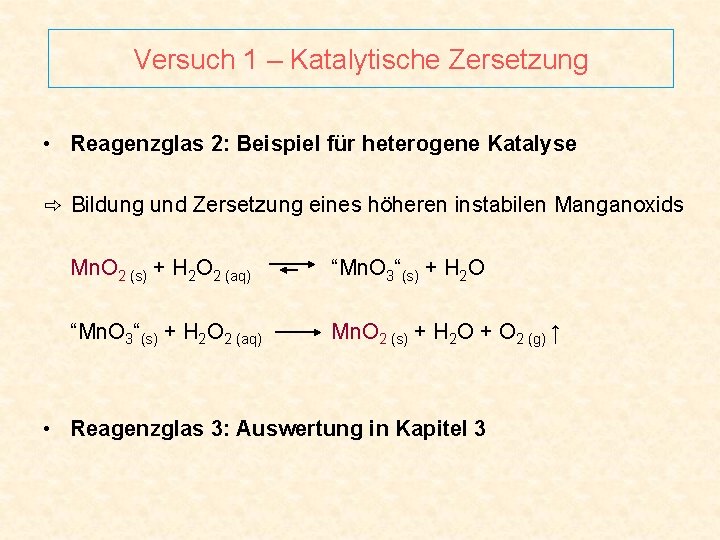
Versuch 1 – Katalytische Zersetzung • Reagenzglas 2: Beispiel für heterogene Katalyse ⇨ Bildung und Zersetzung eines höheren instabilen Manganoxids Mn. O 2 (s) + H 2 O 2 (aq) “Mn. O 3“(s) + H 2 O 2 (aq) Mn. O 2 (s) + H 2 O + O 2 (g) ↑ • Reagenzglas 3: Auswertung in Kapitel 3

2. Vorkommen In sehr niedrigen Konzentrationen natürlich vorkommende Substanz: • im Wasser (1 – 30 μg/L) • in der Atmosphäre (0, 1 – 1 ppm) • in allen aerob lebenden Zellen (z. B. menschliche Atemluft 300 - 1000 μg/m 3) • Kuriosität: Bombardierkäfer (Brachinus crepitans / Brachinus explodens)

Bombardierkäfer • Käfer produziert mit seinen Drüsen Hydrochinon und Wasserstoffperoxid (bis zu einer Konzentration von 28, 5 %) • Substanzen dienen als Abwehrstoffe gegen Freßfeinde

3. Physiologische Wirkung Wie kommt H 2 O 2 in den Organismus? • Endreaktion der Atmungskette ⇨ aus Sauerstoff kann das toxische Superoxid-Ion O 2 - gebildet werden: 2 O 2 -(aq) + 2 H+(aq) Superoxid. Dismutase H 2 O 2 (aq) + O 2 (g) Folgen? • in höheren Konzentrationen: Zellgift Deshalb: Schutzmechanismen, in Form von H 2 O 2 -zersetzenden Enzymen (Katalase / H 2 O 2 -Oxidoreduktase) ⇨ Versuch 2

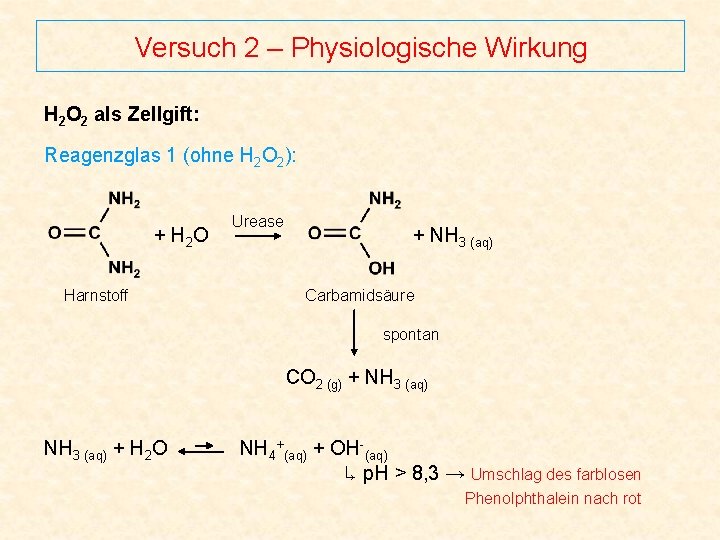
Versuch 2 – Physiologische Wirkung H 2 O 2 als Zellgift: Reagenzglas 1 (ohne H 2 O 2): + H 2 O Harnstoff Urease + NH 3 (aq) Carbamidsäure spontan CO 2 (g) + NH 3 (aq) + H 2 O NH 4+(aq) + OH-(aq) ↳ p. H > 8, 3 → Umschlag des farblosen Phenolphthalein nach rot

Versuch 2 – Physiologische Wirkung Reagenzglas 2 (mit H 2 O 2): Urease wird durch H 2 O 2 irreversibel geschädigt, deshalb kein Umschlag des farblosen Phenolphthaleins + H 2 O

Physiologische Wirkung Schutzmechanismen: Reagenzglas 3 (von Versuch 1): Katalysator im Blut ist das Enzym Katalase, welches in der Lage ist H 2 O 2 sehr schnell zu zersetzen Katalase: ∙ eines der effektivsten Enzyme (ein Katalasemolekül zerlegt in einer Sekunde 3· 1011 H 2 O 2 -Moleküle) ∙ enthält 4 Hämgruppen mit Fe(III) ∙ Hauptaufgabe ist Zerstörung des Zellgifts H 2 O 2

4. Historie • 1818 erstmalige Darstellung durch Thenard mit Bariumperoxid als Ausgangssubstanz ⇨Versuch 3

Versuch 3 a – Darstellung Reaktion ist mit einem Fällungsvorgang und einer Säure-Base-Reaktion nach Brønsted verknüpft: Ba. O 2 (s) + H 2 SO 4 (aq) Ba. SO 4 (s) ↓ + H 2 O 2 (aq) O 22 -(aq) + 2 H 3 O+(aq) H 2 O 2 (aq) + 2 H 2 O weiß Abstumpfen des Reaktionsmilieus: Ba. CO 3 (s) + 2 H 3 O+(aq) + SO 42 -(aq) Ba. SO 4 (s) ↓ + CO 2 (g) ↑ + 3 H 2 O weiß

Versuch 3 b – Nachweis mit Titanoxidsulfat Reaktion ist mit einer Ligandenaustauschreaktion verknüpft: formal: -2 -1 [Ti. O]SO 4 (aq) + H 2 O 2 (aq) H 3 O + -1 -1 -2 [Ti. O-O]SO 4 (aq) + H 2 O gelb genauer: -2 -1 [Ti(OH)2(H 2 O)4]2+(aq) + H 2 O 2 (aq) -1 -2 [Ti(O 2) · aq]2+(aq) + 6 H 2 O gelb

Historie • 1818 erstmalige Darstellung durch Thenard mit Bariumperoxid als Ausgangssubstanz • bleichende und desinfizierende Wirkung wurde erkannt • 1873 erste Anlage zur fabrikmäßigen Herstellung von 3%igen H 2 O 2 aus Ba. O 2 bei Schering in Berlin • 1896 technische Produktion von 3 -8%igen H 2 O 2 bei Merck in Darmstadt • 1905 industrieller Durchbruch mit einem Deutschen Reichspatent zur Herstellung auf elektrolytischem Weg über die Peroxodischwefelsäure (ca. 28%ige Lösungen) • 1953 erste großtechnische Anthrachinon-Autoxidations-Anlage in Memphis/Tennessee

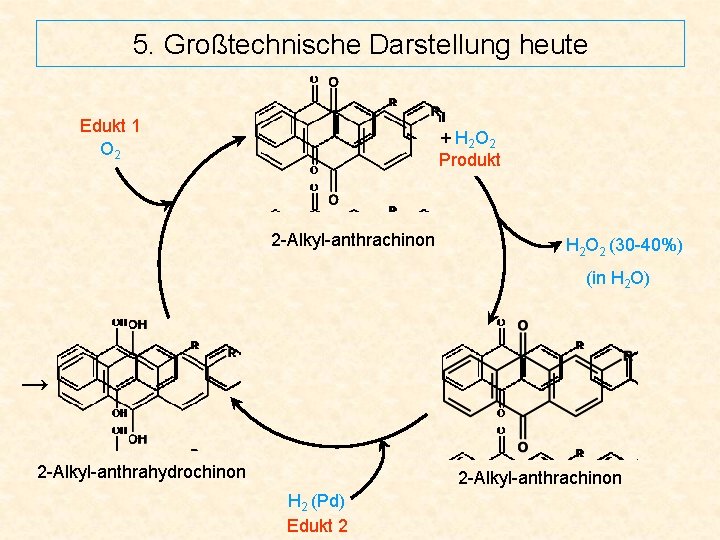
5. Großtechnische Darstellung heute Edukt 1 O 2 + H 2 O 2 Produkt 2 -Alkyl-anthrachinon H 2 O 2 (30 -40%) (in H 2 O) → 2 -Alkyl-anthrahydrochinon 2 -Alkyl-anthrachinon H 2 (Pd) Edukt 2

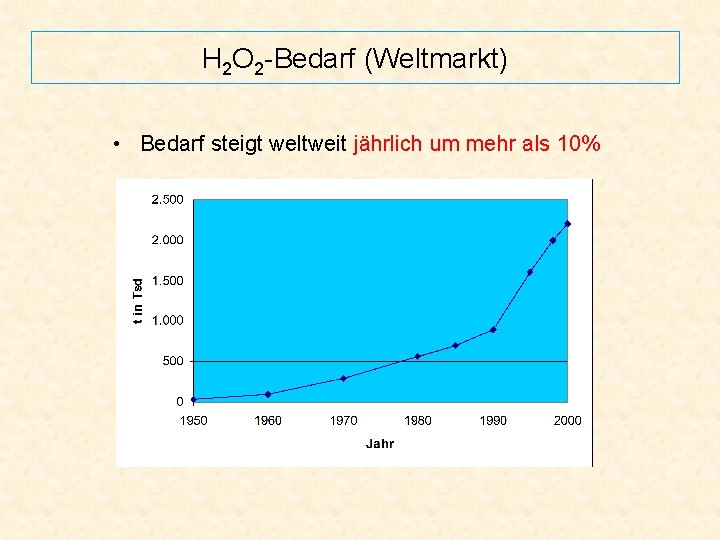
H 2 O 2 -Bedarf (Weltmarkt) • Bedarf steigt weltweit jährlich um mehr als 10%

6. Verwendung 1831 Publikation von Heinrich Wilhelm Kurrer: „ Diese Flüssigkeit [. . . ] wird, wenn man es erst in großem wohlfeil zubereiten gelernt hat, zur Vervollkommnung der Bleichkunst wesentlich beitragen. “

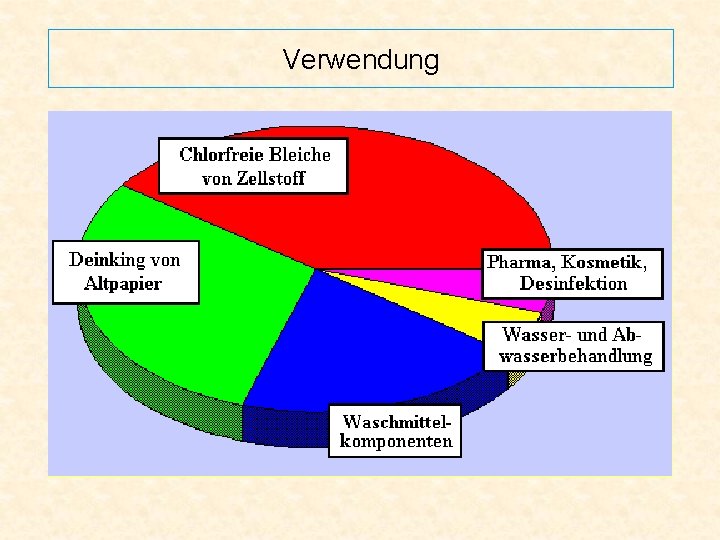
Verwendung • Lösung als Bleichmittel in der Papier- und Zellstoffindustrie und in der Textilindustrie • 3 -8%ige Lösung für medizinische und kosmetische Zwecke ⇨Versuch 4 • in gebundener Form als Waschmittelkomponente (“festes“ H 2 O 2) ⇨Versuch 5 • chemische Abwasserbehandlung • in der chemischen Industrie zur Synthese von organischen Peroxiden und Epoxyverbindungen • 85 -90%ige Lösung für militärische Anwendungen und als Treibstoff für Satellitenantriebe

Verwendung

Verwendung als Desinfektionsmittel • antimikrobielle Wirksamkeit von H 2 O 2 seit etwa 100 Jahren bekannt • abtötende Wirkung beruht auf oxidativen Zerstörung wichtiger Zellkomponenten durch hochaktiven Sauerstoff • Sauerstoff in statu nascendi entsteht beim Zerfall • Vorteil: Verzicht auf Konservierungsstoffe ⇨ Versuch 4

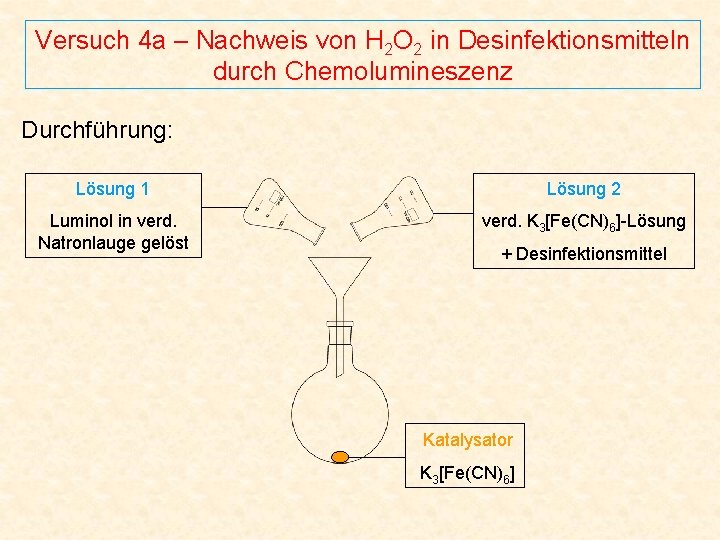
Versuch 4 a – Nachweis von H 2 O 2 in Desinfektionsmitteln durch Chemolumineszenz Durchführung: Lösung 1 Lösung 2 Luminol in verd. Natronlauge gelöst verd. K 3[Fe(CN)6]-Lösung + Desinfektionsmittel Katalysator K 3[Fe(CN)6]

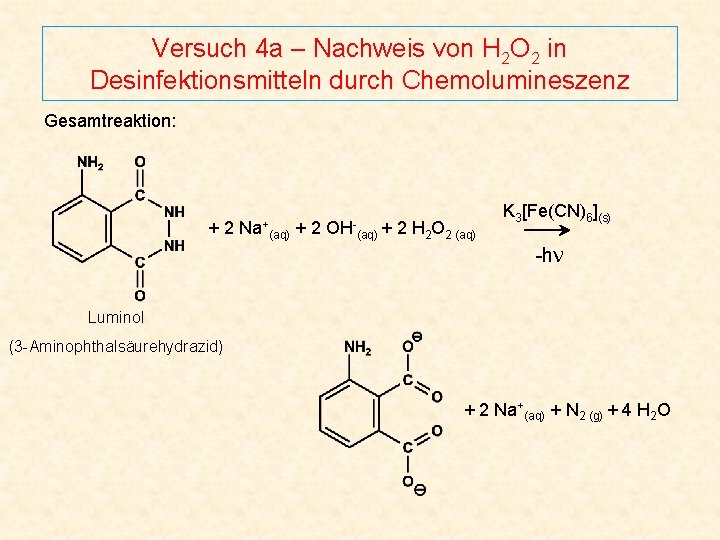
Versuch 4 a – Nachweis von H 2 O 2 in Desinfektionsmitteln durch Chemolumineszenz Gesamtreaktion: +2 Na+ (aq) +2 OH- (aq) + 2 H 2 O 2 (aq) K 3[Fe(CN)6](s) -hν Luminol (3 -Aminophthalsäurehydrazid) + 2 Na+(aq) + N 2 (g) + 4 H 2 O

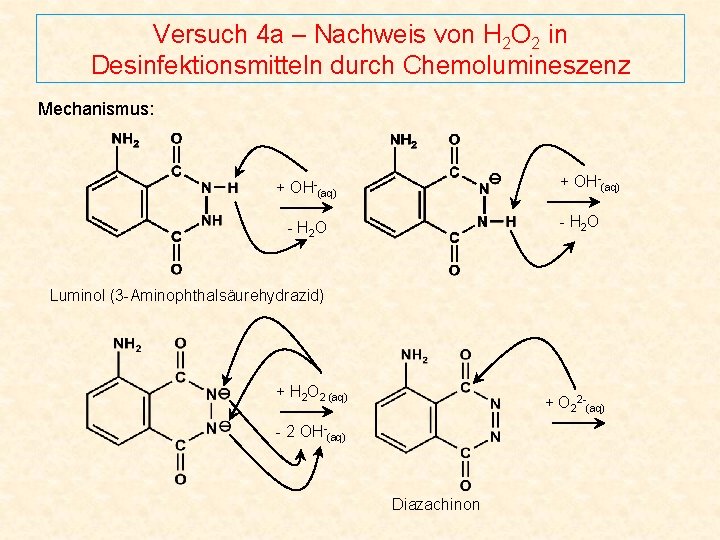
Versuch 4 a – Nachweis von H 2 O 2 in Desinfektionsmitteln durch Chemolumineszenz Mechanismus: + OH-(aq) - H 2 O Luminol (3 -Aminophthalsäurehydrazid) + H 2 O 2 (aq) + O 22 -(aq) - 2 OH-(aq) Diazachinon

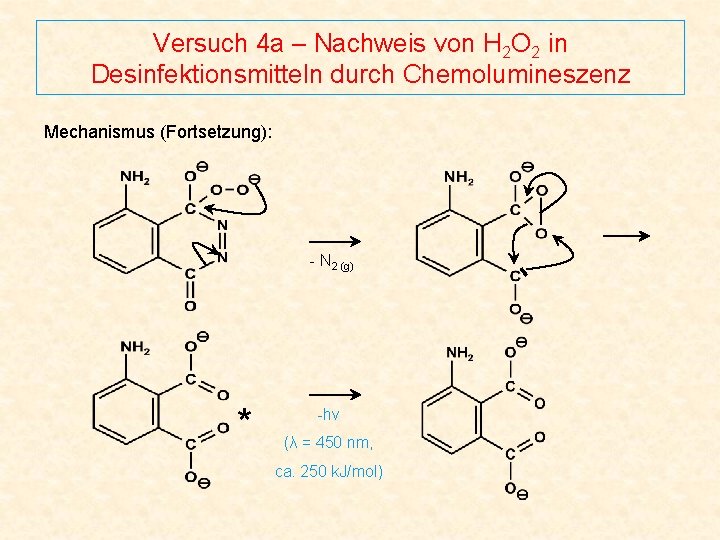
Versuch 4 a – Nachweis von H 2 O 2 in Desinfektionsmitteln durch Chemolumineszenz Mechanismus (Fortsetzung): - N 2 (g) * -hν (λ = 450 nm, ca. 250 k. J/mol)

Versuch 4 b – Quantitative Bestimmung von H 2 O 2 in Desinfektionsmitteln Bestimmung mit Hilfe der Permanganometrie: Durchführung: • • Einwaage: 5 g Desinfektionslösung Maßlösung: KMn. O 4 -Lösung (c = 0, 02 mol/L) Milieu: schwefelsauer Endpunktsbestimmung: bleibende blaßrosa Färbung der Lösung (mind. ½ Minute) Reaktionsgleichung: 2 +7 Mn. O 4 -(aq) + violett -1 5 H 2 O 2 (aq) + 6 H 3 O+ (aq) 2 +2 Mn 2+ blaßrosa 0 (aq) + 5 O 2 (g)↑ + 14 H 2 O

Versuch 4 b – Quantitative Bestimmung von H 2 O 2 in Desinfektionsmitteln Berechnung: 1 m. L KMn. O 4 -Lösung (c = 0, 02 mol/L) enthält 3, 16 mg KMn. O 4 (M(KMn. O 4) = 158 g/mol) Somit ergibt sich: m(H 2 O 2) = 3, 16 mg · 5 mol · 34 g/mol 2 mol · 158 g/mol = 1, 7 mg Also entsprechen. . . . m. L KMn. O 4 -Lösung. . mg H 2 O 2. Für den Massenanteil ergibt sich somit: w(H 2 O 2) = m(H 2 O 2) m(Desinfektionsmittel) = . . . g = 5 g Literaturwert (Kontaktlinsendesinfektionsmittel): w = 0, 6% . . . . %

Verwendung in Waschmitteln • z. B. im Fleckensalz 15 -30% Bleichmittel in Form von Natriumcarbonat-Peroxohydrat 2 Na 2 CO 3 · 3 H 2 O 2 oder als Natriumperoxoborat “Na. BO 2 · H 2 O 2 · 3 H 2 O” • freigesetztes H 2 O 2 zerstört Schmutz durch Oxidation → farbige Anschmutzungen werden in nicht farbige Verbindungen überführt • Bleichwirkung geht von atomaren Sauerstoff aus (statu nascendi) ⇨ Versuch 5

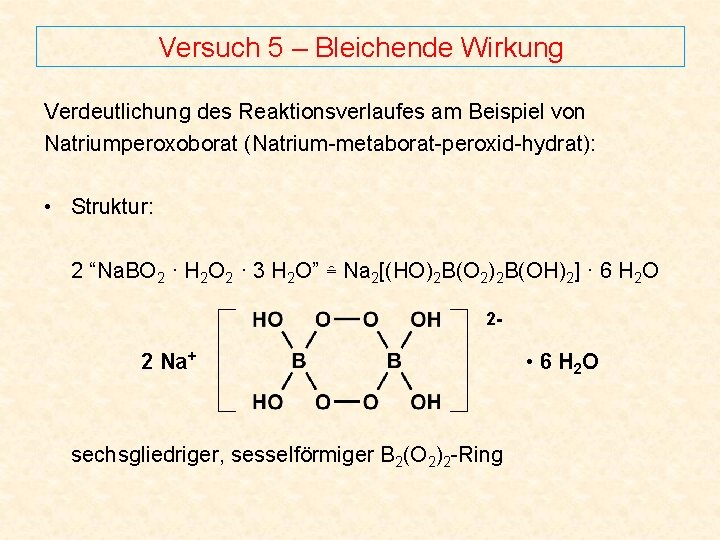
Versuch 5 – Bleichende Wirkung Verdeutlichung des Reaktionsverlaufes am Beispiel von Natriumperoxoborat (Natrium-metaborat-peroxid-hydrat): • Struktur: 2 “Na. BO 2 · H 2 O 2 · 3 H 2 O” ≙ Na 2[(HO)2 B(O 2)2 B(OH)2] · 6 H 2 O 2 - 2 Na+ sechsgliedriger, sesselförmiger B 2(O 2)2 -Ring • 6 H 2 O

Versuch 5 – Bleichende Wirkung (1) Freisetzung von H 2 O 2: Na 2[B 2(O 2)2(OH)4] (s) + 2 H 2 O 2 H 2 BO 3 - (aq) + 2 H 2 O ∆ 2 H 2 O 2 (aq) + 2 Na+(aq) + 2 H 2 BO 3 -(aq) 2 H 3 BO 3 (aq) + 2 OH-(aq) (2) Zerfall von H 2 O 2 mit Bleichwirkung: H 2 O 2 (aq) + OH-(aq) H 2 O + HO 2 -(aq) OH-(aq) + [O] ↓ statu nascendi → Bleichwirkung unerwünschte Reaktion: 2 H 2 O 2 (aq) ∆ 2 H 2 O + O 2 (g) ↑

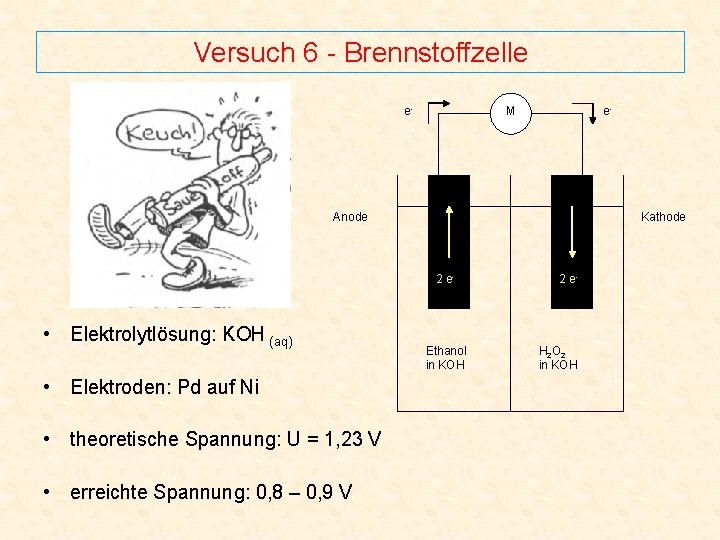
Versuch 6 - Brennstoffzelle e- M e- Anode Kathode 2 e- • Elektrolytlösung: KOH (aq) • Elektroden: Pd auf Ni • theoretische Spannung: U = 1, 23 V • erreichte Spannung: 0, 8 – 0, 9 V Ethanol in KOH 2 e- H 2 O 2 in KOH

Versuch 6 - Brennstoffzelle Kohlenstoffoxidation an der Anode: -3 -1 H 3 C―CH 2―OH (aq) + 12 OH- +4 2 CO 2 (g) + 9 H 2 O + 12 e- (aq) Sauerstoffreduktion an der Kathode: -1 direkte Reaktion: 6 H 2 O 2 (aq) + 12 e- -2 12 OH-(aq) oder Zersetzung unter katalytischen Einfluß des Elektrodenmaterials: -1 6 H 2 O 2 (aq) 0 Pd -2 0 6 H 2 O + 3 O 2 (g) + 6 H 2 O + 12 e- -2 12 OH-(aq) Also: Pro Mol H 2 O 2 werden 2 Mol Elektronen verbraucht.

Schlussbetrachtung ⇨ ideales Oxidationsmittel, da es keine belastenden Nebenprodukte bildet ⇨ keine Anreicherung in der Natur (weder durch natürliche, noch durch industrielle Prozesse) ⇨ immer mehr Anwendungen als umweltfreundliche Alternative zu Chlor und dessen Derivaten
 Permanganometrie wasserstoffperoxid
Permanganometrie wasserstoffperoxid Redoxamphoterie beispiele
Redoxamphoterie beispiele Projektplan softwareeinführung
Projektplan softwareeinführung Gliederung foto
Gliederung foto Motivationsschreiben gliederung
Motivationsschreiben gliederung Projektstrukturplan gliederung
Projektstrukturplan gliederung Biografie gliederung
Biografie gliederung Definition autoritärer führungsstil
Definition autoritärer führungsstil Abschreibung rechnungswesen
Abschreibung rechnungswesen Gliederung mathematik
Gliederung mathematik Biografie gliederung
Biografie gliederung W-seminar bayern gliederung
W-seminar bayern gliederung Klimawandel gliederung
Klimawandel gliederung Gliederung qualitative forschung
Gliederung qualitative forschung Unversteuerte rücklagen definition
Unversteuerte rücklagen definition Gliederung facharbeit
Gliederung facharbeit Der filialleiter inhaltsangabe
Der filialleiter inhaltsangabe Vertikale gliederung fachsprache
Vertikale gliederung fachsprache Kriterium der kleinsten quadrate
Kriterium der kleinsten quadrate Volxbibel bergpredigt
Volxbibel bergpredigt Gliederung in niveaus
Gliederung in niveaus Was bedeutet gliederung
Was bedeutet gliederung Leise begleitung deutungshypothese
Leise begleitung deutungshypothese Gliederung gif
Gliederung gif Friedrich nietzsche vereinsamt
Friedrich nietzsche vereinsamt Georg simmel biographie
Georg simmel biographie Divisionale organisation
Divisionale organisation Mitarbeiterbindung gliederung
Mitarbeiterbindung gliederung Weg der erkenntnisgewinnung
Weg der erkenntnisgewinnung Fachtext definition
Fachtext definition Gliederung des wortschatzes
Gliederung des wortschatzes Comment englisch
Comment englisch Perma 1 2002
Perma 1 2002 Rational rose sequence diagram
Rational rose sequence diagram Les hanson
Les hanson Loi du 4 mars 2002
Loi du 4 mars 2002 Milne and bull 2002
Milne and bull 2002