Alkaliund Erdalkalimetalle Experimentalvortrag AC Marietta Fischer Gliederung 1











































- Slides: 53

Alkaliund Erdalkalimetalle Experimentalvortrag (AC) Marietta Fischer

Gliederung 1. Einstieg 2. Gruppeneigenschaften 2. 1 Metalle bringen Farbe ins Spiel -Flammenfärbung- 2. 2 Die Reaktion mit Wasser 2. 3 Eine „spannungsvolle“ Geschichte -Reduktionspotentiale- 2. 4 Da kommt etwas in Bewegung -Ionenwanderung u. Elektrolyten- 3. Erdalkalimetalle 4. Schulrelevanz

1. Einstieg Alkalimetalle „al kalja“ (arabisch)=Asche 1807 K aus Pflanzenasche 1807 Na (ägypt. : neter = Soda) 1817 Li in Gesteinsmaterialien (gr. : lithos = der Stein) 1860/61 Cs u. Rb durch Spektralanalyse 1860/61 (lat. : rubidus = dunkelrot; caesius = himmelblau) 1939 Fr entdeckt durch die Französin M. Perey und benannt nach ihrem Vaterland

1. Einstieg Gruppeneigenschaften Valenzelektronenkonfiguration s 1 s-Elektron leicht abgegeben In jeder Periode größter Atom- und Ionenradius In Verbindungen fast ausschließlich Oxidationszahl +1 Unter hohem Druck verhalten sich K, Rb und Cs wie Übergangsmetalle, da s-Elektron in d-Niveau wechselt

1. Einstieg Vorkommen Liegen in der Natur gebunden vor (Bsp. : Minerale) Gewicht in der Erdkruste : Abb. : Sylvin (KCl) Fr nur 1, 5 g der gesamten Erdkruste Abb. : Steinsalz (Na. Cl)

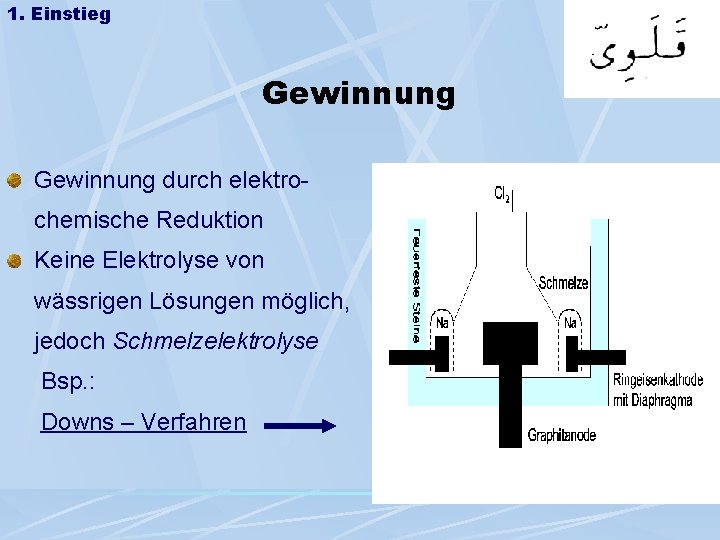
1. Einstieg Gewinnung durch elektrochemische Reduktion Keine Elektrolyse von wässrigen Lösungen möglich, jedoch Schmelzelektrolyse Bsp. : Downs – Verfahren

1. Einstieg Physikalische Eigenschaften Weiche Metalle Li, Na, K geringere Dichte als Wasser Li geringste Dichte aller fester Elemente Li, Na, K, Rb silberweiß; Cs goldton Reduktionspotentiale stark negativ Zunahme von elektropositivem Charakter Bildung von Hydroxidschicht (Aufbewahrung: Petroleum)

1. Einstieg Physiologische Eigenschaften Li ist toxisch, in bestimmten Antidepressiva in der Medizin eingesetzt. Na K Rb essentiell (Ionenkanäle usw. ) nicht toxisch, nicht essentiell Cs (radioaktive Isotop 137 Cs ausgenommen!)

1. Einstieg Erdalkalimetalle Be 1808 Mg, benannt nach Stadt Magnesia 1808 Ca, gr. calx = Kalk 1808 Sr nach Strontian in Schottland 1808 Ba, gr. : barys = schwer. 1828 Be nach Beryll (gr. : beryllos) 1898 Ra, lat. radius = Lichtstrahl Ca Mg

1. Einstieg Gruppeneigenschaften Valenzelektronenkonfiguration s 2 Elektropositive Metalle Ionisierungsenergie nimmt ab; Reduktionskraft steigt von Be Ba In stabilen Verbindungen nur mit Oxidationszahl +2

1. Einstieg Vorkommen In Natur nicht elementar Ca-Verbindungen als gesteinsbildende Minerale Abb. : Calcit Abb. : Strontianit

1. Einstieg Gewinnung Darstellung durch Schmelzelektrolyse oder chemische Reduktion l Be durch Reduktion von Be. F 2 mit Mg l Mg durch Schmelzelektrolyse von Mg. Cl 2 l Ca durch Elektrolyse von Ca. Cl 2 l Ba durch Reduktion von Ba. O mit Al

1. Einstieg Physikalische Eigenschaften Leichtmetalle Be weicht in physik. Daten ab: stahlgrau, spröde und hart Mg silberglänzend, läuft mattweiß an Ca, Sr, Ba sehr ähnlich: silberweiß, laufen schnell an, weich wie Pb Elektropositive Metalle mit stark negativen Reduktionspotentialen

1. Einstieg Physiologische Eigenschaften Be: extrem giftig, stark krebserzeugend Mg: Salze vor allem bei Pflanzen im Stoffwechsel ein bedeutende Rolle Ca: Verbindungen in Knochen, Zähnen, Gehäusen, sowie verschiedenen Pflanzen Sr: Strontiumbromid in der Medizin verwendetes Beruhigungsmittel Ba: giftig

1. Einstieg: Klassifizierung Li Na K Mg Ca Smp. °C 179 97, 5 63, 7 649 839 Sdp. °C 1336 880 760 1107 1494 1. Ionisierungsenergie 520 496 419 738 590 k. J/mol Reduktionspotent. -3, 05 -2, 71 -2, 93 V V V -2, 36 V -2, 87 V Reaktivität EN Nimmt zu 1, 0 Nimmt zu 0, 9 1, 2 1, 0

2. 1 Metalle bringen Farbe ins Spiel Flammenfärbung Die Salze ergeben intensive Färbung Durch hohe Temperaturen können Außenelektronen („Leuchtelektronen“) ein höheres Energieniveau besetzen. Durch Rückfallen in den Grundzustand wird Energie in Form von Licht frei

Demo 1 Flammenfärbung

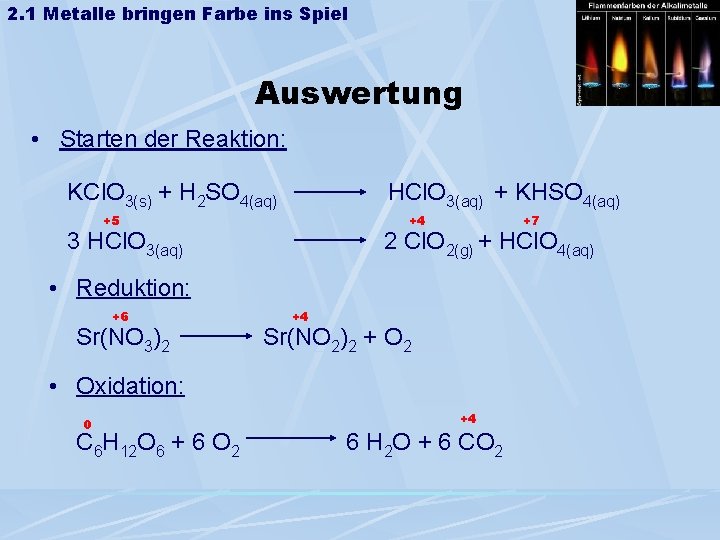
2. 1 Metalle bringen Farbe ins Spiel • Farbigkeit durch Vorgänge in der Elektronenhülle: Schritt 1: Elektronen nehmen Energie auf thermische Anregung Schritt 2 : Anhebung auf ein höheres Besetzungsniveau 2 p Schritt 3: Rückkehr zum 2 s hν Grundzustand unter Aussendung von Licht

2. 1 Metalle bringen Farbe ins Spiel Emissionsspektroskopie Ein Molekül durchläuft den Zustand hoher Energie zu einem Zustand niedriger Energie Dabei wird überschüssige Energie in Form eines Photons emittiert: Alkalimetalle Li Na K Rb Cs kamin gelb violett blau rot Erdalkalimetalle Be Mg Ca Sr Ba ziegel kamin grün rot

2. 1 Metalle bringen Farbe ins Spiel Verwendung Analytische Chemie Pyrotechnik: Feuerwerksraketen und bengalische Feuer

2. 1 Metalle bringen Farbe ins Spiel Versuch 1: Bengalisches Feuer

2. 1 Metalle bringen Farbe ins Spiel Auswertung • Starten der Reaktion: KCl. O 3(s) + H 2 SO 4(aq) HCl. O 3(aq) + KHSO 4(aq) +5 +4 +7 3 HCl. O 3(aq) 2 Cl. O 2(g) + HCl. O 4(aq) • Reduktion: +6 +4 Sr(NO 3)2 Sr(NO 2)2 + O 2 • Oxidation: 0 +4 C 6 H 12 O 6 + 6 O 2 6 H 2 O + 6 CO 2

2. 2 Die Reaktion mit Wasser Alkalimetalle Salze meist leicht löslich Li, Na reagieren unter H 2 –Entwicklung zum Hydroxid, ohne Entzündung des H 2 K, Rb reagieren unter spontaner Entzündung des H 2 Cs reagiert explosionsartig Hydroxide sind starke Basen

2. 2 Die Reaktion mit Wasser Erdalkalimetalle Spiegelt sich die Reaktivität wider: l zunehmend von Be Ba Lösen sich unter H 2 –Entwicklung zu Hydroxiden Löslichkeit der Salze abhängig von Gitterenergie und Hydrationsenthalpie

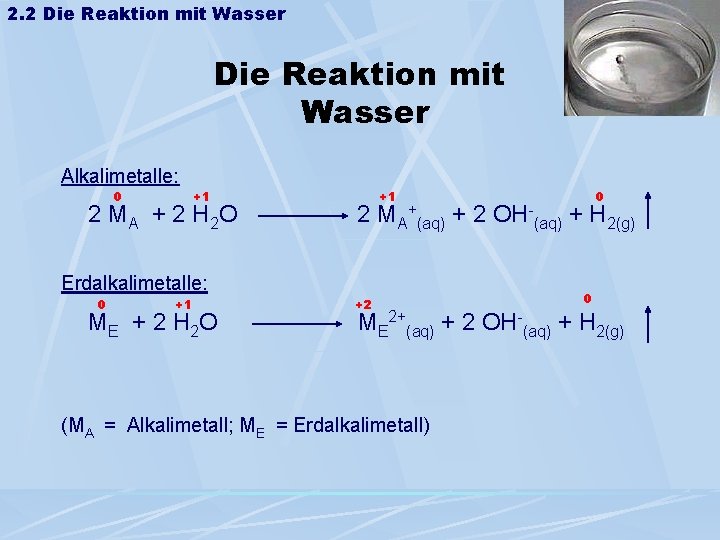
2. 2 Die Reaktion mit Wasser Alkalimetalle: 0 +1 +1 2 MA + 2 H 2 O 2 MA + (aq) Erdalkalimetalle: 0 +1 +2 + 2 OH- 0 (aq) + H 2(g) 0 ME + 2 H 2 O ME 2+(aq) + 2 OH-(aq) + H 2(g) (MA = Alkalimetall; ME = Erdalkalimetall)

2. 2 Die Reaktion mit Wasser Versuch 2: Li-, Na- Billard; im Vgl. mit Mg

2. 2 Die Reaktion mit Wasser Lithium und Natrium l Reagieren unter Magnesium l Reagiert nicht mit kaltem Wasser l Reaktionsfähigkeit nimmt von Be Ba zu H 2 -Entwicklung zum Hydroxid l Reaktionsfähigkeit nimmt von Li Cs zu

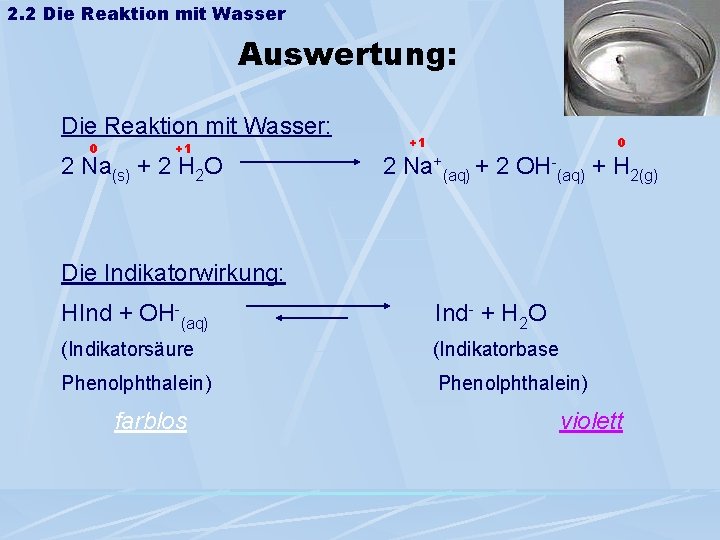
2. 2 Die Reaktion mit Wasser Auswertung: Die Reaktion mit Wasser: 0 +1 +1 0 2 Na(s) + 2 H 2 O 2 Na+(aq) + 2 OH-(aq) + H 2(g) Die Indikatorwirkung: HInd + OH-(aq) Ind- + H 2 O (Indikatorsäure (Indikatorbase Phenolphthalein) farblos Phenolphthalein) violett

2. 3 Eine „spannungsvolle“ Geschichte Reduktionspotentiale M+ + e- M Größe eines Redoxpaares ist ΔE zwischen M(s) und M+(aq) sind stark negativ; Na Cs Li negativste Reduktionspotential l Gute Verwendung in Elektrochemie

2. 3 Eine „spannungsvolle“ Geschichte Galvanische Elemente Energieumwandler Primär-, Sekundärelemente und Brennstoffzellen Redoxvorgang erzeugt Strom; Energie in Elektrodensubstanz gespeichert Brennstoffzelle: Brennstoff wird Elektrode laufend zugeführt Sekundärelement: Zelle kann wieder geladen werden (Akkumulator)

2. 3 Eine „spannungsvolle“ Geschichte Die Lithiumbatterie Hohe Potentialdifferenz zwischen Li und edlem Metall Hohe Energiedichte Niedrige Selbstentladung Lange Lebensdauer

2. 3 Eine „spannungsvolle“ Geschichte Demo 2: Lithium - Batterie

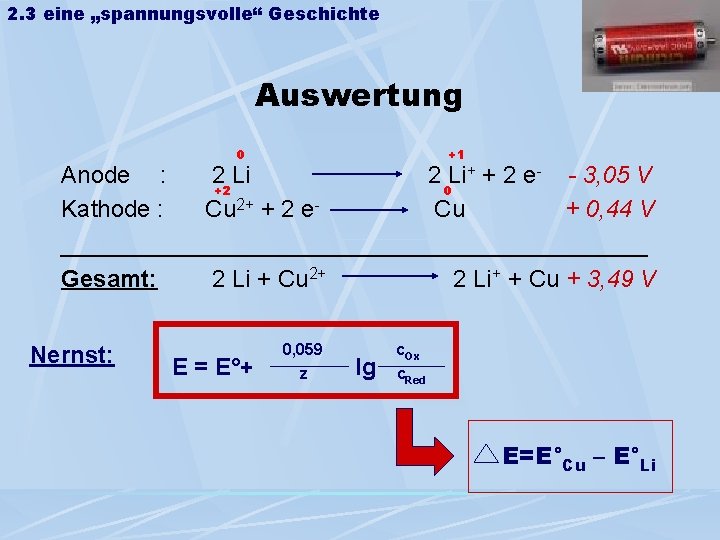
2. 3 eine „spannungsvolle“ Geschichte Auswertung 0 +1 + + 2 e- - 3, 05 V Anode : 2 Li +2 0 Kathode : Cu 2+ + 2 e- Cu + 0, 44 V ______________________ Gesamt: 2 Li + Cu 2+ 2 Li+ + Cu + 3, 49 V Nernst: E = E°+ 0, 059 z lg c. Ox c. Red E=E°Cu – E°Li

2. 4 Da kommt etwas in Bewegung Elektrolytische Lösungen Elektrolyt: polare Verbindungen, die sich in Wasser zu freibeweglichen Ionen lösen leiten den Strom l Träger des Stroms: Ionen l Kationen(+) Kathode (-) l Anionen(-) Anode (+)

2. 4 Da kommt etwas in Bewegung Versuch 3: Reinigen von angelaufenem Silber

2. 4 Da kommt etwas in Bewegung Auswertung Wie kommt es zu angelaufenem Silber? 0 +1 0 -2 2 Ag(s) + H 2 S(g) + 0, 5 O 2(g) Ag 2 S(s) + H 2 O Reinigen von angelaufenem Silber: +1 0 0 +3 3 Ag 2 S(s) + 2 Al(s) 6 Ag(s) + 2 Al 3+(aq) + 3 S 2 -(aq) Aluminium dient als Lokalelement Elektrolyt: Na. Cl(s) Na+(aq) + Cl-(aq)

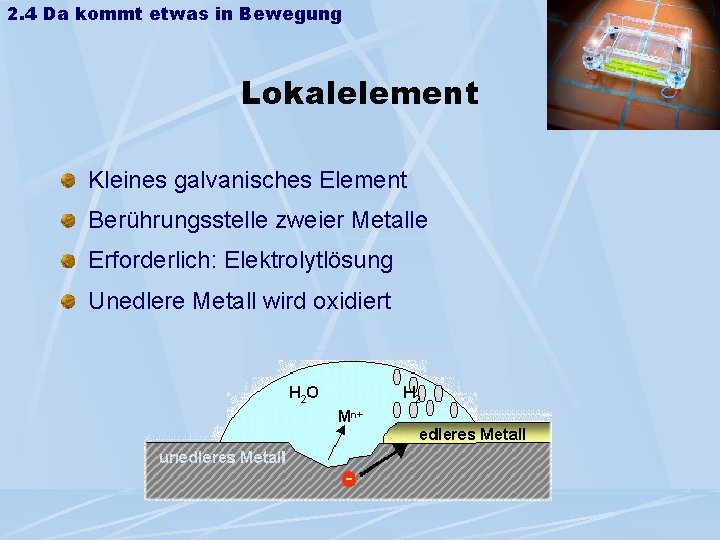
2. 4 Da kommt etwas in Bewegung Lokalelement Kleines galvanisches Element Berührungsstelle zweier Metalle Erforderlich: Elektrolytlösung Unedlere Metall wird oxidiert

2. 4 Da kommt etwas in Bewegung Elektrolyse Salze im elektrischen Feld Anode (+) zieht Anionen (-) an, Kathode (-) zieht Kationen (+) an An den Elektroden werden Ionen reduziert oder oxidiert Bilden sich Atome oder Moleküle, nimmt die Leitfähigkeit ab Stromfluss: wandernde Ionen keine Elektronen

2. 4 Da kommt etwas in Bewegung Demo 3: Ionenwanderungen

2. 4 Da kommt etwas in Bewegung Verwendung Beispiel: Gelelektrophorese l DNA Polyanion l Wanderung im elektrischen Feld l Auftrennung verschiedengroßer Fragmente l Molekularsieb: 1) Agarosegel oder 2) Polyacrylamid

Erdalkalimetalle Magnesium Gewinnung durch Schmelzflusselektrolyse von Mg. Cl 2 Mg ist ein starkes Reduktionsmittel Mg verbrennt an der Luft zu Mg. O bei 1700 -2000°C gebrannt: „Sintermagnesia“ (feuerfeste Laborgeräte)

3. Erdalkalimetalle Versuch 4: Verbrennung von Mg im Trockeneisblock

3. Erdalkalimetalle Auswertung: Verdeutlicht Reduktionsvermögen von Mg 0 +4 +2 0 2 Mg(s) + CO 2 (s) 2 Mg. O(s) + C(s) Benötigt hohe Anfangstemperatur (Oxidschicht) Starten der Reaktion: +5 400°C +7 -1 4 KCl. O 3 3 KCl. O 4 + KCl 500°C KCl. O 4 KCl + 2 O 2 Mg entzieht so gut wie allen Stoffen O 2 Bildung des stabilen Mg. O

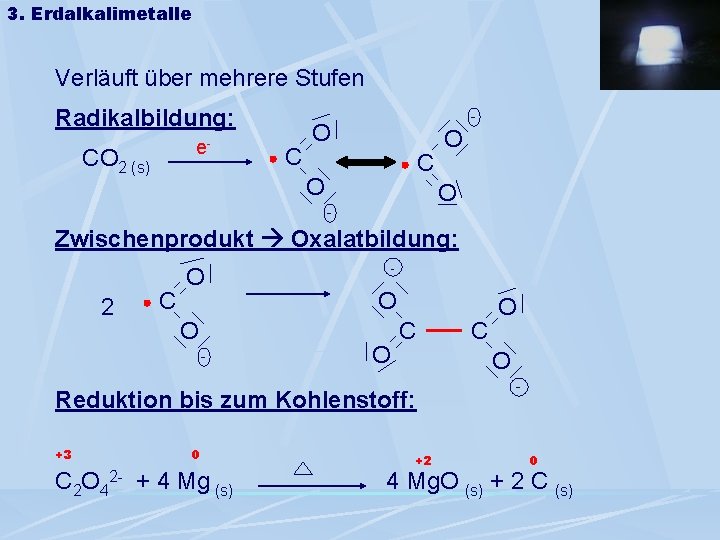
3. Erdalkalimetalle Verläuft über mehrere Stufen Radikalbildung: e- CO 2 (s) C - O C O O O - Zwischenprodukt Oxalatbildung: 2 C O O - - O O C O Reduktion bis zum Kohlenstoff: +3 0 C O +2 - 0 C 2 O 42 - + 4 Mg (s) 4 Mg. O (s) + 2 C (s)

3. Erdalkalimetalle Calcium Sehr weich Gewinnung durch Elektrolyse oder aluminothermisch Verbindung für Baustoffindustrie von Bedeutung Bsp. : Kalkstein (Ca. CO 3), Gips (Ca. SO 4) Reagiert mit H 2 O unter H 2 – Entwicklung Ca. H 2 : H 2– Erzeugung u. als Trocken- u. Reduktionsmittel

3. Erdalkalimetalle Versuch 5: Fällung von Ca 2+ -Ionen mit Rhabarbersaft

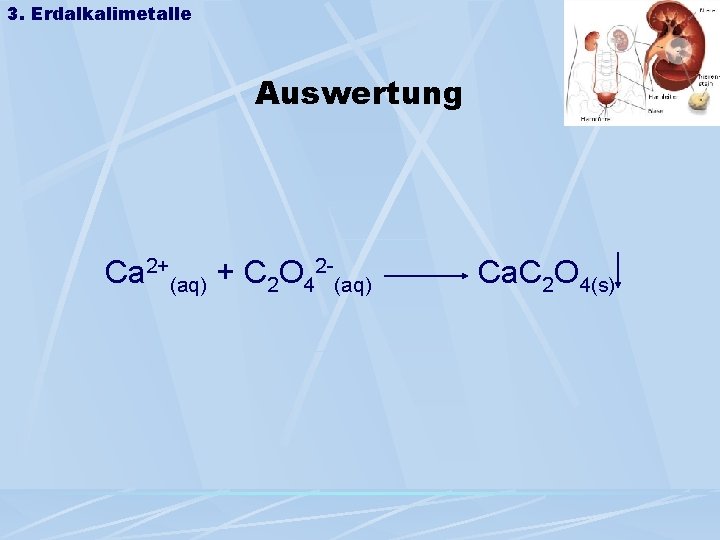
3. Erdalkalimetalle Auswertung Ca 2+(aq) + C 2 O 42 -(aq) Ca. C 2 O 4(s)

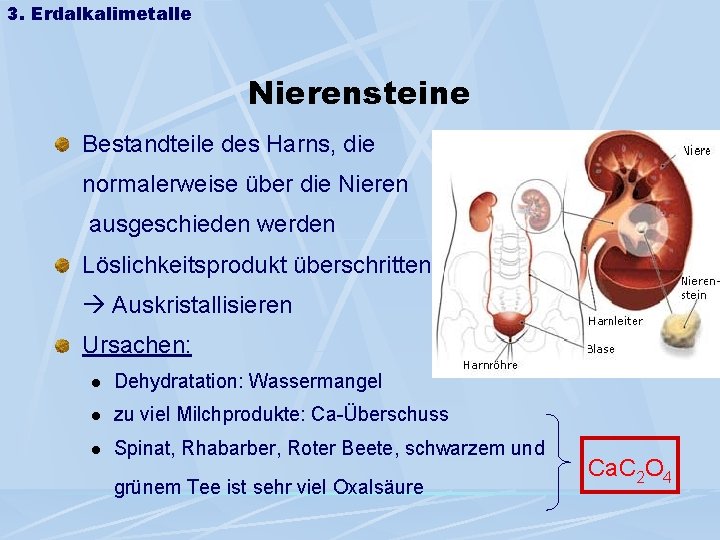
3. Erdalkalimetalle Nierensteine Bestandteile des Harns, die normalerweise über die Nieren ausgeschieden werden Löslichkeitsprodukt überschritten Auskristallisieren Ursachen: l Dehydratation: Wassermangel l zu viel Milchprodukte: Ca-Überschuss l Spinat, Rhabarber, Roter Beete, schwarzem und grünem Tee ist sehr viel Oxalsäure Ca. C 2 O 4

4. Schulrelevanz Lehrplan Chemie Gymnasium Themenübersicht

4. Schulrelevanz 8. 2 Die chemischen Reaktionen Std. : 24 l (Reaktion von Metallen und Nichtmetallen mit Sauerstoff Verbrennungsvorgänge in Alltag und Umwelt) 9. 2 Elementargruppen Std. : 14 l Verbindliche Unterrichtsinhalte: l 9. 2. 1 Alkalimetalle l Fakultative Unterrichtsinhalte: l 9. 2. 1 f Erdalkalimetalle

4. Schulrelevanz 9. 3 Elektrolyse und Ionenbegriff Std. : 8 l (Leiter und Nichtleiter, Ionen als Ladungsträger, Elektrolyse einer wässrigen Metallhalogenid. Lösung)

4. Schulrelevanz Alkalimetalle Eigenschaften und Verwendungen der Metalle und ihre Verbindungen Chemische Reaktionen Alkalilaugen, Systeme Alkalimetall / Wasser bzw. Alkalimetalloxid / Wasser Erdalkalimetalle Schwerpunkte liegen auf Calcium und Magnesium Flammenfärbung Alkalimetallverbindungen und Erdalkaliverbindungen

Vielen Dank für ihre Aufmerksamkeit
 Erdalkalimetalle
Erdalkalimetalle Lockheed martin slogan
Lockheed martin slogan Lake murray lodge rates
Lake murray lodge rates John fazio marietta college
John fazio marietta college Marietta haffner
Marietta haffner Marietta's family was quarrelling
Marietta's family was quarrelling Standardschätzfehler regression
Standardschätzfehler regression Gliederung qualitative forschung
Gliederung qualitative forschung Gliederung in niveaus
Gliederung in niveaus Vertikale gliederung fachsprache
Vertikale gliederung fachsprache Was bedeutet gliederung
Was bedeutet gliederung Leise begleitung rainer maria rilke
Leise begleitung rainer maria rilke Volxbibel bergpredigt
Volxbibel bergpredigt Gliederung gif
Gliederung gif überführungsfunktion
überführungsfunktion Georg simmel biographie
Georg simmel biographie Divisionale organisation
Divisionale organisation Naturwissenschaftliche erkenntnisgewinnung beispiel
Naturwissenschaftliche erkenntnisgewinnung beispiel Gliederung des wortschatzes
Gliederung des wortschatzes Gutachterliche stellungnahme aufbau
Gutachterliche stellungnahme aufbau Mitarbeiterbindung gliederung
Mitarbeiterbindung gliederung Projektplan softwareeinführung
Projektplan softwareeinführung Friedrich nietzsche vereinsamt
Friedrich nietzsche vereinsamt Gliederung foto
Gliederung foto Motivationsschreiben gliederung
Motivationsschreiben gliederung Wilhelm conrad röntgen lebenslauf
Wilhelm conrad röntgen lebenslauf Horizontale gliederung fachsprache
Horizontale gliederung fachsprache Gliederung mathematik
Gliederung mathematik Michel de certeau praktiken im raum
Michel de certeau praktiken im raum Projektstrukturplan gliederung
Projektstrukturplan gliederung W-seminar bayern gliederung
W-seminar bayern gliederung Definition autoritärer führungsstil
Definition autoritärer führungsstil Klimawandel gliederung
Klimawandel gliederung Unversteuerte rücklagen definition
Unversteuerte rücklagen definition Gliederung facharbeit
Gliederung facharbeit Anlagevermögen gliederung
Anlagevermögen gliederung Schrock carbene
Schrock carbene Reacciones de alcoholes
Reacciones de alcoholes Pt georg fischer trading indonesia
Pt georg fischer trading indonesia D-glyceraldehyde fischer projection
D-glyceraldehyde fischer projection D-psicose fischer projection
D-psicose fischer projection Glycerinaldehyd
Glycerinaldehyd Melitta fischer-kern
Melitta fischer-kern Cahn-ingold-prelog rules
Cahn-ingold-prelog rules Agio sebagai laba muncul dari perbedaan antara
Agio sebagai laba muncul dari perbedaan antara Articles funéraires drusenheim
Articles funéraires drusenheim Alanine fischer projection
Alanine fischer projection Kristi fischer
Kristi fischer D-aldopentose fischer projection
D-aldopentose fischer projection Fischer escala
Fischer escala Emil hermann fischer
Emil hermann fischer Tracheal shave san francisco
Tracheal shave san francisco Fischer effect formula
Fischer effect formula Lotta fischer
Lotta fischer