Sixime CHAPITRE Calcul de p H des ampholytes



![[AH 2] = C / ( 1 + R 1 R 2 ) [AH 2] = C / ( 1 + R 1 R 2 )](https://slidetodoc.com/presentation_image/4d10bb231fb9f8ff37fe6f725e8783df/image-5.jpg)


![On peut donc supposer que [H 3 O+] et [OH-] seront tous deux négligeables On peut donc supposer que [H 3 O+] et [OH-] seront tous deux négligeables](https://slidetodoc.com/presentation_image/4d10bb231fb9f8ff37fe6f725e8783df/image-10.jpg)
![2 p. H = p. Ka 1 + log { [AH-] / [AH 2] 2 p. H = p. Ka 1 + log { [AH-] / [AH 2]](https://slidetodoc.com/presentation_image/4d10bb231fb9f8ff37fe6f725e8783df/image-11.jpg)

![[A 2 -] + [OH-]= [AH 2] K 1 = [AH-] [H 3 O+] [A 2 -] + [OH-]= [AH 2] K 1 = [AH-] [H 3 O+]](https://slidetodoc.com/presentation_image/4d10bb231fb9f8ff37fe6f725e8783df/image-13.jpg)





![Résolution exacte K 2 = [X 2 -] h / [ HX- ] K Résolution exacte K 2 = [X 2 -] h / [ HX- ] K](https://slidetodoc.com/presentation_image/4d10bb231fb9f8ff37fe6f725e8783df/image-19.jpg)

![Diagramme de prédominance des espèces [H 3 X] = [H 2 X-] H 3 Diagramme de prédominance des espèces [H 3 X] = [H 2 X-] H 3](https://slidetodoc.com/presentation_image/4d10bb231fb9f8ff37fe6f725e8783df/image-21.jpg)
![Ampholyte H 2 XE. N : [H 2 X-] + 2 [HX 2 -] Ampholyte H 2 XE. N : [H 2 X-] + 2 [HX 2 -]](https://slidetodoc.com/presentation_image/4d10bb231fb9f8ff37fe6f725e8783df/image-22.jpg)
![E. N : [H 2 X-] + 2 [HX 2 -] + 3 [X E. N : [H 2 X-] + 2 [HX 2 -] + 3 [X](https://slidetodoc.com/presentation_image/4d10bb231fb9f8ff37fe6f725e8783df/image-23.jpg)

- Slides: 24

Sixième CHAPITRE Calcul de p. H des ampholytes COURS DU PROFESSEUR TANGOUR BAHOUEDDINE

1 - Solutions d’ampholytes Un ampholyte est une espèce qui, comme l’eau, intervient comme acide dans un couple et comme base dans un autre. Exemples : AH 3 + H 2 O = AH 2 - + H 3 O+ base AH 2 - + H 2 O = AH 2 - + H 3 O+ acide base AH 2 - + H 2 O = A 3 - + H 3 O+ acide AH 2 - et AH 2 - sont tous deux des espèces ampholytes

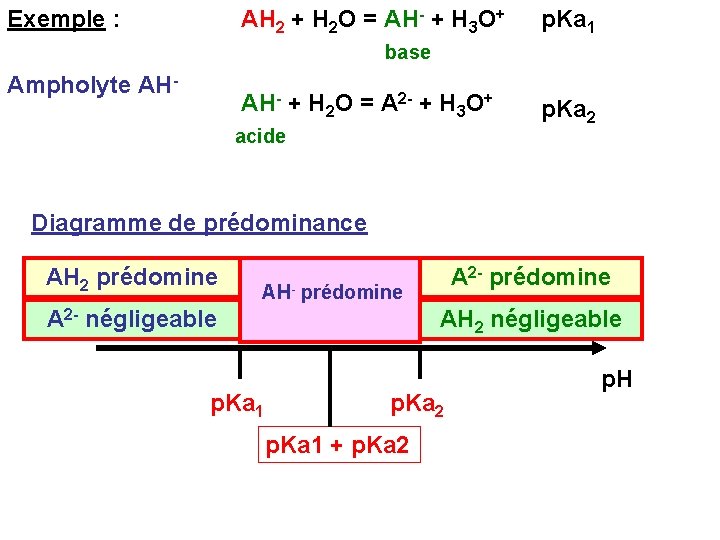
Exemple : AH 2 + H 2 O = AH- + H 3 O+ p. Ka 1 base Ampholyte AH- + H 2 O = A 2 - + H 3 O+ acide p. Ka 2 Diagramme de prédominance AH 2 prédomine A 2 - prédomine AH- prédomine A 2 - négligeable p. Ka 1 AH 2 négligeable p. Ka 2 p. Ka 1 + p. Ka 2 p. H

Calcul des concentrations de chaque espèce en fonction du p. H = p. Ka 1 + log { [AH-] / [AH 2] } = p. Ka 1 + log R 1 p. H = p. Ka 2 + log { [A 2 -] / [AH-] } = p. Ka 2 + log R 2 [AH-] / [AH 2] = R 1 = 10( p. H - p. Ka 1) [A 2 -] / [AH-] = R 2 = 10( p. H - p. Ka 2) [AH-] = R 1 [AH 2] [A 2 -] = R 2 [AH-] = R 1 R 2 [AH 2]+ [AH-] + [A 2 -] = C [AH 2] + R 1 R 2 [AH 2] = C / ( 1 + R 1 R 2 )
![AH 2 C 1 R 1 R 2 [AH 2] = C / ( 1 + R 1 R 2 )](https://slidetodoc.com/presentation_image/4d10bb231fb9f8ff37fe6f725e8783df/image-5.jpg)
[AH 2] = C / ( 1 + R 1 R 2 ) %AH 2 = 100 / ( 1 + R 1 R 2 ) [AH-] = R 1 C / ( 1 + R 1 R 2 ) %AH- = 100 R 1 / ( 1 + R 1 R 2 ) [A 2 -] = R 1 R 2 C / ( 1 + R 1 R 2 ) %A 2 - = 100 R 1 R 2 / ( 1 + R 1 R 2 ) Valeurs obtenues pour p. K 1=4 et p. K 2=8 (cas typique) 1/2 (p. K 1+ p. K 2) %AH - %A 2 - 100 0 0 1 100 0 0 2 99 1 0 3 91 9 0 4 50 50 0 5 9 91 0 6 1 98 1 7 0 91 9 8 0 50 50 9 91 10 0 1 99 11 0 0 100 12 0 0 100 13 0 0 100 14 0 0 100 p. H %AH 0 2 100 80 60 40 20 0 2 p. K 41 6 p. K 8 2 10

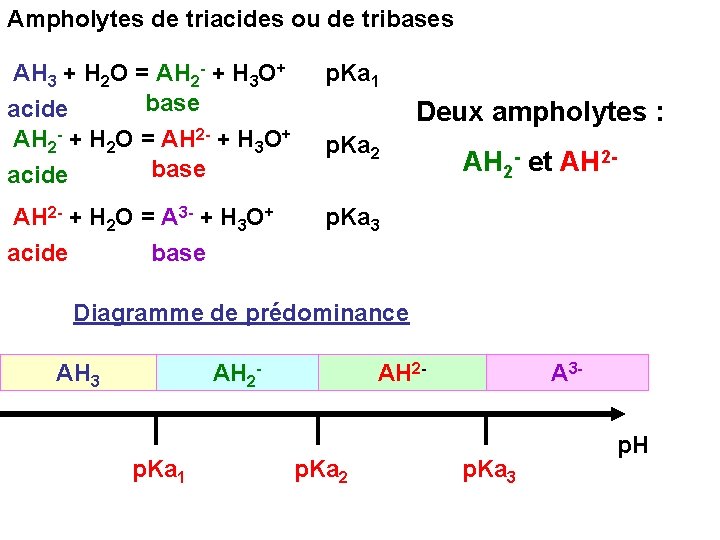
Ampholytes de triacides ou de tribases AH 3 + H 2 O = AH 2 - + H 3 O+ base acide AH 2 - + H 2 O = AH 2 - + H 3 O+ base acide p. Ka 1 AH 2 - + H 2 O = A 3 - + H 3 O+ acide base p. Ka 3 Deux ampholytes : p. Ka 2 AH 2 - et AH 2 - Diagramme de prédominance AH 3 AH 2 - p. Ka 1 AH 2 - p. Ka 2 A 3 - p. Ka 3 p. H

Calcul des concentrations de chaque espèce en fonction du p. H La démonstration est la même que dans le cas des diacides. La formule se généralise très simplement : [AH 2 -] / [AH 3] = R 1 = 10( p. H - p. Ka 1) [AH 2 -] / [AH 2 -] = R 2 = 10( p. H - p. Ka 2) [A 3 -] / [AH 2 -] = R 3 = 10( p. H - p. Ka 3) [AH 3] = C / ( 1 + R 1 R 2 + R 1 R 2 R 3 ) [AH 2 -] = R 1 R 2 C / ( 1 + R 1 R 2 + R 1 R 2 R 3 ) [A 3 -] = R 1 R 2 R 3 C / ( 1 + R 1 R 2 + R 1 R 2 R 3 )

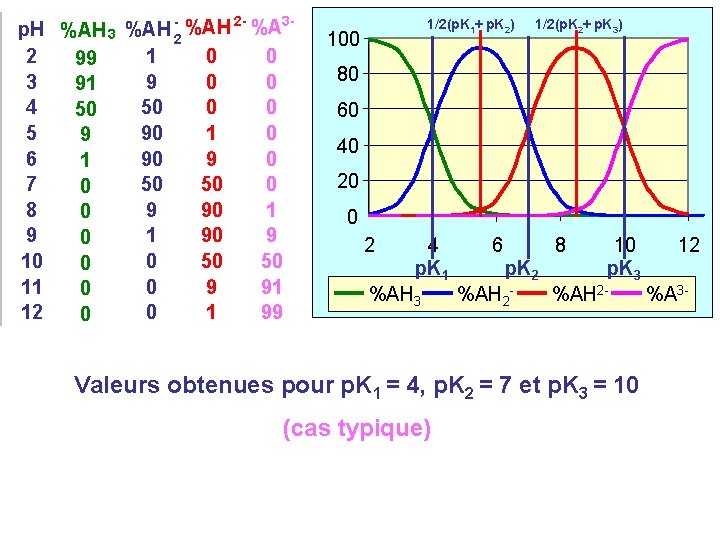
23 p. H %AH 3 %AH -2 %AH %A 2 1 0 0 99 3 9 0 0 91 4 50 0 0 50 5 90 1 0 9 6 90 9 0 1 7 50 50 0 0 8 9 90 1 0 9 1 90 9 0 10 0 50 50 0 11 0 9 91 0 12 0 1 99 0 1/2(p. K 1+ p. K 2) 100 1/2(p. K 2+ p. K 3) 80 60 40 20 0 2 4 p. K 1 %AH 3 6 8 p. K 2 %AH 2 - 10 p. K 3 %AH 2 - 12 %A 3 - Valeurs obtenues pour p. K 1 = 4, p. K 2 = 7 et p. K 3 = 10 (cas typique)

Calcul du p. H d’une solution d’ampholyte Soit l’ampholyte Na+, AH- mis en solution à la concentration initiale C 0. Quel est le p. H de cette solution ? Espèces présentes en solution : AH 2 , AH- , A 2 - , H 3 O+ , OH- , Na+ C. M. 1 : [AH 2] + [AH-] + [A 2 -] = C 0 C. M. 2 : [Na+] = C 0 E. N : [OH-] + [AH-] + 2 [A 2 -] = [H 3 O+ ] + [Na+] Hypothèse simplificatrice : L’ampholyte est a la fois un acide et une base, on peut donc supposer que le p. H de la solution ne sera ni très acide ni très basique.
![On peut donc supposer que H 3 O et OH seront tous deux négligeables On peut donc supposer que [H 3 O+] et [OH-] seront tous deux négligeables](https://slidetodoc.com/presentation_image/4d10bb231fb9f8ff37fe6f725e8783df/image-10.jpg)
On peut donc supposer que [H 3 O+] et [OH-] seront tous deux négligeables devant C 0. E. N : [OH-] + [AH-] + 2 [A 2 -] = [H 3 O+ ] + C 0 C. M. 1 : [AH 2] + [AH-] + [A 2 -] = C 0 E. N - CM 1 : [AH-] + 2 [A 2 -] - [AH 2] - [AH-] - [A 2 -] = 0 soit : [A 2 -] = [AH 2] p. H = p. Ka 1 + log { [AH-] / [AH 2] } p. H = p. Ka 2 + log { [A 2 -] / [AH-] } 2 p. H = p. Ka 1 + log { [AH-] / [AH 2] } + p. Ka 2 + log { [A 2 -] / [AH-] }
![2 p H p Ka 1 log AH AH 2 2 p. H = p. Ka 1 + log { [AH-] / [AH 2]](https://slidetodoc.com/presentation_image/4d10bb231fb9f8ff37fe6f725e8783df/image-11.jpg)
2 p. H = p. Ka 1 + log { [AH-] / [AH 2] } + p. Ka 2 + log { [A 2 -] / [AH-] } 2 p. H = p. Ka 1 + p. Ka 2 + log { [A 2 -] [AH-] / [AH-] [AH 2] } puisque : [A 2 -] = [AH 2] log { [A 2 -] [AH-] / [AH-] [AH 2] } = log 1 = 0 p. H = 1/2 ( p. Ka 1 + p. Ka 2 ) Cette formule simple est correcte dans la majorité des cas. Dans la pratique on doit avoir p. K 1 > 4 ; p. K 2 < 10 et p. C < 3 Si ces conditions sont respectées la formule est correcte

Amélioration de l’approximation Il peut arriver que la formule précédante ne donne pas d’excellents résultats surtout pour des valeurs des p. Ka extrêmes p. K 1 < 4 ou p. K 2 > 10. 1) Si p. K 1 + p. K 2 > 14 : la solution est trop basique pour pouvoir négliger [OH-] E. N : [OH-] + [AH-] + 2 [A 2 -] = [H 3 O+ ] + C 0 C. M. 1 : [AH 2] + [AH-] + [A 2 -] = C 0 E. N - CM 1 : [OH-] + [AH-] + 2 [A 2 -] - [AH 2] - [AH-] - [A 2 -] = 0 soit : [A 2 -] + [OH-]= [AH 2]
![A 2 OH AH 2 K 1 AH H 3 O [A 2 -] + [OH-]= [AH 2] K 1 = [AH-] [H 3 O+]](https://slidetodoc.com/presentation_image/4d10bb231fb9f8ff37fe6f725e8783df/image-13.jpg)
[A 2 -] + [OH-]= [AH 2] K 1 = [AH-] [H 3 O+] / [AH 2] = [AH-] [H 3 O+] / K 1 K 2 = [A 2 -] [H 3 O+] / [AH-] [A 2 -] = K 2 [AH-] / [H 3 O+] K 2 [AH-] / h + Ke / h = [AH-] h / K 1 AH- reste néanmoins dans la plupart des cas très largement majoritaire et on peut donc poser [AH-] = C K 2 C / h + Ke / h = C h / K 1 K 2 C + Ke = C h 2 / K 1 K 2 C + K 1 Ke = C h 2 = K 1 K 2 + K 1 Ke / C 2 log h = log { K 1 K 2 + (K 1 Ke / C) } p. H = -1/2 log { K 1 K 2 + (K 1 Ke / C) }

p. H = -1/2 log { K 1 K 2 + (K 1 Ke / C) } Autre forme d’écriture h 2 = K 1 K 2 + K 1 Ke / C h 2 = K 1 K 2 + K 1 K 2 Ke / K 2 C h 2 = K 1 K 2 ( 1 + Ke / K 2 C ) 2 log h = log K 1 + log K 2 + log ( 1 + Ke / K 2 C ) p. H = 1/2 { p. K 1 + p. K 2 - log ( 1 + Ke / K 2 C ) } Les deux formules sont totalement équivalentes

2) Si p. K 1 + p. K 2 < 14 : la solution est trop acide pour pouvoir négliger [H 3 O+] E. N : [OH-] + [AH-] + 2 [A 2 -] = [H 3 O+ ] + C 0 C. M. 1 : [AH 2] + [AH-] + [A 2 -] = C 0 E. N - CM 1 : [AH-] + 2 [A 2 -] - [AH 2] - [AH-] - [A 2 -] = [H 3 O+] soit : [A 2 -] - [AH 2]= [H 3 O+] K 1 = [AH-] [H 3 O+] / [AH 2] = [AH-] [H 3 O+] / K 1 K 2 = [A 2 -] [H 3 O+] / [AH-] [A 2 -] = K 2 [AH-] / [H 3 O+] K 2 [AH-] / h - [AH-] h / K 1= h AH- reste néanmoins dans la plupart des cas très largement majoritaire et on peut donc poser [AH-] = C

K 2 C / h - C h / K 1= h K 2 C - C h 2 / K 1 = h 2 + C h 2 / K 1 = K 2 C h 2 { 1+ C / K 1 } = K 2 C h 2 = K 2 C / { 1+ C / K 1 } 2 log h = log K 2 + log C - log ( 1 + C / K 1 ) p. H = 1/2 { p. K 2 +p. C + log ( 1 + C / K 1 ) }

p. H = 1/2 { p. K 2 +p. C + log ( 1 + C / K 1 ) } Autre forme d’écriture h 2 = K 2 C / { 1+ C / K 1 } h 2 = K 1 K 2 C / { K 1 + C} 2 log h = log K 1 + log K 2 + log (C / { K 1 + C} ) p. H = 1/2 { p. K 1 + p. K 2 - log ( C / ( K 1 + C) ) } Les deux formules sont totalement équivalentes

L’utilisation des formules corrigées améliore sensiblement la précision surtout dans le cas de concentrations faibles. Il y aura néanmoins des cas ou même les formules corrigées seront insuffisantes, on devra alors procéder à une résolution exacte du problème par une méthode itérative.
![Résolution exacte K 2 X 2 h HX K Résolution exacte K 2 = [X 2 -] h / [ HX- ] K](https://slidetodoc.com/presentation_image/4d10bb231fb9f8ff37fe6f725e8783df/image-19.jpg)
Résolution exacte K 2 = [X 2 -] h / [ HX- ] K 1 = [HX-] h / [ H 2 X ] Les équilibres chimiques mis en jeux sont exactement les même que ceux mis en œuvre si on met en solution le diacide faible AH 2 ou la dibase A 2 -. [ HX- ] = [X 2 -] h / K 2 [ H 2 X ] = [HX-] h / K 1 [ H 2 X ] = [X 2 -] h 2 / K 1 K 2 C. M : C = [ H 2 X] + [HX-] + [X 2 -] C = [X 2 -] { h 2 / K 1 K 2 } + [X 2 -] { h / K 2 } + [X 2 -] C = [X 2 -] [ { h 2 / K 1 K 2 } + { h/ K 2} + 1 ] La première partie de la résolution est donc totalement identique à celle mise en œuvre lors de l’étude du diacide AH 2 ou la dibase A 2 -. . [X 2 -] = C / [ { h 2 / K 1 K 2 } + { h / K 2 } + 1 ] [X 2 -] = C / L Avec L = [ 1 + { ( h / K 2 ) + ( h 2 / K 1 K 2 ) ]

La seule modification apparaît lors de l’écriture de l’électroneutralité de la solution à cause de l’introduction d’une nouvelle espèce : l’ion indifférent Na+. E. N : [HX-] + 2 [X 2 -] + [OH-] = [H 3 O+] + [Na+] [X 2 -] = C / L [ HX- ] = [X 2 -] h / K 2 = C h / K 2 L [ C h / ( K 2 L ) ] + [ 2 C / L ] + [ Ke / h ] = h C { h / K 2 L + 2 / L} + ( Ke / h ) = h + C C { h / K 2 L + 2 / L - 1 } + ( Ke / h ) = h h C { h / K 2 L + 2 / L - 1 } + Ke = h 2 - h C { h / K 2 L + 2 / L - 1 } - Ke = 0 h 2 - h C M - Ke = Q = 0 Avec M = { h / K 2 L + 2 / L - 1 } et L = [ 1 + { ( h / K 2 ) + ( h 2 / K 1 K 2 ) } + C [OH-] = Ke / h
![Diagramme de prédominance des espèces H 3 X H 2 X H 3 Diagramme de prédominance des espèces [H 3 X] = [H 2 X-] H 3](https://slidetodoc.com/presentation_image/4d10bb231fb9f8ff37fe6f725e8783df/image-21.jpg)
Diagramme de prédominance des espèces [H 3 X] = [H 2 X-] H 3 X [H 2 X-] = [HX 2 -] H 2 X - p. K 1 [HX 2 -] = [X 3 -] HX 2 - p. K 2 Il existe ici deux ampholytes différents : H 2 X- et HX 2 - X 3 - p. K 3 p. H Espèces présentes : H 3 X , H 2 X- , HX 2 - , X 3 - , H 3 O+ , OH- , Na+ C. M : C = [ H 3 X] + [H 2 X-] + [HX 2 -] + [X 3 -] Ke = [H 3 O+] [OH-] K 1 = [H 2 X-] [H 3 O+] / [ H 3 X ] K 2 = [HX 2 -] [H 3 O+] / [ H 2 X- ] K 3 = [X 3 -] [H 3 O+] / [ HX 2 - ] [X 3 -] = C / L [ HX 2 - ] = C h / K 3 L Les équilibres chimiques intervenant sont les même que ceux rencontrés lors de la mise en solution du triacide ou de la tribase. On retrouvera donc les mêmes résultats [ H 2 X- ] = C h 2 / K 2 K 3 L [ H 3 X ] = C h 3 / K 1 K 2 K 3 L Avec L = [ 1 + { h / K 3 } + { h 2 / K 2 K 3} + { h 3 / K 1 K 2 K 3 } ]
![Ampholyte H 2 XE N H 2 X 2 HX 2 Ampholyte H 2 XE. N : [H 2 X-] + 2 [HX 2 -]](https://slidetodoc.com/presentation_image/4d10bb231fb9f8ff37fe6f725e8783df/image-22.jpg)
Ampholyte H 2 XE. N : [H 2 X-] + 2 [HX 2 -] + 3 [X 3 -] + [OH-] = [H 3 O+] + Na+ [X 3 -] = C / L [ HX 2 - ] = C h / K 3 L [ H 2 X- ] = C h 2 / K 2 K 3 L C h 2 / K 2 K 3 L + 2 C h / K 3 L + 3 C/L+ Ke / h = h + C C [ h 2 / K 2 K 3 L + 2 h / K 3 L + 3 /L- 1] + Ke / h = h Ch [ h 2 / K 2 K 3 L + 2 h / K 3 L + 3 /L - 1] + Ke = h 2 - Ch [ h 2 / K 2 K 3 L + 2 h / K 3 L + 3 /L - 1] - Ke = 0 h 2 - Ch M - Ke = 0 M = [ h 2 / K 2 K 3 L + 2 h / K 3 L + 3 /L - 1] [ H 3 X ] = C h 3 / K 1 K 2 K 3 L
![E N H 2 X 2 HX 2 3 X E. N : [H 2 X-] + 2 [HX 2 -] + 3 [X](https://slidetodoc.com/presentation_image/4d10bb231fb9f8ff37fe6f725e8783df/image-23.jpg)
E. N : [H 2 X-] + 2 [HX 2 -] + 3 [X 3 -] + [OH-] = [H 3 O+] + Na+ [X 3 -] = C / L [ HX 2 - ] = C h / K 3 L [ H 2 X- ] = C h 2 / K 2 K 3 L C h 2 / K 2 K 3 L + 2 C h / K 3 L + 3 C/L+ Ke / h = h + 2 C C [ h 2 / K 2 K 3 L + 2 h / K 3 L + 3 /L- 2 ] + Ke / h = h Ch [ h 2 / K 2 K 3 L + 2 h / K 3 L + 3 /L - 2 ] + Ke = h 2 - Ch [ h 2 / K 2 K 3 L + 2 h / K 3 L + 3 /L - 2 ] - Ke = 0 h 2 - Ch M - Ke = 0 M = [ h 2 / K 2 K 3 L + 2 h / K 3 L + 3 /L - 2 ] [ H 3 X ] = C h 3 / K 1 K 2 K 3 L

Il est en fait très facile de retrouver rapidement les résultats précédants : H 2 X HXX 2 H 3 X M = { h / K 2 L + 2 / L} M = { h / K 2 L + 2 / L - 1 } M = ( 2 / L ) + ( h / K 2 L ) - 2 M = MH 2 X - 1 M = MHX- - 1 = MH 2 X - 2 M = { h 2 / K 2 K 3 L + 2 h / K 3 L + 3 / L} H 2 X- M = { h 2 / K 2 K 3 L + 2 h / K 3 L + 3 / L - 1 } MH 2 X- = MH 3 X - 1 HX 2 - M = { h 2 / K 2 K 3 L + 2 h / K 3 L + 3 / L - 2 } MHX 2 - = MH 2 X- - 1 = MH 3 X - 2 X 3 - M = { h 2 / K 2 K 3 L + 2 h / K 3 L + 3 / L - 3 } MX 3 - = MHX 2 - - 1 = MH 2 X- - 2 = MH 3 X - 3 On voit que l’on passe du M d’un acide au M de sa base conjuguée en enlevant simplement 1 à son expression.