SISTEM PERIODIK UNSUR PERTEMUAN 3 Harizal S Pd





















- Slides: 29

SISTEM PERIODIK UNSUR PERTEMUAN 3 Harizal, S. Pd. , M. Sc Program Studi Gizi Universitas Esa Unggul

KEMAMPUAN AKHIR YANG DIHARAPKAN

Sistem Periodik Unsur • Tabel periodik tabel merupakan susunan berkala unsur kimia yang disusun berdasarkan nomor atom (jumlah proton), konfigurasi elektron, dan perulangan sifat kimianya. • Kegunaan tabel periodik unsur: – Memudahkan dalam mempelajari unsur-unsur – Memudahkan dalam memprediksi berbagai sifat-sifat unsur seperti jari-jari atom, afinitas elektron, energi ionisasi, bilangan oksidasi, karakter metal/nonmetal unsur, elektronegativitas, dll – Memudahkan dalam memprediksi sifat-sifat dan keberadaan unsur-unsur yang belum ditemukan atau belum disintesis


Sejarah Perkembangan Sistem Periodik Tahun Perkembangan 1789 Antoine Lavoisier mengelompokkan ke-33 unsur menjadi gas, logam, nonlogam, dan bumi 1829 Johann Wolfgang Döbereiner mengemukakan bahwa unsur dapat dikelompokkan dalam sistem triade berdasarkan kemiripan sifat. 1862 Alexandre-Emile Béguyer de Chancourtois merupakan orang pertama yang menyadari tentang adana keperiodisasian unsur dan menyusun unsur dalam suatu spiral tabung berdasarkan kenaikan massa atom 1866 John Newlands menyusun unsur berdasarkan kenaikan massa atom dalam suatu sitem oktaf. 1869 -1870 Dmitri Mendeleev (1869) dan Julius Lothar Meyer (1870) mengembangkan sistem periodik berdasarkan kenaikan massa atom dan kemiripan sifat 1913 Henry Moseley menyusun sistem periodik berdasarkan kenaikan nomor atom (jumlah proton) 1945 Glenn Seaborg menyarankan pemisahan blok-F untuk unsur-unsur aktinida dan lantanida

Ragam bentuk Tabel periodik Unsur


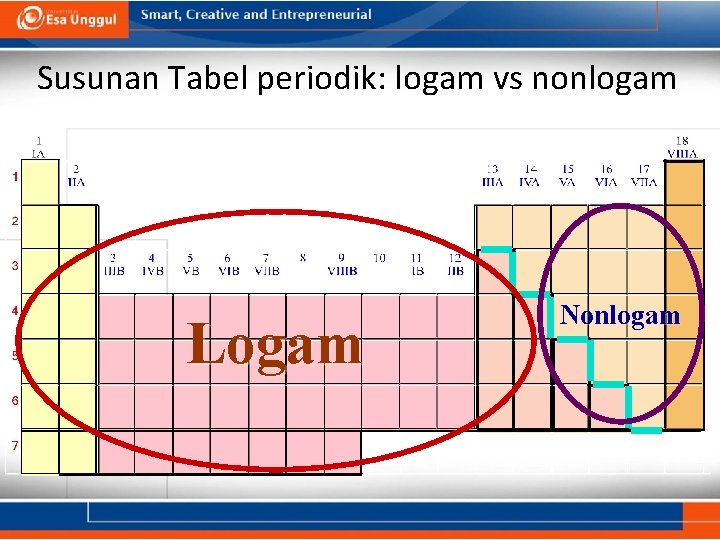
Susunan Tabel periodik: logam vs nonlogam Logam Nonlogam

Tabel periodik: tiga kelompok besar Utama, Transisi, Tanah jarang • Kelompok unsur utama, logam transisi, dan lantanida/aktinida

Unsur Golongan utama • Terdiri atas unsur-unsur pada blok s dan p (unsur dengan elektron valensinya terdapat pada kulit s dan kulit p) • Unsur blok s umumnya hanya memiliki satu bilangan oksidasi, sedangkan pada unsur blok p secara umum memiliki lebih dari satu bilangan oksidasi • Unsur golongan IIIB ([ ]s 2 d 1), IIB ([ ]d 10 s 2), lantanida, dan aktinida kadang sering dimasukkan ke dalam golongan utama karena memiliki sifat yang mirip terutama dalam hal bilangan oksidasinya. 07/12/2020

Unsur Logam Transisi • Unsur logam transisi adalah unsur yang memiliki atom dengan sub-kulit d terisi sebagian, atau dapat menghasilkan kation dengan sub-kulit d ang tidak penuh (unsur blok-d: (n − 1)d 1 -10 n s 1 -2) • Nama transisi merujuk pada perubahan elektron secara bertahap pada sub-kulit d yang notabene berada di kulit bagian dalam (inner sub-shell) • Karakteristik unsur logam transisi: – Memiliki karakteristik warna tertentu pada senyawanya karena adanya transisi transfer muatan antara logam dan ligan, serta transisi d-d. – Memiliki beberapa bilangan oksidasi karena elektron di sub-kulit d memiliki beda energi yang relatif rendah – Memiliki sifat paramagnetik karena adanya elektron tak berpasangan di sub-kulit-d – Memiliki kemampuan katalitik baik homogen maupun heterogen: adanya kemampuan logam transisi untuk memiliki banyak bilangan oksidasi membuat logam ini dapat menyerap dan melemahkan ikatan substrat – Dapat membentuk senyawa kompleks 07/12/2020

07/12/2020

07/12/2020

07/12/2020

Unsur Tanah Jarang (Rare Earth Element) • Terdiri atas unsur-unsur blok f • Secara umum, memiliki konsentrasi yang kecil di kulit bumi, meski sebagian cukup umum dijumpai. • Unsur-unsur ini umumnya dijumpai bersama-sama di alam dan sulit dipisahkan. • Sulit ditemukan dalam jumlah besar di satu tempat. • Banyak digunakan untuk berbagai aplikasi seperti laser, magnet, superkonduktor, dll. 07/12/2020

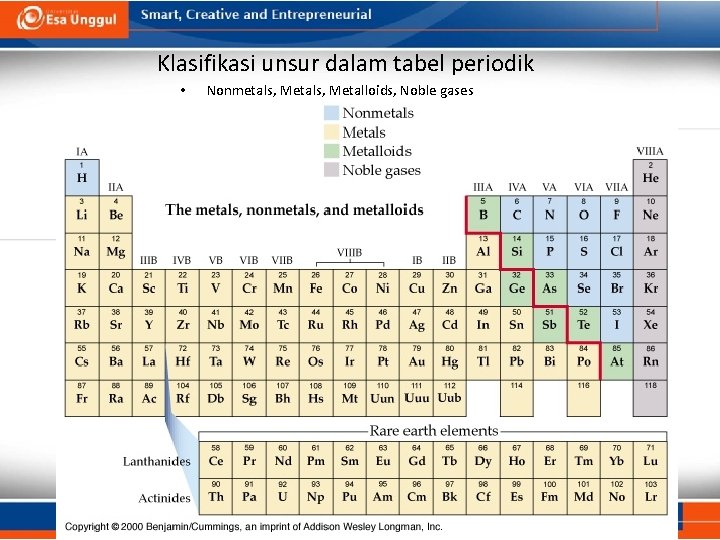
Klasifikasi unsur dalam tabel periodik • Nonmetals, Metalloids, Noble gases

Klasifikasi unsur dalam Tabel Periodik • Unsur nonmetal umumnya memiliki volatilitas yang tinggi, elastisitas yang rendah, konduktor listrik dan panas yang buruk; secara kimia, memiliki energi ionisasi dan elektronegativitas yang tinggin, dan cenderung membentuk ikatan kovalen. • Metaloid umumnya memiliki tampilan seperti logam, lebih getasdibandingkan logam, memiliki kemampuan konditor tingkat menengah, dapat membentuk alloy dengan logam lain, sifatnya relatif berada diantara logam dan nonlogam. • Logam cenderung memiliki tingkat kekerasan dan kerapatan yang tinggi, buram, berkilau, memiliki konduktivitas panas dan listrik yang besar, plastis, dapat membentuk alloy dengan sesama logam, umumnya membentuk kation. 07/12/2020

Periode dalam tabel periodik Periode merupakan susunan horizontal unsur-unsur dalam tabel periodik Terdapat tujuh periode dalam tabel periodik (baris 1 -7) Unsur-unsur dalam satu periode memiliki jumlah kulit yang sama Periode ke-2 Periode ke-6

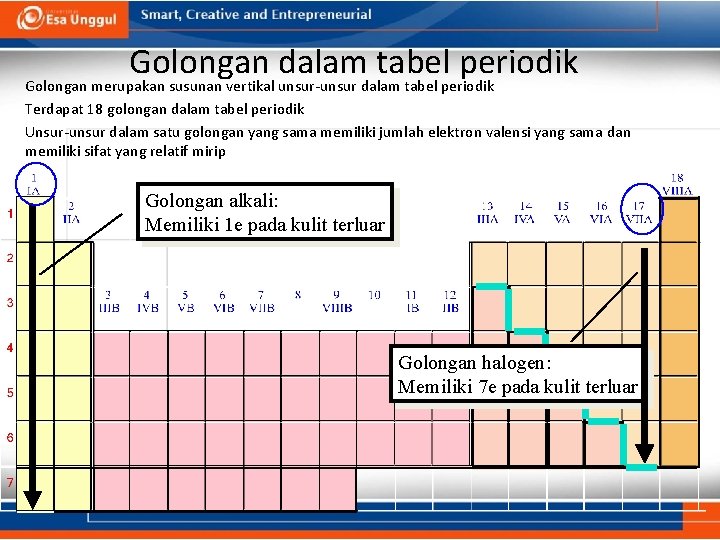
Golongan dalam tabel periodik Golongan merupakan susunan vertikal unsur-unsur dalam tabel periodik Terdapat 18 golongan dalam tabel periodik Unsur-unsur dalam satu golongan yang sama memiliki jumlah elektron valensi yang sama dan memiliki sifat yang relatif mirip Golongan alkali: Memiliki 1 e pada kulit terluar Golongan halogen: Memiliki 7 e pada kulit terluar

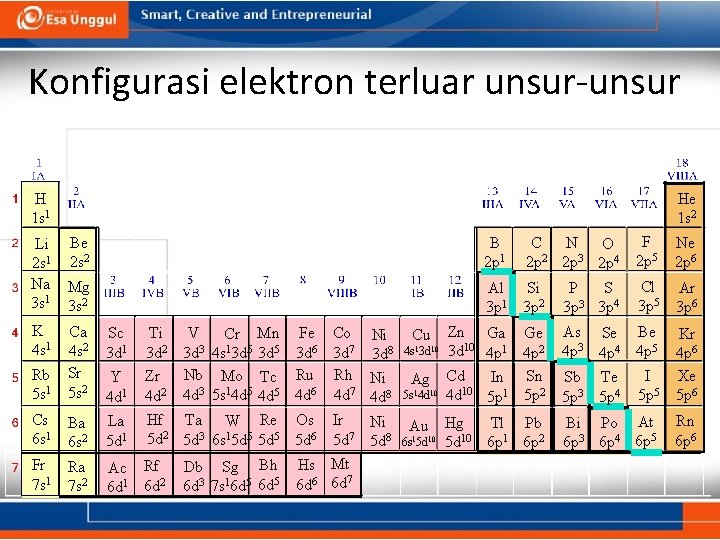
Konfigurasi elektron terluar unsur-unsur H 1 s 1 He 1 s 2 Li Be 2 s 1 2 s 2 Na Mg 3 s 1 3 s 2 K 4 s 1 Sc 3 d 1 Rb 5 s 1 Ca 4 s 2 Sr 5 s 2 Y 4 d 1 V Ti Cr Mn Fe Co 3 d 2 3 d 3 4 s 13 d 5 3 d 6 3 d 7 Zr Nb Mo Tc Ru Rh 4 d 2 4 d 3 5 s 14 d 5 4 d 6 4 d 7 Cs 6 s 1 Ba 6 s 2 La 5 d 1 Hf Ta W Re Os 5 d 2 5 d 3 6 s 15 d 5 5 d 6 Fr 7 s 1 Ra 7 s 2 Ac Rf 6 d 1 6 d 2 Db Sg Bh 6 d 3 7 s 16 d 5 Ni 3 d 8 Ni 4 d 8 Ir Ni 7 5 d 5 d 8 Hs Mt 6 d 6 6 d 7 Cu 4 s 13 d 10 Ag 5 s 14 d 10 Au 6 s 15 d 10 B 2 p 1 • C B N O 1 2 3 • 2 p 2 p 4 F 2 p 5 Ne 2 p 6 Al 3 p 1 Si 3 p 2 S P 3 3 p 3 p 4 Cl 3 p 5 Ar 3 p 6 Zn Ga Ge 3 d 10 4 p 1 4 p 2 Cd In Sn 10 4 d 5 p 1 5 p 2 As Se 4 p 3 4 p 4 Be 4 p 5 Sb Te 5 p 3 5 p 4 I 5 p 5 Kr 4 p 6 Xe 5 p 6 Hg Tl Pb 5 d 10 6 p 1 6 p 2 Bi Po At 6 p 3 6 p 4 6 p 5 Rn 6 p 6

1. Perilaku oksidasi-reduksi unsur • Tabel periodik dapat mengklasifikasikan sifat oksidasi-reduksi unsur. Logam Mataloid Alkali, alkali tanah, transisi Unsur-unsur ini cenderung Unsur-unsur ini dapat menyumbangkan elektronnya menerima dan (teroksidasi) dan membentuk menumbangkan elektronnya kation Nonmetal Gas mulia, halogen, kalkogen Unsur-unsur ini cenderung menerima elektron (tereduksi) dan membentuk anion

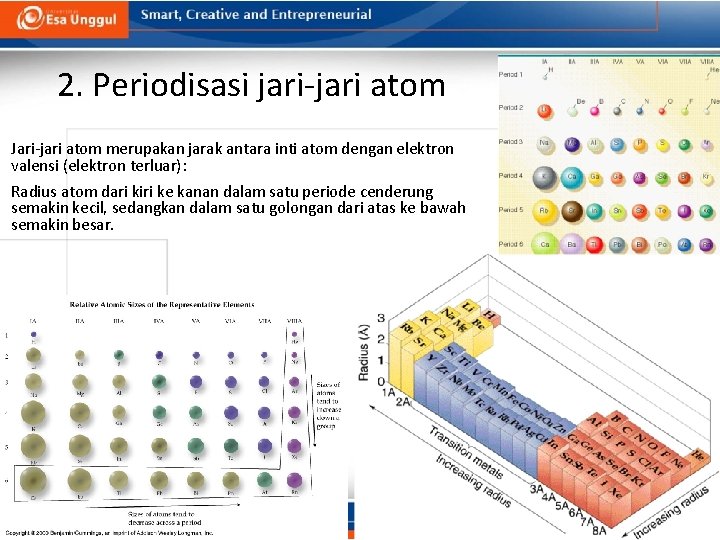
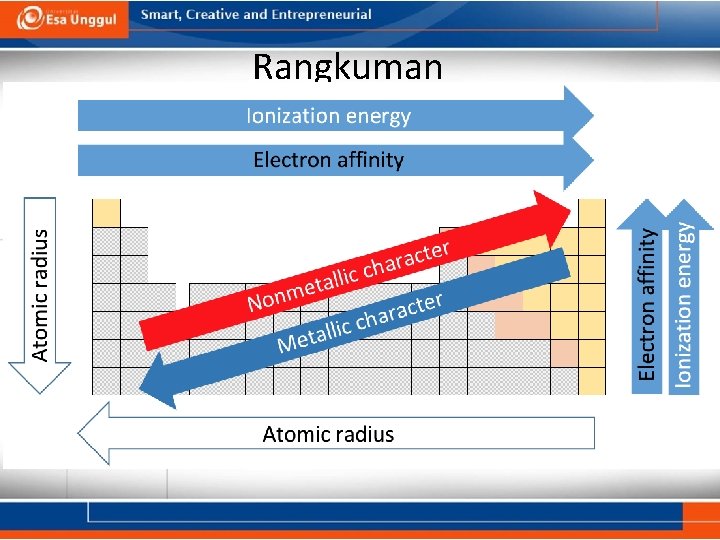
2. Periodisasi jari-jari atom Jari-jari atom merupakan jarak antara inti atom dengan elektron valensi (elektron terluar): Radius atom dari kiri ke kanan dalam satu periode cenderung semakin kecil, sedangkan dalam satu golongan dari atas ke bawah semakin besar.

3. Periodisasi Energi Ionisasi Energi ionisasi merupakan energi yang dibutuhkan untuk melepaskan satu elektron valensi dari satu atom gas. Dari kiri ke kanan, dalam satu periode, energi ionisasi semakin besar, sedangkan dari atas ke bawah dalam satu golongan semakin kecil.

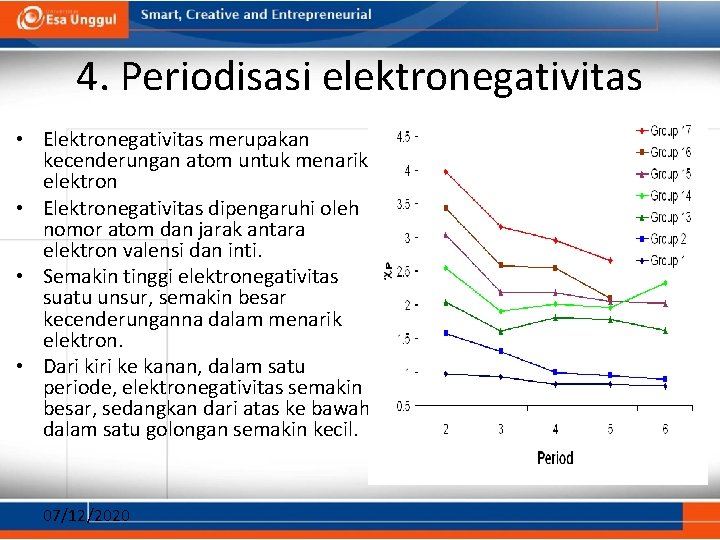
4. Periodisasi elektronegativitas • Elektronegativitas merupakan kecenderungan atom untuk menarik elektron • Elektronegativitas dipengaruhi oleh nomor atom dan jarak antara elektron valensi dan inti. • Semakin tinggi elektronegativitas suatu unsur, semakin besar kecenderunganna dalam menarik elektron. • Dari kiri ke kanan, dalam satu periode, elektronegativitas semakin besar, sedangkan dari atas ke bawah dalam satu golongan semakin kecil. 07/12/2020

5. Periodisasi Afinitas Elektron Afinitas elektron adalah energi yang dilepaskan ketika satu elektron ditambahkan ke kulit terluar suatu atom gas. Dalam satu periode, dari kiri ke kanan, afinitas elektron semakin besar, sedangkan dari atas ke baah dalam satu golongan, afinitas elektron semakin kecil.

6. Karakter Logam • Semakin kecil nilai energi ionisasi, elektronegativitas, dan afinitas elektron suatu unsur, semakin besar karakter logam unsur tersebut, dan sebaliknya. • Dalam satu periode, dari kiri ke kanan, karakter logam semakin kecil, sedangkan dari atas ke bawah dalam satu golongan, karakter logam semakin besar.

Perdebatan dan kontroversi 1. 2. 3. 4. 5. 6. 7. Posisi hidrogen dan helium dalam tabel periodik Golongan 3 dan unsur-unsurnya di periode 6 an 7 – Lantanum dan aktinium – Lutetium dan lawrencium – Lantanida dan aktinida Golongan yang termasuk dalam unsur transisi Unsur dengan sifat kimia yang belum diketahui Pemanjangan tabel periodik lebih lanjut (penambahan periode ke 8) Unsur dengan nomor atom tertinggi – Model Bohr (max 137) – Persamaan relativitas Dirac (max 173) Bentuk Tabel periodk yang optimum 07/12/2020

Rangkuman

Rangkuman Tabel periodik: susunan berkala unsur-unsur berdasarkan (jumlah proton), konfigurasi elektron, dan perulangan sifat kimianya. Jenis unsur: logam, metaloid, nonlogam pengelompokan: unsur gologan utama, transisi, dan lantanida/aktinida Golongan: unsur-unsur yang berada dalam satu kolom (golongan) memiliki sifat yang sama karena memiliki elektron valensi yang sama. Alkali, Alkali tanah, kalkogen, halogen, gas mulia Periode: unsur yang berada dalam satu baris.
 Mengapa susunan unsur unsur diberi sisipan kata periodik
Mengapa susunan unsur unsur diberi sisipan kata periodik Ppt sifat periodik unsur
Ppt sifat periodik unsur Sifat oksidator terkuat
Sifat oksidator terkuat Pengertian sistem dalam akuntansi
Pengertian sistem dalam akuntansi Unsur-unsur sistem pendidikan
Unsur-unsur sistem pendidikan Antoine lavoiseir
Antoine lavoiseir Jari jari atom
Jari jari atom Contoh jurnal khusus retur pembelian
Contoh jurnal khusus retur pembelian Prisma
Prisma Unsur unsur nada akor
Unsur unsur nada akor Unsur-unsur balok
Unsur-unsur balok Isobar
Isobar Unsur pembantu pimpinan terdiri dari
Unsur pembantu pimpinan terdiri dari Pengertian kerjasama tim
Pengertian kerjasama tim Unsur unsur dalam koperasi
Unsur unsur dalam koperasi Unsur-unsur penunjang kesehatan rohani di tempat kerja
Unsur-unsur penunjang kesehatan rohani di tempat kerja Unsur-unsur penunjang
Unsur-unsur penunjang Manajemen puncak
Manajemen puncak Unsur-unsur prisma segi enam
Unsur-unsur prisma segi enam Identifikasi ciri-ciri pertanian rakyat
Identifikasi ciri-ciri pertanian rakyat Parameter identitas nasional
Parameter identitas nasional Unsur-unsur proposal kegiatan
Unsur-unsur proposal kegiatan Unsur unsur manajemen keperawatan
Unsur unsur manajemen keperawatan Unsur-unsur trigatra
Unsur-unsur trigatra Unsur unsur temuan kekurangan
Unsur unsur temuan kekurangan Nilai angka kredit menjadi anggota pgri
Nilai angka kredit menjadi anggota pgri Teks drama adalah
Teks drama adalah Unsur unsur hukum perburuhan
Unsur unsur hukum perburuhan Sebutkan unsur unsur dasar bangun datar dan bangun ruang
Sebutkan unsur unsur dasar bangun datar dan bangun ruang 5 m dalam manajemen
5 m dalam manajemen