Simon LE HELLO Syndromes myloprolifratifs 1 La Moelle















- Slides: 24

Simon LE HELLO Syndromes myéloprolifératifs 1

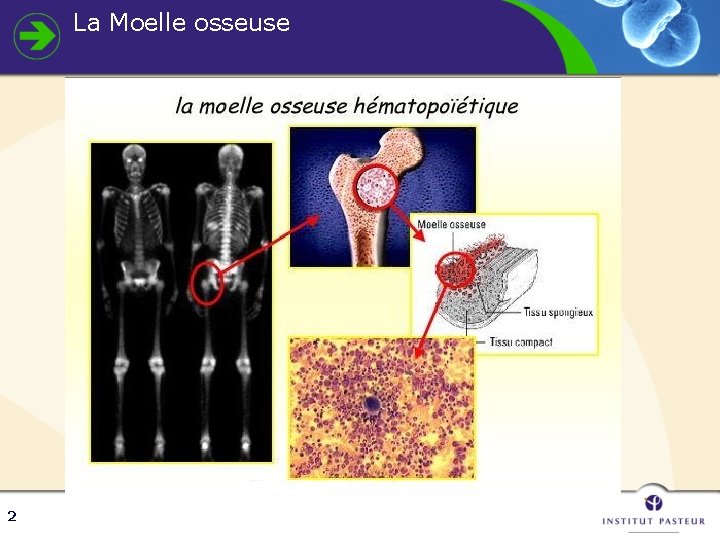
La Moelle osseuse 2

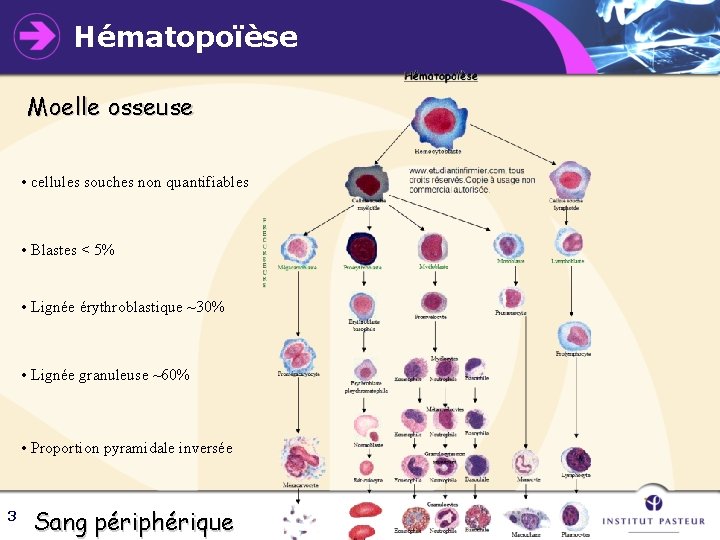
Hématopoïèse Moelle osseuse • cellules souches non quantifiables • Blastes < 5% • Lignée érythroblastique ~30% • Lignée granuleuse ~60% • Proportion pyramidale inversée 3 Sang périphérique

Classification des syndromes myéloprolifératifs 5 entités physiopathologiques (selon polycythemia Vera Study Group) =Processus monoclonal d’un progéniteur pluripotent • Leucémie Myéloïde Chronique • Splénomégalie myéloïde ou myélofibrose primitive • Thrombocythémie essentielle • Maladie de Vaquez • Leucémie myelo-monocytaire chronique Diagnostic différentiel • Syndrome lymphoprolifératif (LLC) • Leucémie aigüe (> 30% de blastes) 4

Leucémie Myéloïde Chronique « de Philadelphie à Nouméa » La leucémie myéloïde chronique (LMC) est une prolifération myéloïde monoclonale sans blocage de maturation prédominant sur la lignée granuleuse au niveau médullaire et splénique. • Fréquence -7 à 20% de toutes leucémies (22% en NC en 2005) - incidence de 1 à 2 / 100 000 hab/an (2 en NC en 2005) - tous les ages, surtout l'adulte entre 30 et 50 ans -favorisée par l'exposition au benzène et aux rayons ionisants. 5

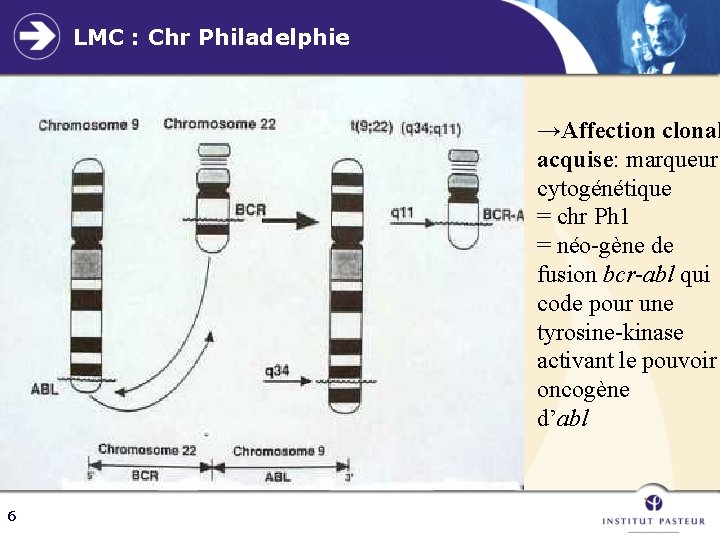
LMC : Chr Philadelphie →Affection clonal acquise: marqueur cytogénétique = chr Ph 1 = néo-gène de fusion bcr-abl qui code pour une tyrosine-kinase activant le pouvoir oncogène d’abl 6

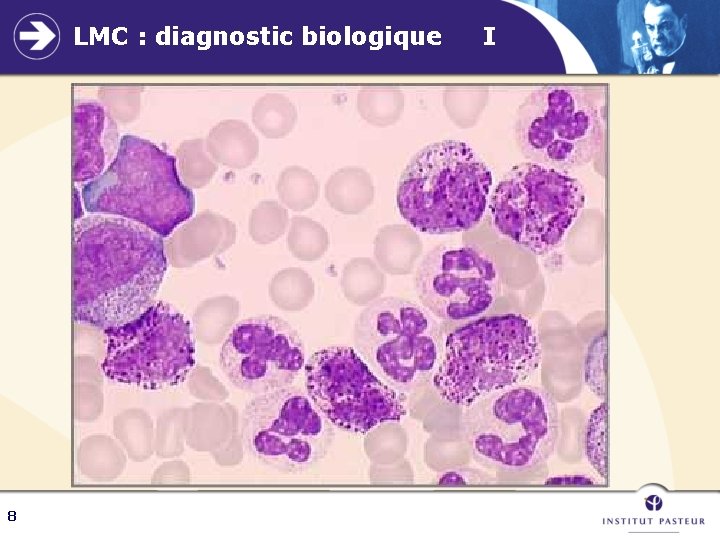
LMC : diagnostic biologique I a - NFS caractéristique +++ : → Hyperleucocytose > 100 000/mm 3 à 1 M/mm 3 neutrophiles (30 à 40 %) basophilie ++ et éosinophilie myélémie (30 à 50 %) composée de tous les stades de maturation granuleuse métamyélocytes > promyélocytes > rares blastes sans hiatus de maturation +++ →Autres lignées sanguines Anémie modérée Plaquettes normales ou élevées (si abaissées, craindre une acutisation) 7

LMC : diagnostic biologique 8 I

LMC : diagnostic biologique II b - Myélogramme : Le myélogramme est identique au frottis sanguin : une hyperplasie granuleuse (80 -90 %) maturation normale éosinophilie et basophilie médullaire inutile au diagnostic, n'est réalisé que pour faire une cytogénétique médullaire 9

LMC : diagnostic biologique III c - Cytogénétique : le chromosome philadelphie : - quasi-totalité des patients (95%) - non spécifique + LAL Ph+ - recherche effectuée sur la moelle - Suivi de la réponse thérapeutique d – Autres examens biologiques - BOM (richesse médullaire ++) - PAL effondrées t translocation t(9, 22) (q 34, q 11) 10

LMC : diagnostic clinique I ü Circonstances révélatrices : début insidieux +++++ adulte jeune (âge moyen 45 ans) signes peu caractéristiques : asthénie, amaigrissement, grosse rate →NFS de routine 11

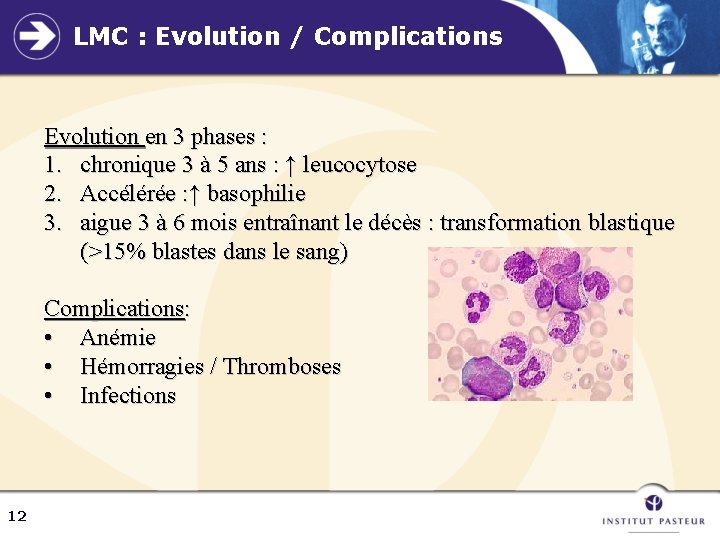
LMC : Evolution / Complications Evolution en 3 phases : 1. chronique 3 à 5 ans : ↑ leucocytose 2. Accélérée : ↑ basophilie 3. aigue 3 à 6 mois entraînant le décès : transformation blastique (>15% blastes dans le sang) Complications: • Anémie • Hémorragies / Thromboses • Infections 12

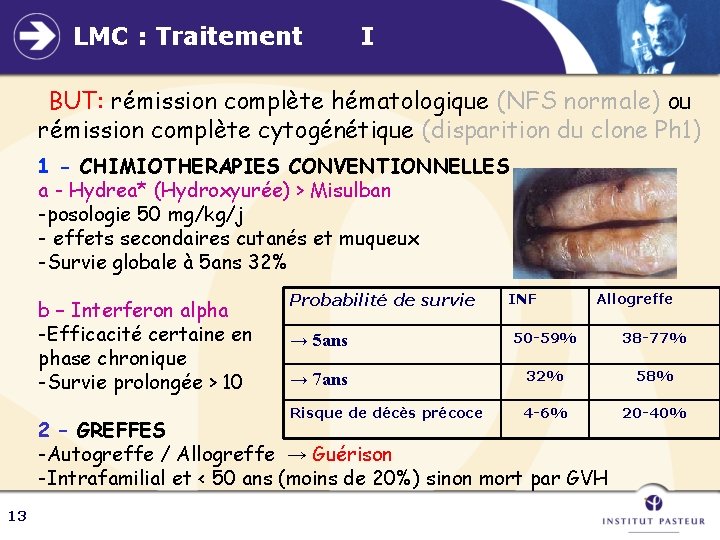
LMC : Traitement I BUT: rémission complète hématologique (NFS normale) ou rémission complète cytogénétique (disparition du clone Ph 1) 1 - CHIMIOTHERAPIES CONVENTIONNELLES a - Hydrea* (Hydroxyurée) > Misulban -posologie 50 mg/kg/j - effets secondaires cutanés et muqueux -Survie globale à 5 ans 32% b – Interferon alpha -Efficacité certaine en phase chronique -Survie prolongée > 10 Probabilité de survie INF Allogreffe → 5 ans 50 -59% 38 -77% → 7 ans 32% 58% Risque de décès précoce 4 -6% 20 -40% 2 – GREFFES -Autogreffe / Allogreffe → Guérison -Intrafamilial et < 50 ans (moins de 20%) sinon mort par GVH 13

LMC : Traitement II 3 – NOUVEAUX TRAITEMENTS : Inhibiteurs de Bcr-Abl STI 571 ou Imatinib GLIVEC® -inhibiteur spécifique de la tyrosine kinase bcr-abl -posologie 400 mg/j en phase chronique -Dans tous les cas et immédiatement -Effets indésirables rares -95% de RCH et 87% de RCC même sur les formes acutisées Espoir mais maladie résiduelle ØDurée de la réponse? Ø 10% de résistance 14 ØToxicité au long cours?

L’ Histoire de Glivec… 15 • 1960 : Identification d’une mutation génétique chez les patients atteints de LMC. • Dans les années 80 : Un lien est établit entre le chromosome Philadelphie et la Tyrosine kinase. • 1990 : Découverte des inhibiteurs de Bcr-Abl. Sélection de la molécule mère parmi les inhibiteurs de la PKC. • 1992 : 1 er lot de Glivec synthétisé. • 1996 : Activité démontrée dans des cellules modifiées Bcr-Abl chez des souris syngénéiques. • Juin 1996 : 1 er patient atteint de LMC traité. • Juin 1999 : Début des essais de phase II. • Juin 2000 : Début des essais de phase III. • Mai 2001 : Approbation pour la LMC par la FDA. • Août 2002 : FDA accorde le statut d’examen prioritaire à Glivec en tant que traitement de 1ère intention de la LMC à un stade précoce.

Autres syndromes myéloprolifératifs Diagnostic différentiel A - Les myélémies réactionnelles : • infections sévères • nécroses tissulaires et hémolyses • régénérations médullaires post-saignement, post aplasie • cancers métastatiques • traitement : corticoïdes, adrénaline B - Les hyperleucocytoses sans myélémie liée au tabac : modérée : 15 - 20000/mm 3 C - Les autres syndromes myéloprolifératifs • Maladie de Vaquez • Thrombocythémie essentielle • Splémomégalie myéloïde • Leucémie myélo-monocytaire chronique 16

Maladie de Vaquez La Polyglobulie primitive ou maladie de Vaquez est caractérisée par une prolifération non contrôlée de l’ens des lignées myéloïdes mais surtout de la lignée érythroblastique. Son évolution chronique aboutit à une masse sanguine élevée, dominée par le risque de thromboses et l’évolution terminale vers la fibrose médullaire ou la leucémie aigüe. Le pronostic est sombre en 18 mois si non traité mais 12 ans si traité Diagnostic biologique • Évoqué sur la NFS : hématie > 6 M/μl, hématocrite >55% et hémoglobine entre 18 et 25 g/dl • Confirmation par le VGT / hématies marquées au Cr 51 Traitement • Saignée ou P 32 ou chimiothérapie 17

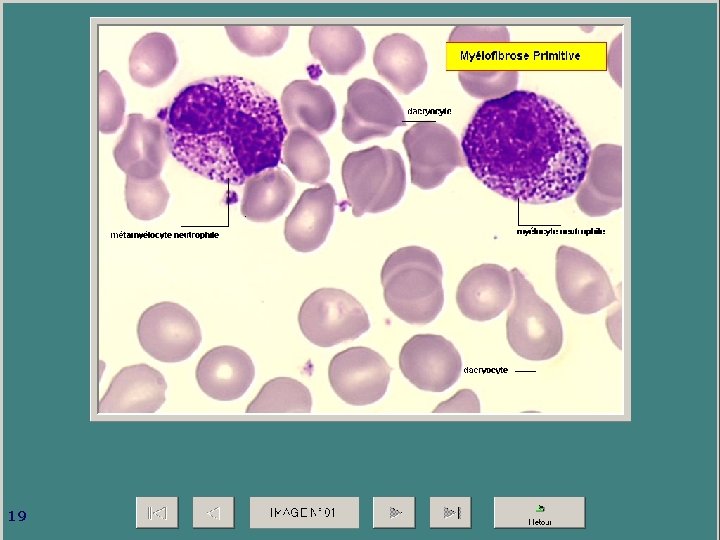
Splénomégalie myéloïde ou myélofibrose primitive C’est une maladie nettement plus rare que la LMC mais proche avec myélofibrose, survient habituellement après 50 ans. Splénomégalie est le signe majeur avec une rate très volumineuse+++ NFS : érythromyélèmie et dacryocytes+++ BM = myélofibrose et des mégacaryocytes dystrophiques L’évolution est variable de 1 à 15 ans avec transformation en LA (25%) ou pancytopénie Le traitement : Aucun 18

19

Thrombocythémie essentielle (TE) Excès chronique du nombre des plaquettes >1000 G/L par atteinte monoclonale de la cellule souche mégacaryocytaire, avec une prépondérance chez la femme. NFS : Hyperplaquettose le plus souvent entre 2000 et 5000 G/L. Hyperleucocytose entre 15 et 40 G/L Moelle : hyperplasie mégacaryocytaire dystrophique Complications : Hémorragies/ Thromboses +++ (URGENT) Evolution : survie entre 15 -20 ans max puis transformation en LA Traitement myélosuppressif systématique 20

Leucémie myelomonocytaire Chronique Double prolifération granulocytaire et monocytaire survenant chez des personnes âgées, d’évolution lentement progressive. Ce syndrome représente 2% des hémopathies. NFS : Monocytose sanguine (>1000 G/L de promonocytes) et discrète myélémie. Moelle : hyperplasie myéloïde + infiltration monocytaire (10 -15%) Evolution lente voire stable sans traitement chez des sujets âgés 21

CAS CLINIQUE 1 Homme de 57 ans consulte pour des douleurs épigastiques. A l’auscultation, découverte d’une volumineuse splénomégalie isolée NFP : Hb =13 g/d. L / plaquettes= 312 G/L / GB= 58 G/L Formule : PNN 70%, myélémie 20%, basophile 6% Myelogramme : moëlle riche avec prédominance de la lignée blanche sans excès de formes immatures. Cytogétique : Chr Ph 1 positive LMC 22

CAS CLINIQUE 2 Femme de 69 ans a des douleurs osseuses. Numération avec hyperleucocytose sans splénomégalie et sans signe infectieux. NFP : Hb =13 g/d. L / plaquettes= 440 G/L / GB= 19, 9 G/L Formule : PNN 56%, lympho 20%, mono 23% Myelogramme : moëlle riche sans excès de blastes, lignées neutophiles 64%, erythroblastique 15% et monocyte 15% LMMC 23

CAS CLINIQUE 3 24
 Informal greetings and responses
Informal greetings and responses Hello. what _________ your name?
Hello. what _________ your name? Hello hello hello how are you
Hello hello hello how are you Anesthésie générale
Anesthésie générale La moelle épinière
La moelle épinière Glomerulus cerebellaris
Glomerulus cerebellaris What is geriatric syndromes
What is geriatric syndromes Cerebellar syndromes
Cerebellar syndromes Neuroendocrine syndrome in gynecology
Neuroendocrine syndrome in gynecology Differential diagnosis of stroke
Differential diagnosis of stroke Neuroendocrine disorders in gynecology
Neuroendocrine disorders in gynecology Chromosome philadelphie
Chromosome philadelphie Small head fat body
Small head fat body Hellopt
Hellopt Hope you are doing well
Hope you are doing well Hello hello to everyone it's english time
Hello hello to everyone it's english time I am peter pan
I am peter pan Hello the sun is shining
Hello the sun is shining Birchfield nursery
Birchfield nursery Hello hello 1 2 3
Hello hello 1 2 3 Tom hello good morning hello good
Tom hello good morning hello good Im muzzy
Im muzzy Hello my friend friend of a friend
Hello my friend friend of a friend The clown punk simon armitage
The clown punk simon armitage Simon lelieveldt
Simon lelieveldt