Sehr geehrte Chemielehrerinnen und Chemielehrer die folgende Prsentation


- Slides: 22

Sehr geehrte Chemielehrerinnen und Chemielehrer, die folgende Präsentation stellt mögliche Lernschrittfolgen zur Unterrichtsstunde im Themenbereich „Stoffe und ihre Eigenschaften“ dar. Die Seiten sind stets so angelegt, dass sie einen möglichen Unterrichtsverlauf unterstützen. Passen Sie den Inhalt einfach nach Ihren Wünschen an. Alle Videos, interaktiven Aufgaben und Animationen sind direkt verlinkt. Zum Start eines Videos oder einer Animation klicken Sie auf das nebenstehende Symbol. Zu den Aufgaben gelangen Sie durch einen Klick auf das entsprechende Bild zur Aufgabe. Wichtig: Für die verlinkten Medien auf der Webseite „https: //www. fit-in-chemie. de“ ist die Eingabe eines Passworts erforderlich. Dieses finden Sie in Ihrem Anschreiben oder auf der letzten Seite des Buches „Fit in Chemie“. Alternativ können Sie auch das Passwort Ihres digitalen e. Books verwenden. Im Notizbereich einer Folie finden Sie gegebenenfalls noch weitere Anmerkungen zur verwendeten Didaktik oder Methodik. Wir wünschen Ihnen viel Freude und einen positiven Unterrichtserfolg beim Arbeiten mit den angefügten Materialien. Ihr Rothbaum Verlag © Rothbaum Verlag Fit in Chemie 9 I, Kapitel 1

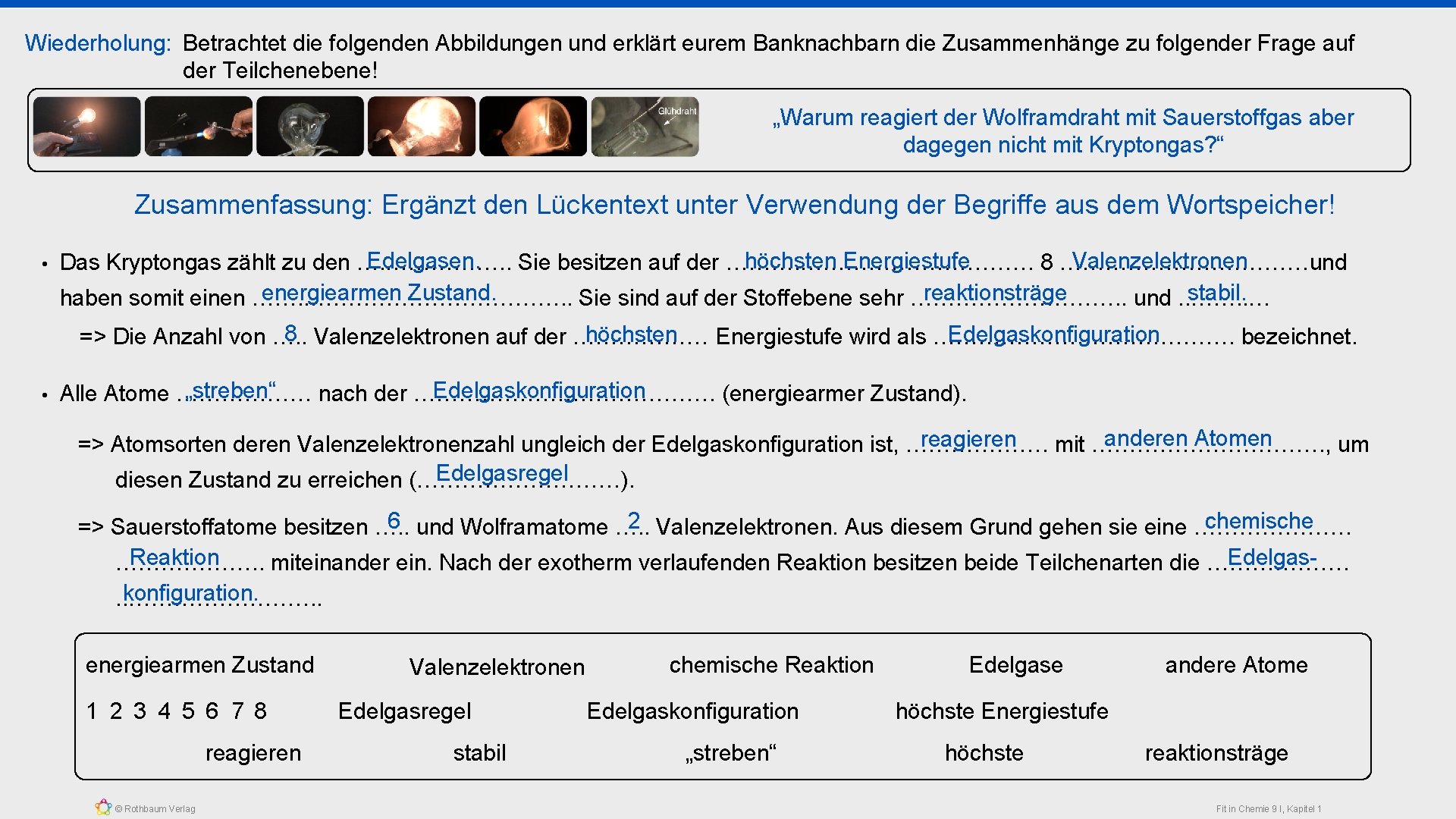
Wiederholung: Betrachtet die folgenden Abbildungen und erklärt eurem Banknachbarn die Zusammenhänge zu folgender Frage auf der Teilchenebene! „Warum reagiert der Wolframdraht mit Sauerstoffgas aber dagegen nicht mit Kryptongas? “ Verwendet für eure Erklärungen die Begriffe aus dem Wortspeicher! 8 Valenzelektronen energiearmen Zustand Edelgasregel Edelgaskonfiguration Atome © Rothbaum Verlag Edelgase höchste Energiestufe „streben“ nach reaktionsträge stabil Fit in Chemie 9 I, Kapitel 1

Wiederholung: Betrachtet die folgenden Abbildungen und erklärt eurem Banknachbarn die Zusammenhänge zu folgender Frage auf der Teilchenebene! „Warum reagiert der Wolframdraht mit Sauerstoffgas aber dagegen nicht mit Kryptongas? “ Zusammenfassung: Ergänzt den Lückentext unter Verwendung der Begriffe aus dem Wortspeicher! • Edelgasen. höchsten Energiestufe Valenzelektronen Das Kryptongas zählt zu den …. ……………. . Sie besitzen auf der ……………. 8 ………………und reaktionsträge stabil. energiearmen Zustand. haben somit einen ……. . ………………. . Sie sind auf der Stoffebene sehr ……………. . und. . ……. . … 8 Valenzelektronen auf der ……………… Edelgaskonfiguration höchsten => Die Anzahl von …. . Energiestufe wird als …………………. bezeichnet. • „streben“ Edelgaskonfiguration Alle Atome ……………… nach der …………………. (energiearmer Zustand). anderen Atomen reagieren => Atomsorten deren Valenzelektronenzahl ungleich der Edelgaskonfiguration ist, ………………. mit ……………. , um Edelgasregel diesen Zustand zu erreichen (……………). 6 und Wolframatome …. . chemische 2 Valenzelektronen. Aus diesem Grund gehen sie eine ………………… => Sauerstoffatome besitzen …. . Reaktion Edelgas………………. . miteinander ein. Nach der exotherm verlaufenden Reaktion besitzen beide Teilchenarten die ………………. konfiguration. . . …………. . energiearmen Zustand 1 2 3 4 5 6 7 8 reagieren © Rothbaum Verlag Valenzelektronen Edelgasregel stabil chemische Reaktion Edelgaskonfiguration „streben“ Edelgase andere Atome höchste Energiestufe höchste reaktionsträge Fit in Chemie 9 I, Kapitel 1

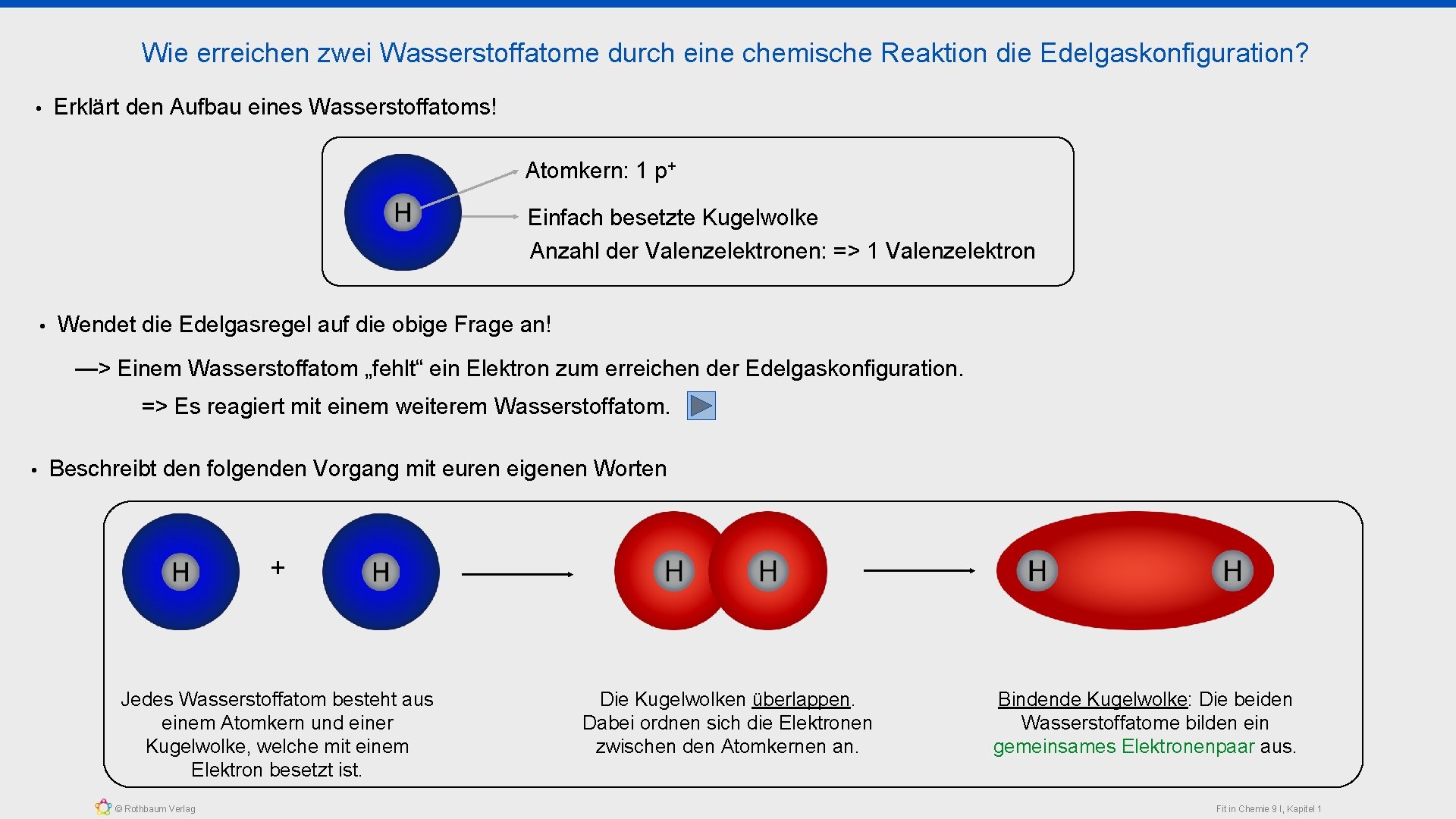
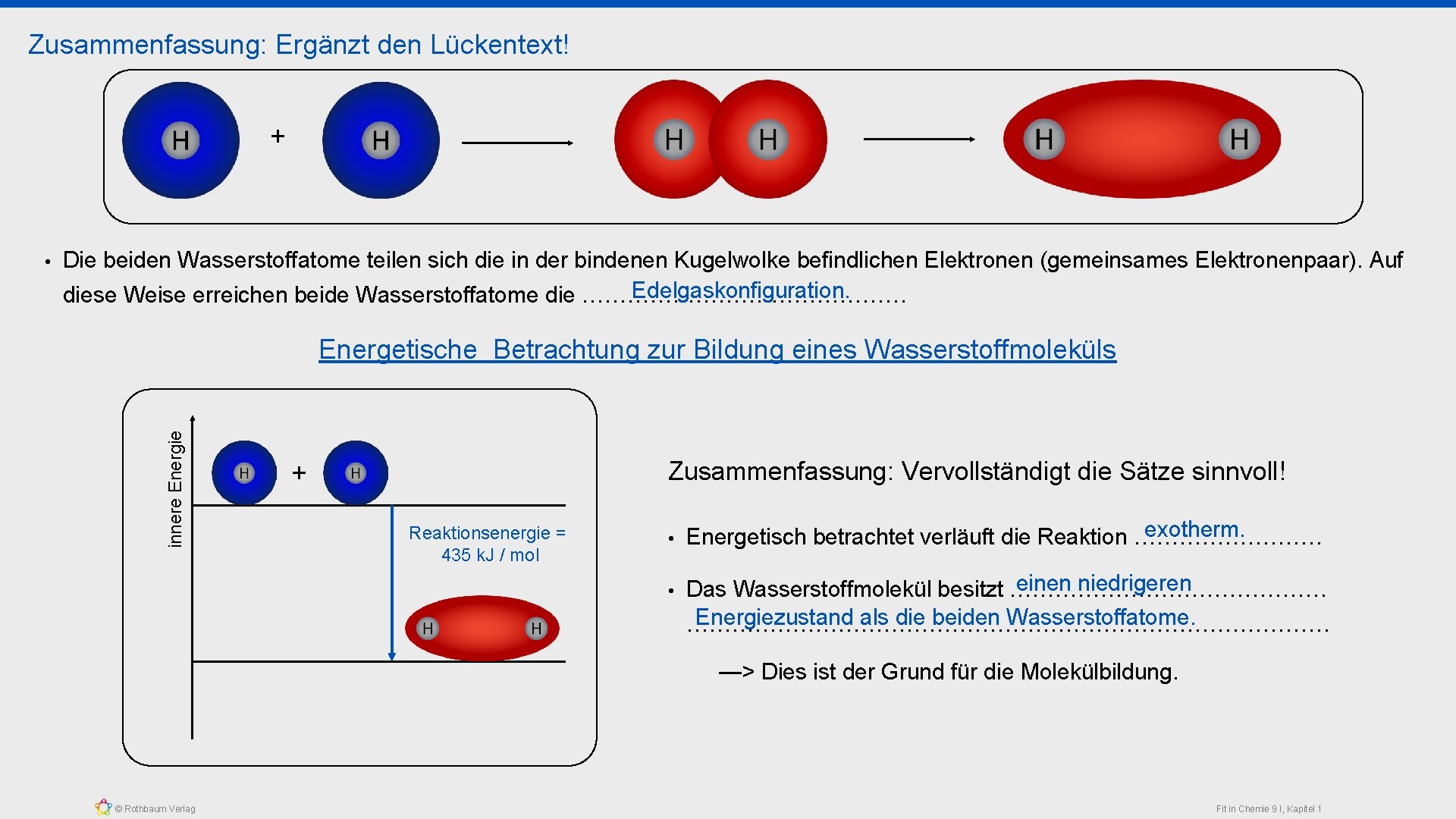
Wie erreichen zwei Wasserstoffatome durch eine chemische Reaktion die Edelgaskonfiguration? • Erklärt den Aufbau eines Wasserstoffatoms! Atomkern: 1 p+ Einfach besetzte Kugelwolke Anzahl der Valenzelektronen: => 1 Valenzelektron • Wendet die Edelgasregel auf die obige Frage an! —> Einem Wasserstoffatom „fehlt“ ein Elektron zum erreichen der Edelgaskonfiguration. => Es reagiert mit einem weiterem Wasserstoffatom. • Beschreibt den folgenden Vorgang mit euren eigenen Worten + Jedes Wasserstoffatom besteht aus einem Atomkern und einer Kugelwolke, welche mit einem Elektron besetzt ist. © Rothbaum Verlag Die Kugelwolken überlappen. Dabei ordnen sich die Elektronen zwischen den Atomkernen an. Bindende Kugelwolke: Die beiden Wasserstoffatome bilden ein gemeinsames Elektronenpaar aus. Fit in Chemie 9 I, Kapitel 1

Zusammenfassung: Ergänzt den Lückentext! + Die beiden Wasserstoffatome teilen sich die in der bindenen Kugelwolke befindlichen Elektronen (gemeinsames Elektronenpaar). Auf Edelgaskonfiguration. diese Weise erreichen beide Wasserstoffatome die …………………. Energetische Betrachtung zur Bildung eines Wasserstoffmoleküls innere Energie • Zusammenfassung: Vervollständigt die Sätze sinnvoll! + Reaktionsenergie = 435 k. J / mol • • exotherm. Energetisch betrachtet verläuft die Reaktion …………. einen niedrigeren Das Wasserstoffmolekül besitzt ………………… Energiezustand als die beiden Wasserstoffatome. ……………………………………. —> Dies ist der Grund für die Molekülbildung. © Rothbaum Verlag Fit in Chemie 9 I, Kapitel 1

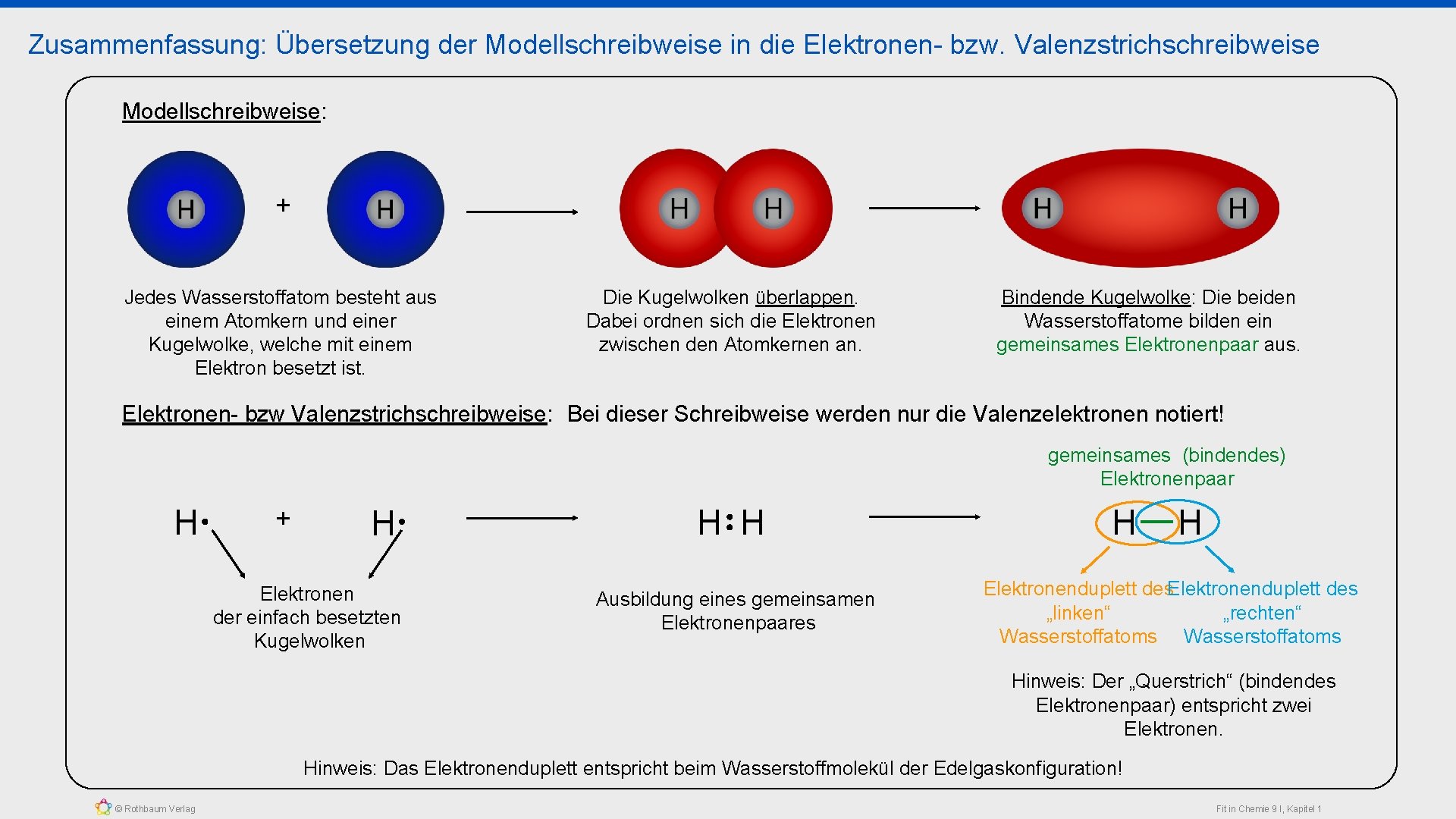
Zusammenfassung: Übersetzung der Modellschreibweise in die Elektronen- bzw. Valenzstrichschreibweise Modellschreibweise: + Jedes Wasserstoffatom besteht aus einem Atomkern und einer Kugelwolke, welche mit einem Elektron besetzt ist. Die Kugelwolken überlappen. Dabei ordnen sich die Elektronen zwischen den Atomkernen an. Bindende Kugelwolke: Die beiden Wasserstoffatome bilden ein gemeinsames Elektronenpaar aus. Elektronen- bzw Valenzstrichschreibweise: Bei dieser Schreibweise werden nur die Valenzelektronen notiert! gemeinsames (bindendes) Elektronenpaar H + H Elektronen der einfach besetzten Kugelwolken H H Ausbildung eines gemeinsamen Elektronenpaares H H Elektronenduplett des „linken“ „rechten“ Wasserstoffatoms Hinweis: Der „Querstrich“ (bindendes Elektronenpaar) entspricht zwei Elektronen. Hinweis: Das Elektronenduplett entspricht beim Wasserstoffmolekül der Edelgaskonfiguration! © Rothbaum Verlag Fit in Chemie 9 I, Kapitel 1

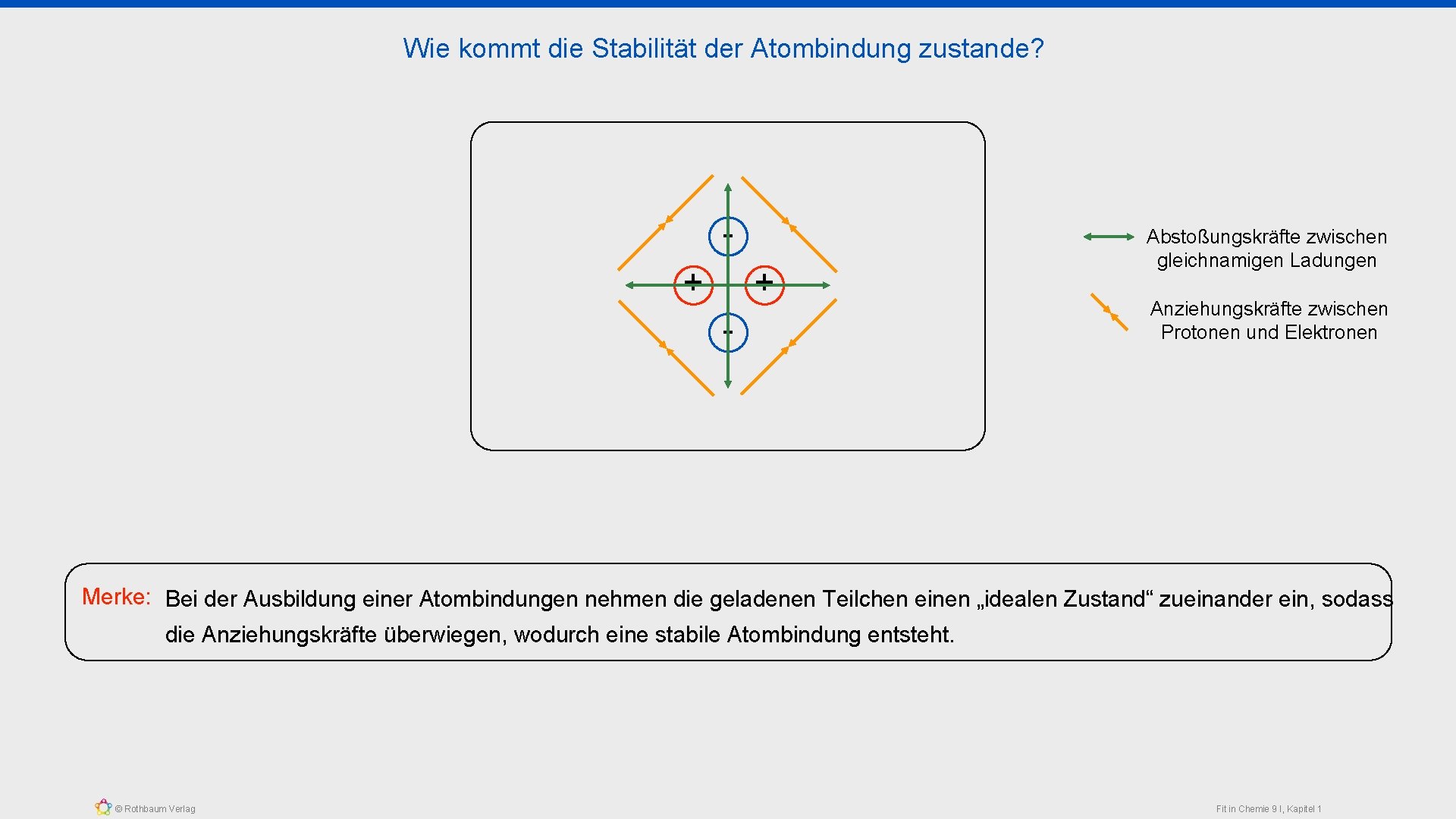
Wie kommt die Stabilität der Atombindung zustande? + + - Abstoßungskräfte zwischen gleichnamigen Ladungen Anziehungskräfte zwischen Protonen und Elektronen Merke: Bei der Ausbildung einer Atombindungen nehmen die geladenen Teilchen einen „idealen Zustand“ zueinander ein, sodass die Anziehungskräfte überwiegen, wodurch eine stabile Atombindung entsteht. © Rothbaum Verlag Fit in Chemie 9 I, Kapitel 1

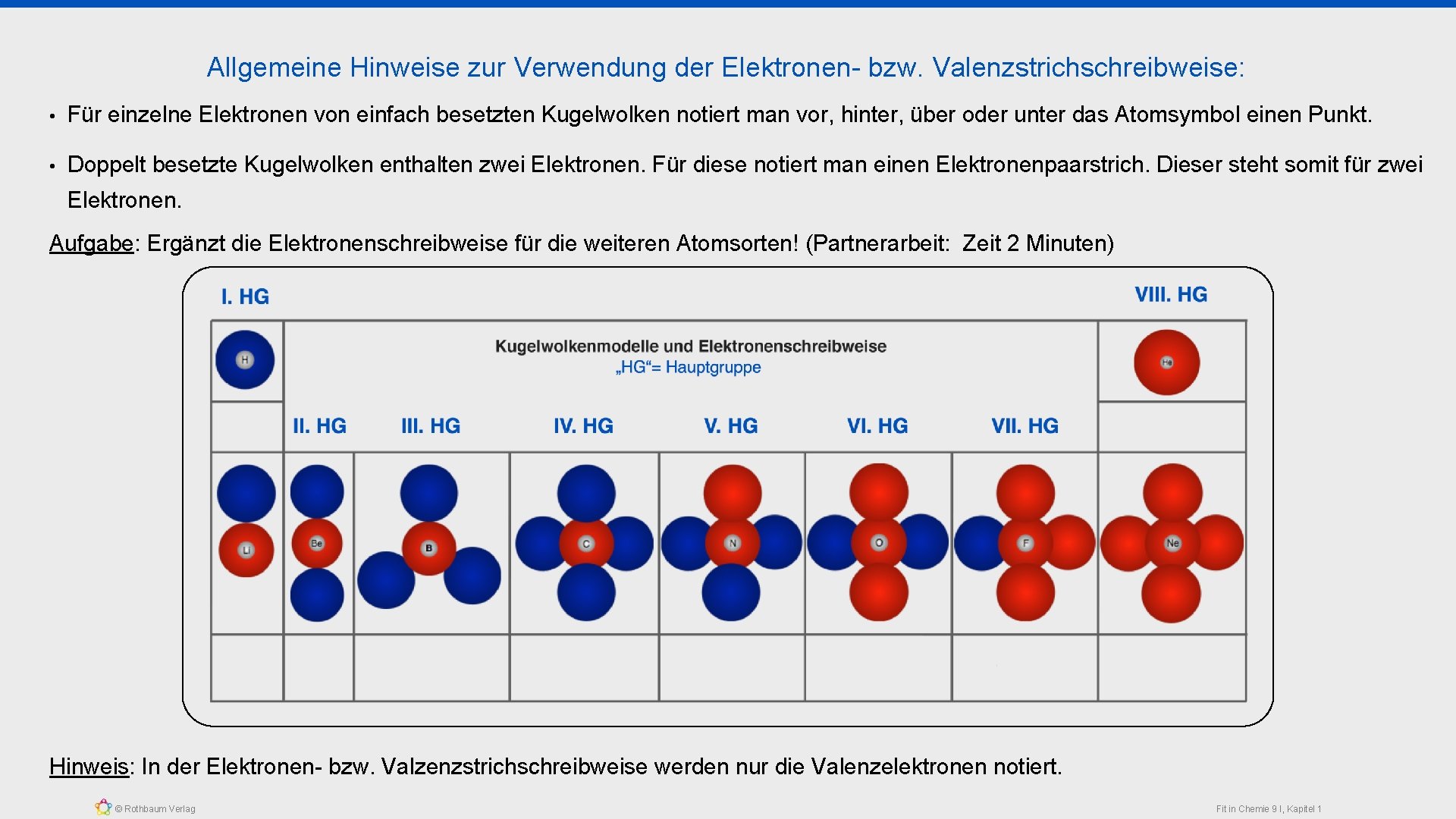
Allgemeine Hinweise zur Verwendung der Elektronen- bzw. Valenzstrichschreibweise: • Für einzelne Elektronen von einfach besetzten Kugelwolken notiert man vor, hinter, über oder unter das Atomsymbol einen Punkt. • Doppelt besetzte Kugelwolken enthalten zwei Elektronen. Für diese notiert man einen Elektronenpaarstrich. Dieser steht somit für zwei Elektronen. Aufgabe: Ergänzt die Elektronenschreibweise für die weiteren Atomsorten! (Partnerarbeit: Zeit 2 Minuten) Hinweis: In der Elektronen- bzw. Valzenzstrichschreibweise werden nur die Valenzelektronen notiert. © Rothbaum Verlag Fit in Chemie 9 I, Kapitel 1

© Rothbaum Verlag Fit in Chemie 9 I, Kapitel 1

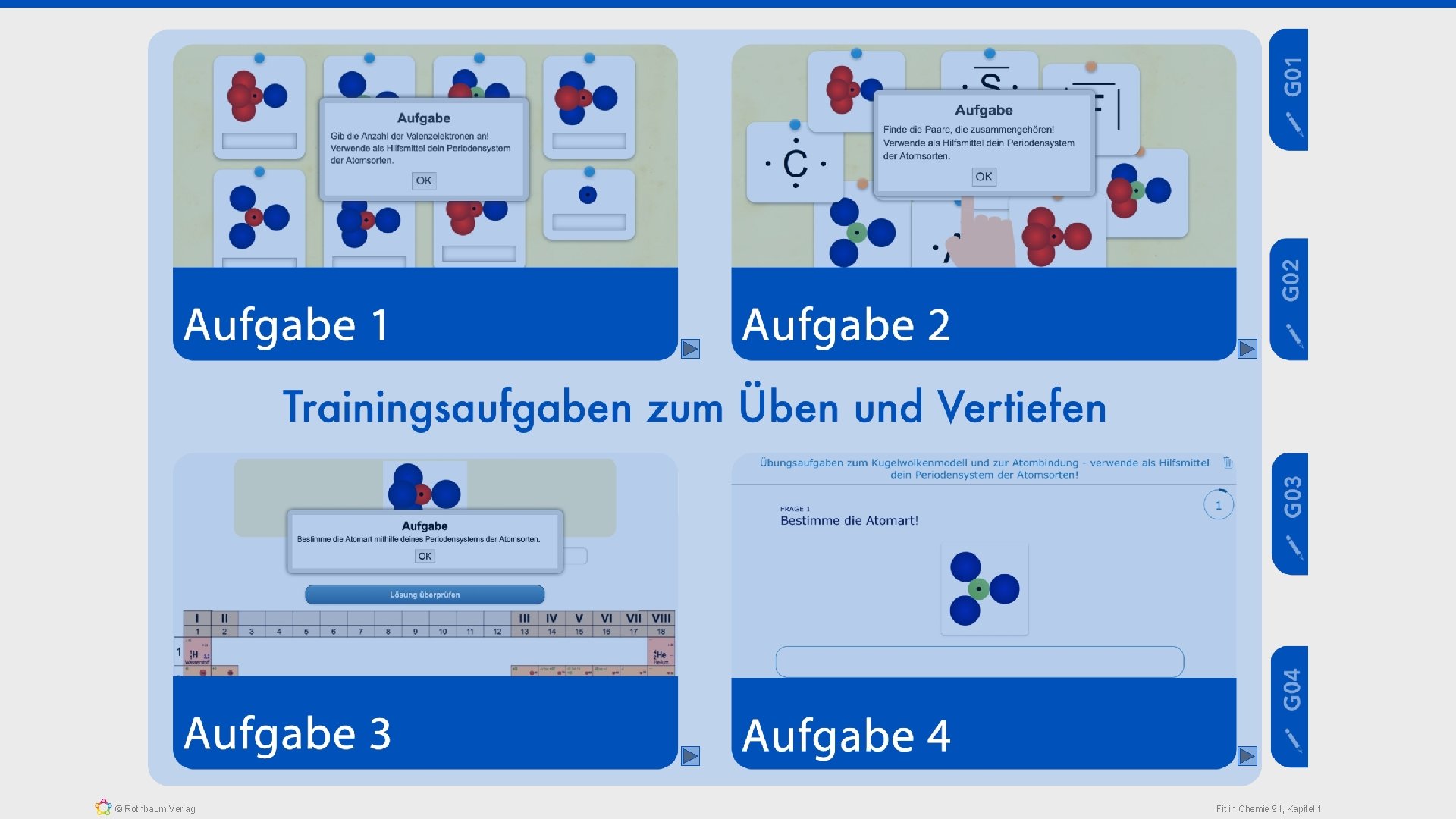
Partnerarbeit 1) Baut mithilfe der Kugelwolkenmodelle aus den entsprechenden Atomen die folgenden Moleküle! • Bildung eines Wasserstoffmonofluoridmoleküls aus einem Fluoratom und einem Wasserstoffatom • Bildung eines Fluormoleküls aus zwei Fluoratomen • Bildung eines Wassermoleküls aus einem Sauerstoffatom und zwei Wasserstoffatomen • Bildung eines Methanmoleküls aus einem Kohlenstoffatom und vier Wasserstoffatomen 2) Übersetzt die Kugelwolkenmodelle in die Elektronen- bzw. Valenzstrichschreibweise und notiert eure Ergebnisse auf ein Blatt Papier! Zeit: 20 Minuten © Rothbaum Verlag Fit in Chemie 9 I, Kapitel 1

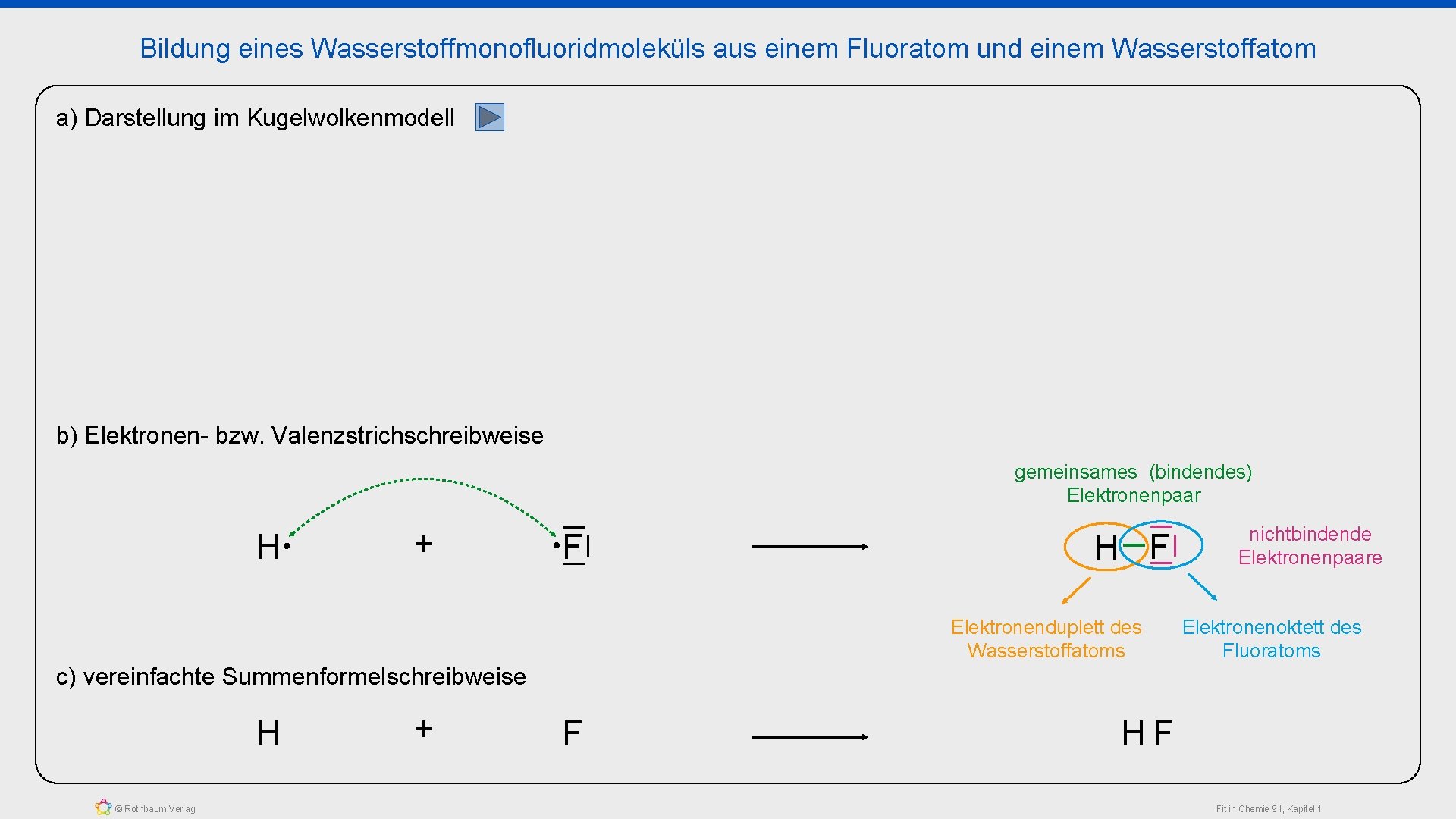
Bildung eines Wasserstoffmonofluoridmoleküls aus einem Fluoratom und einem Wasserstoffatom a) Darstellung im Kugelwolkenmodell b) Elektronen- bzw. Valenzstrichschreibweise gemeinsames (bindendes) Elektronenpaar H + F H F Elektronenduplett des Wasserstoffatoms nichtbindende Elektronenpaare Elektronenoktett des Fluoratoms c) vereinfachte Summenformelschreibweise H © Rothbaum Verlag + F HF Fit in Chemie 9 I, Kapitel 1

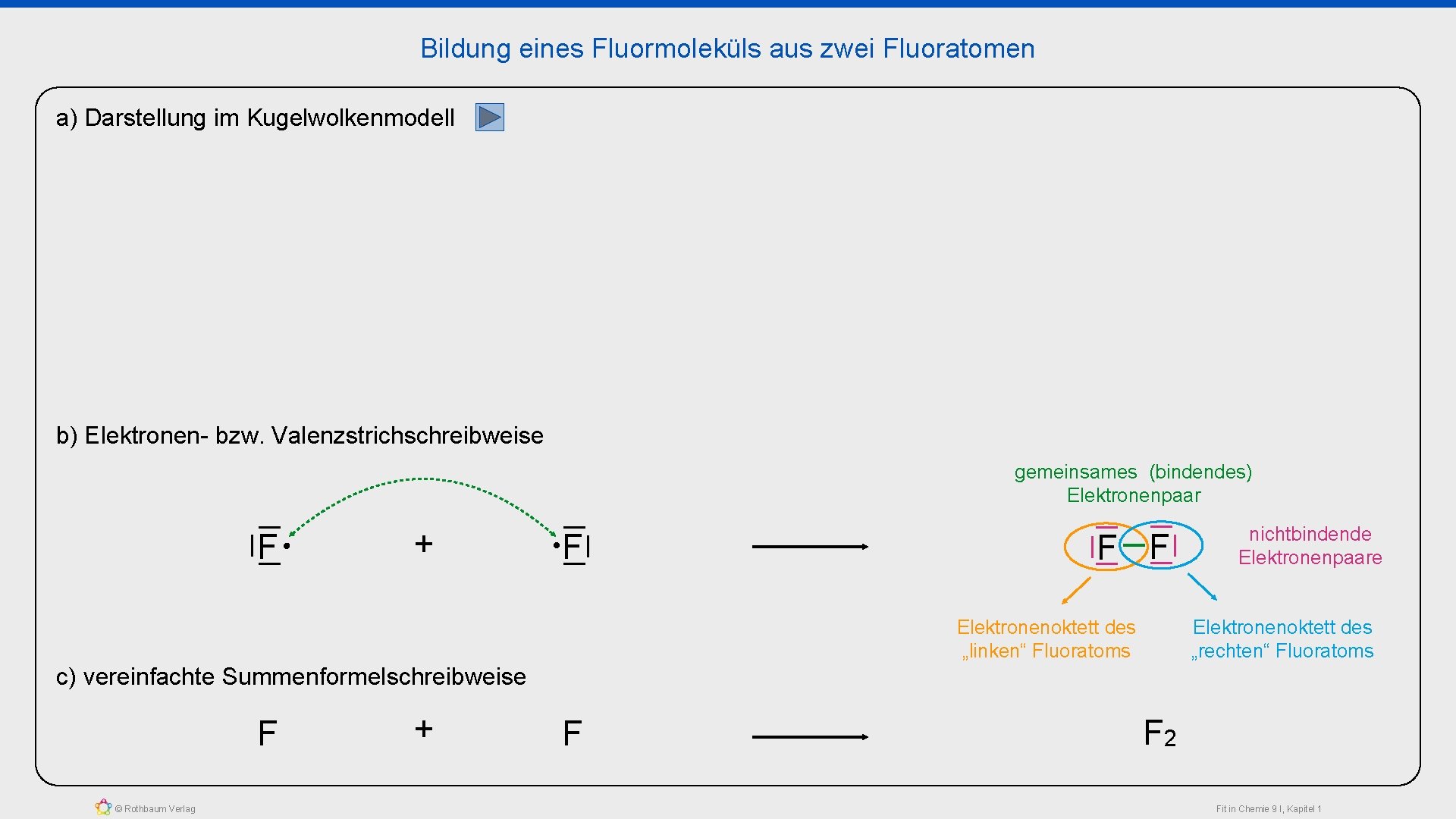
Bildung eines Fluormoleküls aus zwei Fluoratomen a) Darstellung im Kugelwolkenmodell b) Elektronen- bzw. Valenzstrichschreibweise gemeinsames (bindendes) Elektronenpaar F + F F F Elektronenoktett des „linken“ Fluoratoms nichtbindende Elektronenpaare Elektronenoktett des „rechten“ Fluoratoms c) vereinfachte Summenformelschreibweise F © Rothbaum Verlag + F F 2 Fit in Chemie 9 I, Kapitel 1

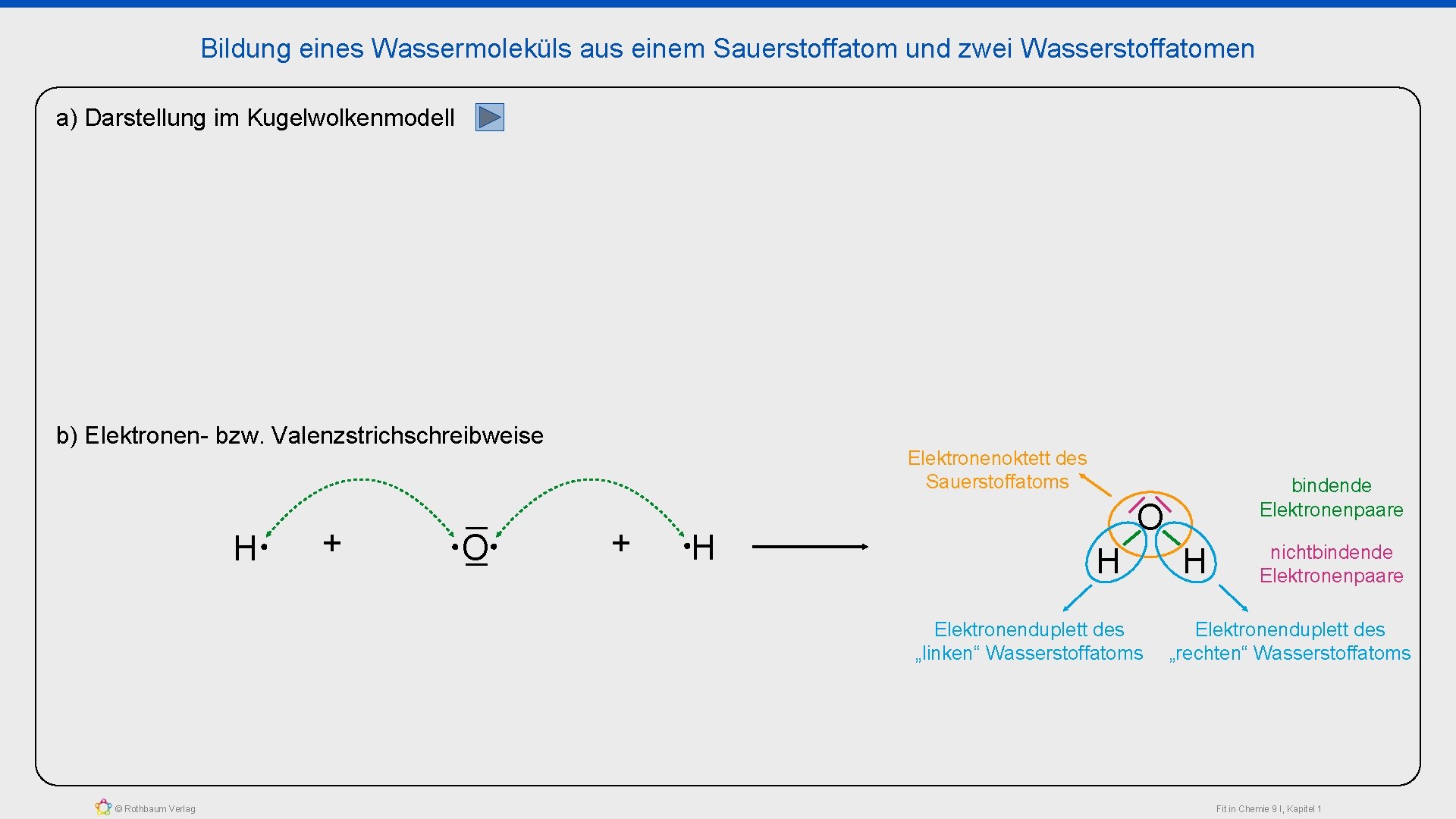
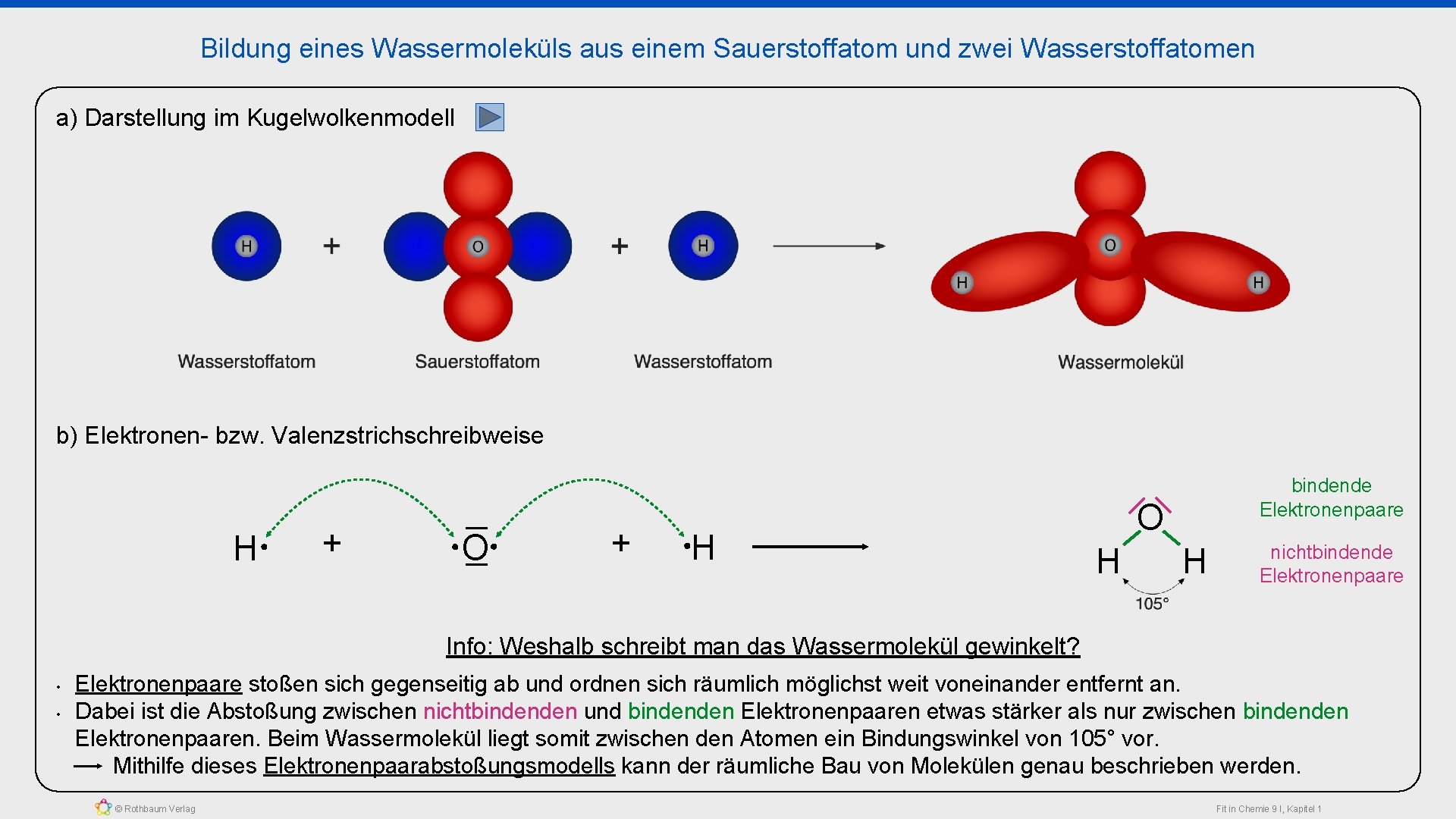
Bildung eines Wassermoleküls aus einem Sauerstoffatom und zwei Wasserstoffatomen a) Darstellung im Kugelwolkenmodell b) Elektronen- bzw. Valenzstrichschreibweise H + O Elektronenoktett des Sauerstoffatoms + H O H Elektronenduplett des „linken“ Wasserstoffatoms © Rothbaum Verlag bindende Elektronenpaare H nichtbindende Elektronenpaare Elektronenduplett des „rechten“ Wasserstoffatoms Fit in Chemie 9 I, Kapitel 1

Bildung eines Wassermoleküls aus einem Sauerstoffatom und zwei Wasserstoffatomen a) Darstellung im Kugelwolkenmodell b) Elektronen- bzw. Valenzstrichschreibweise H + O + H bindende Elektronenpaare O H H nichtbindende Elektronenpaare Info: Weshalb schreibt man das Wassermolekül gewinkelt? • • Elektronenpaare stoßen sich gegenseitig ab und ordnen sich räumlich möglichst weit voneinander entfernt an. Dabei ist die Abstoßung zwischen nichtbindenden und bindenden Elektronenpaaren etwas stärker als nur zwischen bindenden Elektronenpaaren. Beim Wassermolekül liegt somit zwischen den Atomen ein Bindungswinkel von 105° vor. Mithilfe dieses Elektronenpaarabstoßungsmodells kann der räumliche Bau von Molekülen genau beschrieben werden. © Rothbaum Verlag Fit in Chemie 9 I, Kapitel 1

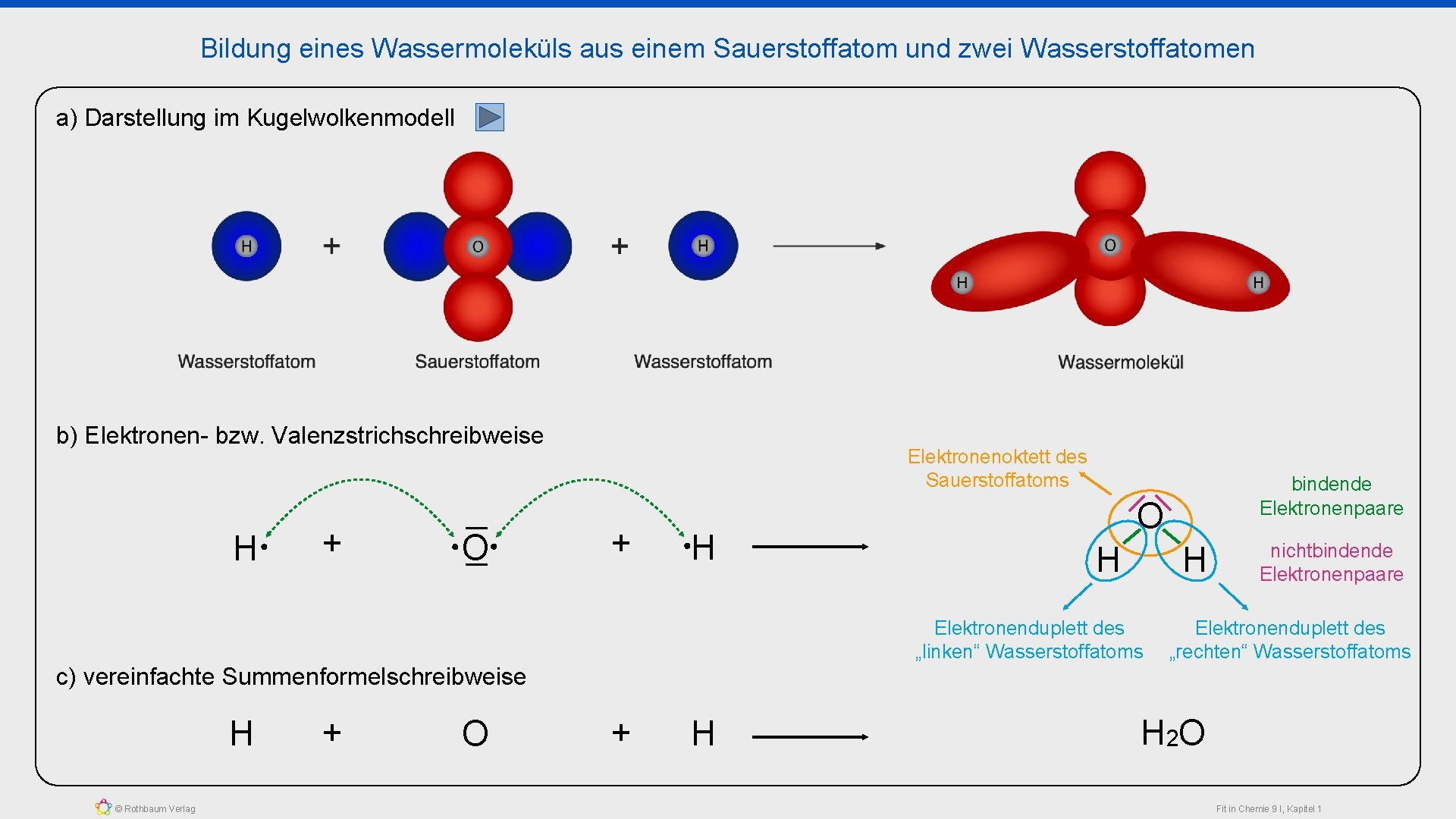
Bildung eines Wassermoleküls aus einem Sauerstoffatom und zwei Wasserstoffatomen a) Darstellung im Kugelwolkenmodell b) Elektronen- bzw. Valenzstrichschreibweise H + O Elektronenoktett des Sauerstoffatoms + H bindende Elektronenpaare O H H Elektronenduplett des „linken“ Wasserstoffatoms nichtbindende Elektronenpaare Elektronenduplett des „rechten“ Wasserstoffatoms c) vereinfachte Summenformelschreibweise H © Rothbaum Verlag + O + H H 2 O Fit in Chemie 9 I, Kapitel 1

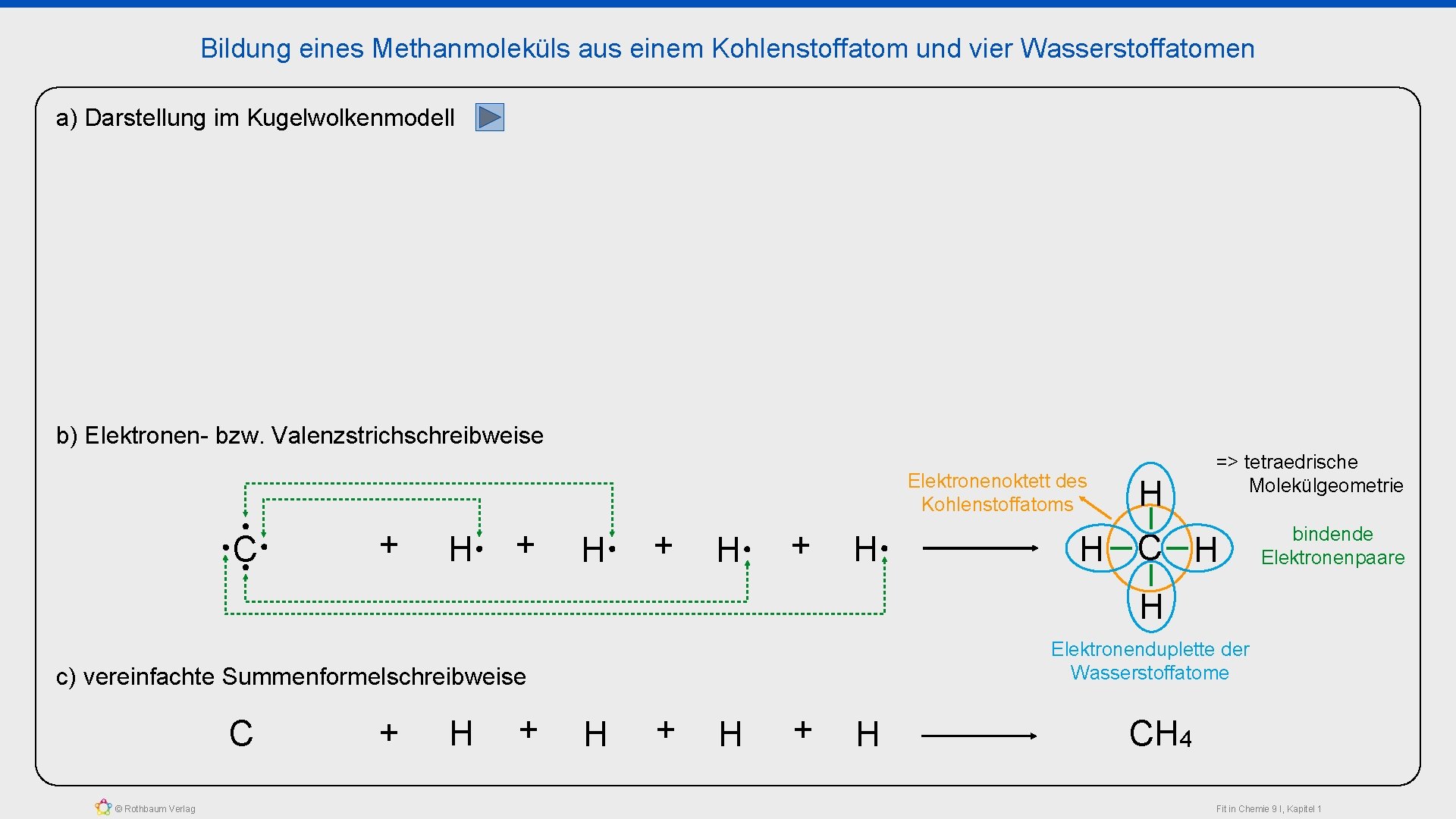
Bildung eines Methanmoleküls aus einem Kohlenstoffatom und vier Wasserstoffatomen a) Darstellung im Kugelwolkenmodell b) Elektronen- bzw. Valenzstrichschreibweise Elektronenoktett des Kohlenstoffatoms C + H + H H => tetraedrische Molekülgeometrie H C H bindende Elektronenpaare H Elektronenduplette der Wasserstoffatome c) vereinfachte Summenformelschreibweise C © Rothbaum Verlag + H + H CH 4 Fit in Chemie 9 I, Kapitel 1

Partnerarbeit 1) Baut mithilfe der Kugelwolkenmodelle aus den entsprechenden Atomen die folgenden Moleküle! • Bildung eines Sauerstoffmoleküls aus zwei Sauerstoffatomen • Bildung eines Stickstoffmoleküls aus zwei Stickstoffatomen 2) Übersetzt die Kugelwolkenmodelle in die Elektronen- bzw. Valenzstrichschreibweise und notiert eure Ergebnisse auf ein Blatt Papier! Zeit: 10 Minuten © Rothbaum Verlag Fit in Chemie 9 I, Kapitel 1

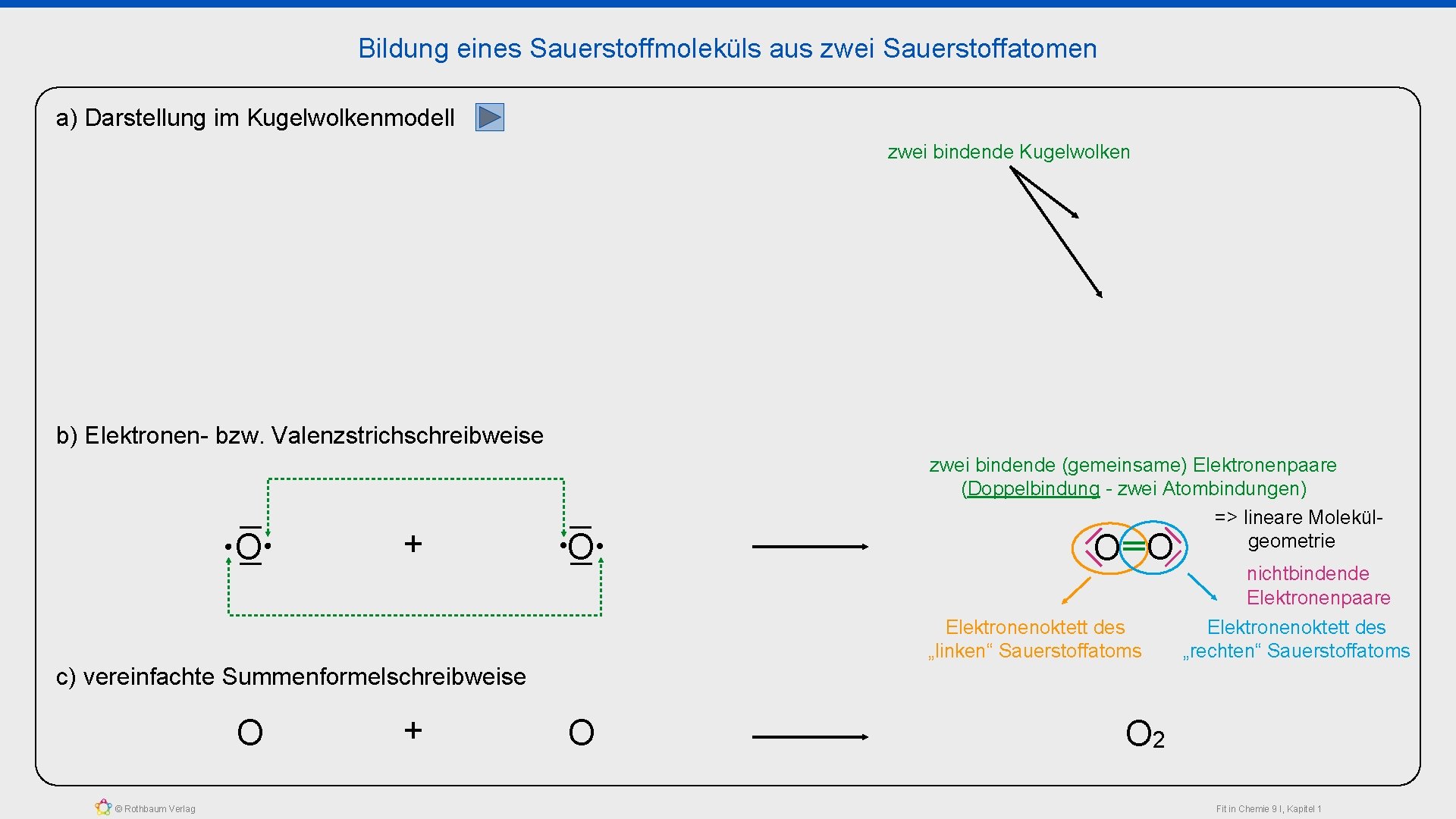
Bildung eines Sauerstoffmoleküls aus zwei Sauerstoffatomen a) Darstellung im Kugelwolkenmodell zwei bindende Kugelwolken b) Elektronen- bzw. Valenzstrichschreibweise O + O zwei bindende (gemeinsame) Elektronenpaare (Doppelbindung - zwei Atombindungen) => lineare Molekülgeometrie O O Elektronenoktett des „linken“ Sauerstoffatoms nichtbindende Elektronenpaare Elektronenoktett des „rechten“ Sauerstoffatoms c) vereinfachte Summenformelschreibweise O © Rothbaum Verlag + O O 2 Fit in Chemie 9 I, Kapitel 1

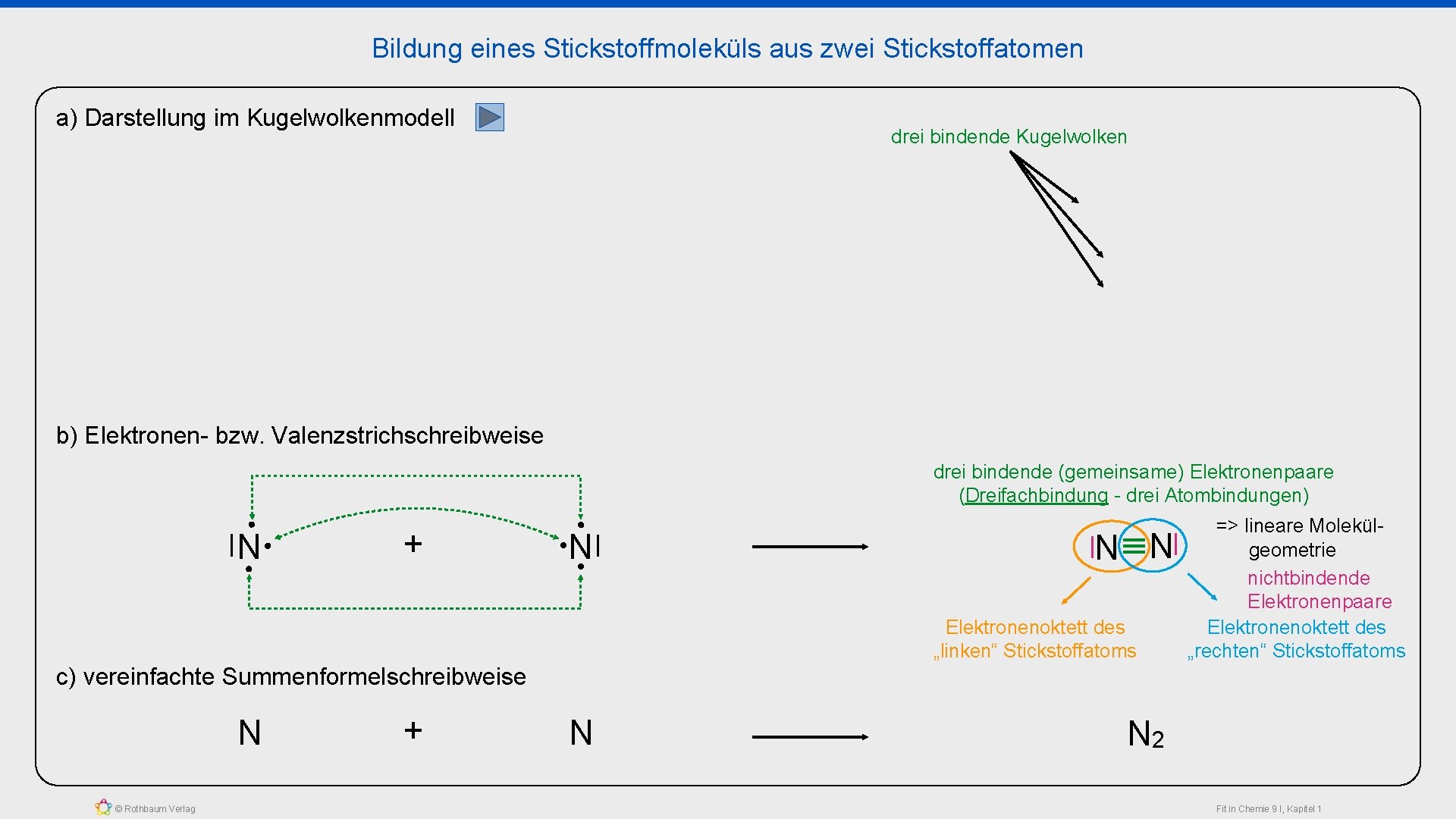
Bildung eines Stickstoffmoleküls aus zwei Stickstoffatomen a) Darstellung im Kugelwolkenmodell drei bindende Kugelwolken b) Elektronen- bzw. Valenzstrichschreibweise drei bindende (gemeinsame) Elektronenpaare (Dreifachbindung - drei Atombindungen) N + N N N Elektronenoktett des „linken“ Stickstoffatoms => lineare Molekülgeometrie nichtbindende Elektronenpaare Elektronenoktett des „rechten“ Stickstoffatoms c) vereinfachte Summenformelschreibweise N © Rothbaum Verlag + N N 2 Fit in Chemie 9 I, Kapitel 1

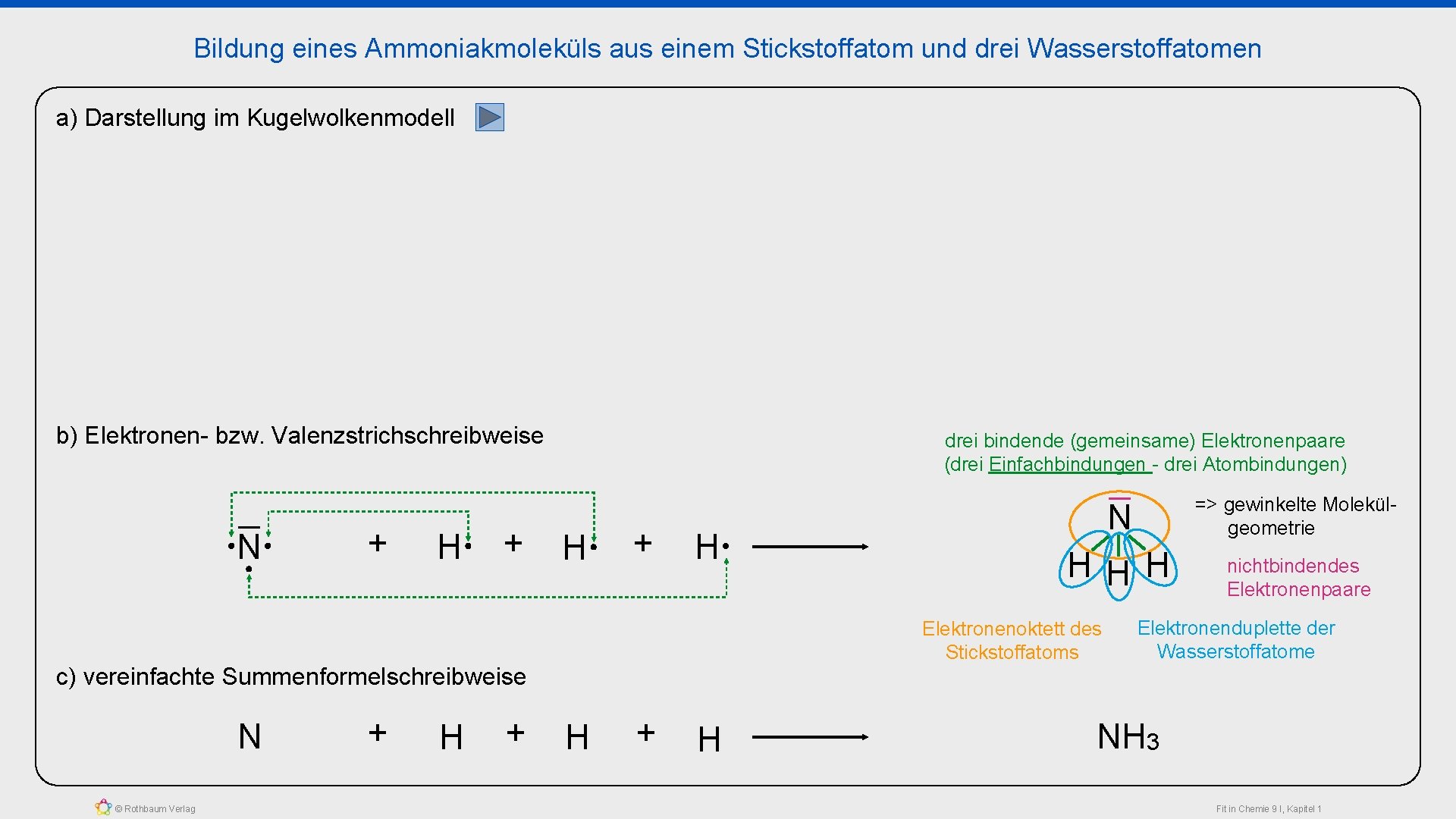
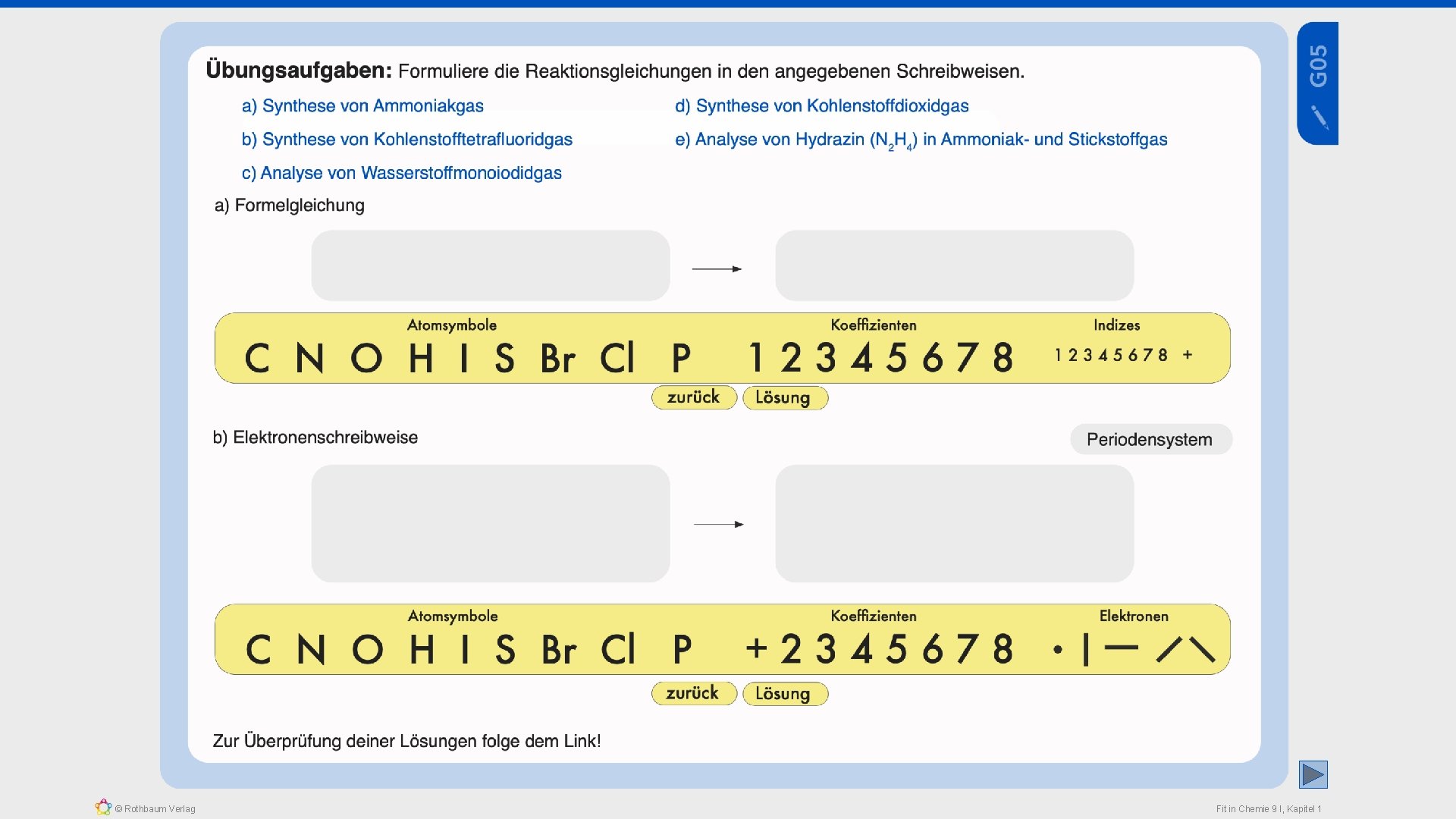
Bildung eines Ammoniakmoleküls aus einem Stickstoffatom und drei Wasserstoffatomen a) Darstellung im Kugelwolkenmodell b) Elektronen- bzw. Valenzstrichschreibweise N + H + drei bindende (gemeinsame) Elektronenpaare (drei Einfachbindungen - drei Atombindungen) H + H © Rothbaum Verlag + HHH nichtbindendes Elektronenpaare Elektronenoktett des Stickstoffatoms c) vereinfachte Summenformelschreibweise N N => gewinkelte Molekülgeometrie H + H Elektronenduplette der Wasserstoffatome NH 3 Fit in Chemie 9 I, Kapitel 1

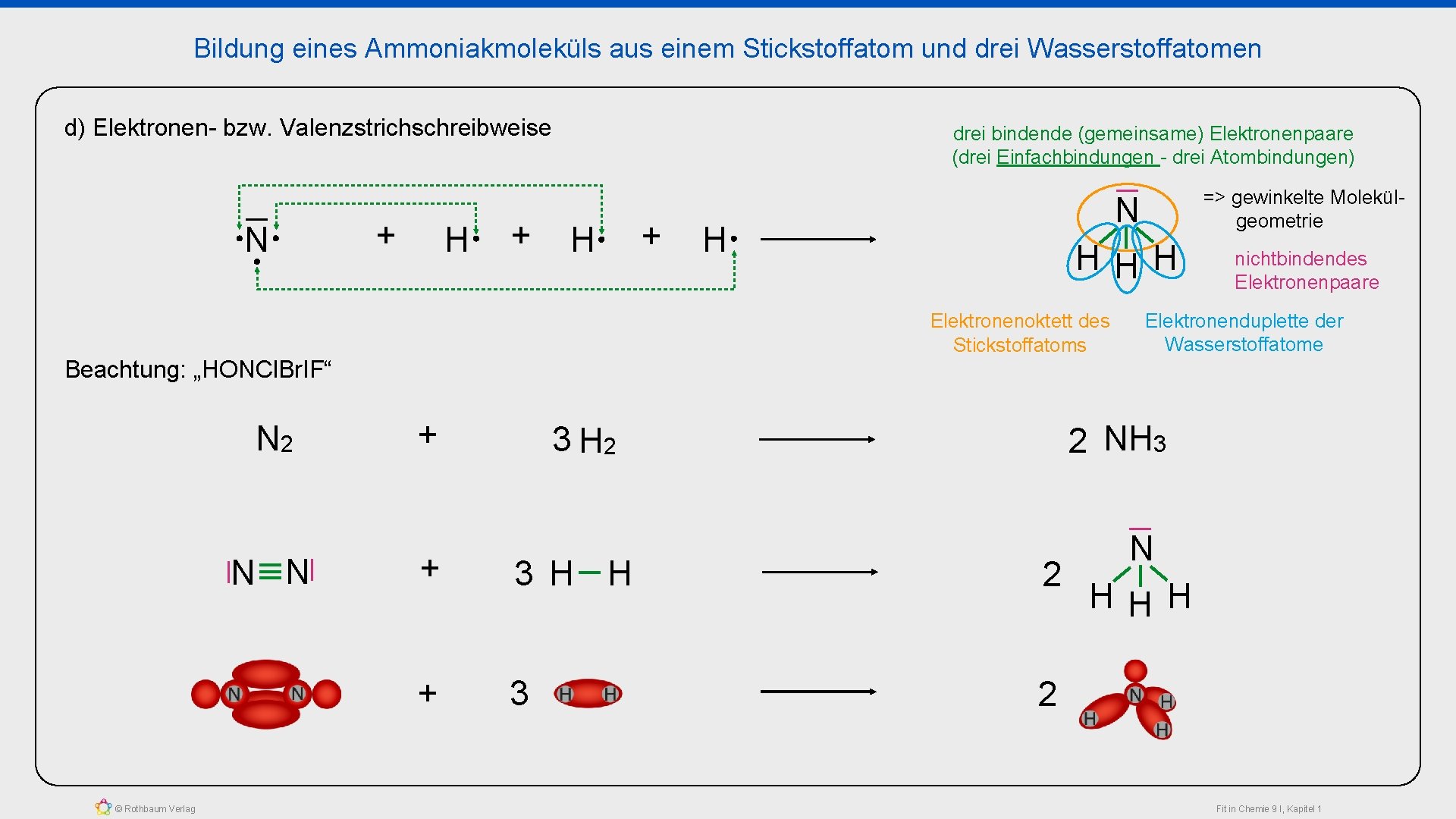
Bildung eines Ammoniakmoleküls aus einem Stickstoffatom und drei Wasserstoffatomen d) Elektronen- bzw. Valenzstrichschreibweise N + H + drei bindende (gemeinsame) Elektronenpaare (drei Einfachbindungen - drei Atombindungen) H N N © Rothbaum Verlag H HHH nichtbindendes Elektronenpaare Elektronenoktett des Stickstoffatoms Beachtung: „HONCl. Br. IF“ N 2 + N => gewinkelte Molekülgeometrie + Elektronenduplette der Wasserstoffatome 2 NH 3 3 H 2 + 3 H H 2 + 3 2 N HHH Fit in Chemie 9 I, Kapitel 1

© Rothbaum Verlag Fit in Chemie 9 I, Kapitel 1
 Sehr geehrte damen und herren
Sehr geehrte damen und herren Sehr geehrte damen und herren
Sehr geehrte damen und herren Sehr geehrte frau doktor
Sehr geehrte frau doktor Sehr geehrte damen und herren
Sehr geehrte damen und herren Prsentation
Prsentation Sprachgruppen
Sprachgruppen Prsentation powerpoint
Prsentation powerpoint Prsentation
Prsentation Die mier en die sprinkaan
Die mier en die sprinkaan Sehr schön
Sehr schön Wie schreibt man sehr geehrter
Wie schreibt man sehr geehrter Rot rot rot sind die rosen rosen die ich an dich verschenke
Rot rot rot sind die rosen rosen die ich an dich verschenke Wat is lewensdoelwitte
Wat is lewensdoelwitte Die pad van waarheid tot die lewe
Die pad van waarheid tot die lewe Lydende en bedrywende vorm examples
Lydende en bedrywende vorm examples Het is niet die ene druppel die de emmer doet overlopen
Het is niet die ene druppel die de emmer doet overlopen Die einde van die koue oorlog 1989
Die einde van die koue oorlog 1989 Die hippie die
Die hippie die Voegwoorde graad 6
Voegwoorde graad 6 Die europäer verteilen die welt
Die europäer verteilen die welt Die kinder verbringen die ferien
Die kinder verbringen die ferien Mutter bumst sohn
Mutter bumst sohn Belydenis van geloof ek glo in god die vader
Belydenis van geloof ek glo in god die vader