Rhodium Ruthenium A Rkov Rhodium pat do VIII























- Slides: 25

Rhodium, Ruthenium A. Růžková

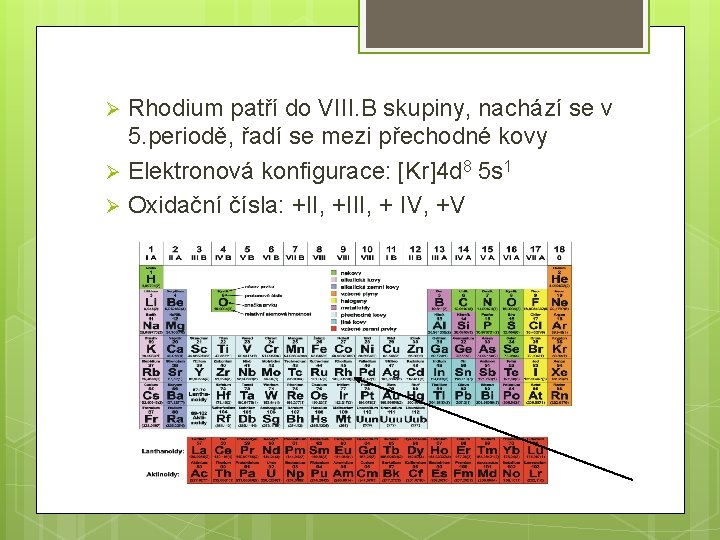
Rhodium patří do VIII. B skupiny, nachází se v 5. periodě, řadí se mezi přechodné kovy Ø Elektronová konfigurace: [Kr]4 d 8 5 s 1 Ø Oxidační čísla: +II, +III, + IV, +V Ø

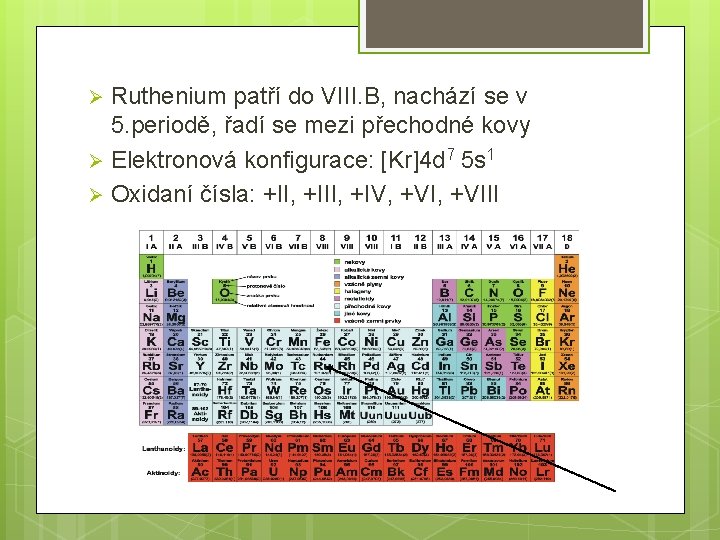
Ruthenium patří do VIII. B, nachází se v 5. periodě, řadí se mezi přechodné kovy Ø Elektronová konfigurace: [Kr]4 d 7 5 s 1 Ø Oxidaní čísla: +II, +IV, +VIII Ø

Vlastnosti, výskyt

Rhodium Ø Patří do triády tzv. lehkých platinových kovů – je nejdražší Ø Je mimořádně odolné, neochotně se rozpouští v lučavce královské či v koncentrované kyselině chlorovodíkové za vysokého tlaku, za přítomnosti chloristanu sodného Ø Rhodiové sloučeniny jsou růžové – podle nich odvozený název Ø Ušlechtilý, odolný, poměrně tvrdý kov, tepělně i elektricky dobře vodivý

S chlorem reaguje poměrně ochotně za vzniku červeně zbarveného chloridu Rh. Cl 3 Ø Největšími nalezišti jsou platinové doly Ø V přírodě se rhodium vyskytuje v platinových rudách a zlatonosných píscích Ø


Ruthenium Ø Ø Patří do triády lehkých platinových kovů Je značně odolné, nejlépe jej lze do roztoku po oxidačním alkalickém tavení s hydroxidem a peroxidem sodným Ø Je jedním ze tří prvků, které mohou vytvořit oxid s prvkem v nejvyšším oxidačním čísle ØJe to šedý, tvrdý a ušlechtilý kov, který je poměrně vzácný. Ø V přírodě se vyskytuje ve stopovém množství v platinových rudách, popř. v sulfidických rudách mědi a zinku

S fluorem reaguje práškové ruthenium při teplotě 300°C za vzniku fluoridu rutheničného Ru. F 5 Ø Má silný sklon k tvorbě barevných komplexních sloučenin Ø


Výroba, získání

Rhodium Ø Získává se postupy používanými při oddělování Ag, Au a všech platinových kovů. Zpracování výchozí suroviny jako při výrobě ruthenia. Rhodium se získáva z nerozpuštěného zbytku Ruthenium Ø Ruthenium se získává z anodických kalů, které vznikají při elektrolytické rafinaci zinku

Sloučeniny

Rhodium Ø halogenidy Ø Rh. F 6 (černý), (Rh. F 5)4 (tmavě červený), Rh. F 4 (purpurově červený), Rh. F 3, Rh. Cl 3 (červené), Rh. Br 3 (červenohnědý), Rh. I 3(černý) Ø Rh. III Ø hydráty Rh. III Ø jejich roztoky jsou žluté, způsobuje to přítomnost kationtu [Rh(H 2 O)6]3+ Ø Rh. Cl 3· 3 H 2 O Ø oxidy Ø Rh 2 O 3 Ø Rh. O 2

Ø sulfidy Ø Rh. S 2, Rh 2 S 3, Rh 2 S 5 Ø Komplexní sloučeniny [Rh. X 6]3 Ø [Rh(NH 3)6]3+ , [Rh(H 2 O)6]3+ Ø [Rh(CN)6]3Ø [Rh(NH 3)5 H]2+ Ø [Rh. X 6]2 - (X = F, Cl) Ø

Ø V přírodě se vyskytuje zejména ryzí a vždy společně s jinými drahými kovy, mezi známe minerály patří: kuprohodsit Cu. Rh 2 s, čerpanovit Rh. As, polkanovit Rh 12 As, miassit Rh 12 S 15

Ruthenium Ø Ø Ø Oxidy Ru. O 2, Ru. O 4 Hydroxidy Ru(OH)3 -černá sraženina, Ru(OH)2 -hnědá sraženina Mezi známé minerály ruthenia patří anduoit (Ru, Os)As, irarsit(Ir, Ru, Rh, Pt)As. S, omeiit (Os, Ru)As nebo ruarsit Ru. As. S Nejvyšší obsah ruthenia ze všech nerostů má laurit Ru. S 2

Zajímavosti

Využití

Rhodium Slitiny s platinou a iridiem se využívají jako materiál na výrobu odolného chemického nádobí, pro rozklady vzorků Ø Ve sklářském průmyslu slouží jeho slitiny s platinou pro výrobu zařízení na tažení optických vláken Ø V chemickém průmyslu slouží jako katalyzátor – výroba kyseliny dusičné z amoniaku Ø Termočlánky, šperky (rhodiování stříbrných šperků – ochrana před korozí, lesk), pokování méně ušlechtilých kovů, dokonalá zrcadla Ø Automobilový katalyzátor - zařízení snižující emise výfukových plynů Ø


Ruthenium V chemickém průmyslu jako katalyzátor - velice dobře katalyzuje např. syntézu amoniaku z vodíku a dusíku Ø Legování slitin titanu – zlepšuje jeho odolnost, proti korozi Ø Zvýšení tvrdosti platiny a palladia Ø S platinou – luxusní náramkové hodinky (nepoškoditelné) Ø Odstraňování sulfanu z ropy a ropných produktů Ø Farmaceutický průmysl – cytostatika (léčba nádorových nemocí) Ø


Nebezpečné účinky ruthenia Ø Dýmy oxidu rutheničného i rutheničelého mají silné pulmotoxické účinky Ø Vdechování závažným způsobem poškozuje plicní tkáň Ø Směs dýmu oxidu rutheničelého se vzduchem je silně explozivní Ø Rhodium je nejdražší platinový kov, rekordu dosáhla cena rhodia v roce 2008, kdy se průměrná cena za trojskou unci (31, 103 g) na světových trzích pohybovala okolo 6530 USD Ø

Zdroje www. wikipedia. cz Ø Encyklopedie 1000 otázek a odpovědí Ø www. prvky. com Ø www. tabulka. cz Ø
 Rhodium ruthenium
Rhodium ruthenium Ruthenium
Ruthenium Pat pat seguimiento
Pat pat seguimiento Roma siglo viii a.c
Roma siglo viii a.c Navarea viii warnings
Navarea viii warnings Reforma luterana consequências
Reforma luterana consequências Henryk viii
Henryk viii Henry viii family tree
Henry viii family tree Prvky viii.a skupiny
Prvky viii.a skupiny Csric viii
Csric viii Viii domingo tiempo ordinario ciclo c
Viii domingo tiempo ordinario ciclo c Harri viii
Harri viii Henry viii foreign policy 1509-1529
Henry viii foreign policy 1509-1529 How to remember henry viii wives
How to remember henry viii wives Luther calvin and henry viii
Luther calvin and henry viii Mapa mental formação dos estados nacionais
Mapa mental formação dos estados nacionais Canto 8 paradiso
Canto 8 paradiso Raport evaluare nationala clasa 6
Raport evaluare nationala clasa 6 Viii encuentro nacional de catalogadores
Viii encuentro nacional de catalogadores Stcw chapter viii
Stcw chapter viii Henry viii great matter
Henry viii great matter Jnc viii
Jnc viii Donde se encuentra el nervio vago
Donde se encuentra el nervio vago Viii henrik feleségei
Viii henrik feleségei Why did henry viii divorce catherine of aragon
Why did henry viii divorce catherine of aragon Lecturas domingo xviii tiempo ordinario ciclo c
Lecturas domingo xviii tiempo ordinario ciclo c