Plan du cours 1re partie De latome dhydrogne







- Slides: 28

Plan du cours 1ère partie : De l'atome d'hydrogène à la classification périodique Chapitre 1 : Atomistique - la structure de l’atome Chapitre 2 : Introduction à la mécanique quantique Chapitre 3 : L’atome d’hydrogène et les hydrogénoïde Chapitre 4 : Structure électronique des atomes et tableau périodique 2ème partie : Molécules et liaisons intermoléculaires Chapitre 5 : Structure électronique des molécules; liaisons chimiques Chapitre 6 : Modèle ionique, modèle de Lewis, mésomérie Chapitre 7 : Liaisons faibles, liaisons intermoléculaires 3ème partie : Structure à l’état solide, initiation à la cristallographie Chapitre 8 : Notions de base en cristallographie Chapitre 9 : Etude des mailles cubiques Chapitre 10 : Application aux cristaux métalliques et ioniques

L’existence de forces intermoléculaires Une phase : • Une forme de la matière qui est uniforme à la fois en composition chimique et en état physique. Liquide et solide sont appelées phases condensées. • L’existence de phases condensées découle d’interactions attractives entre les molécules ou atomes : les forces intermoléculaires. Gaz : Solides : Liquides : Les molécules ou atomes n’interagissent (presque) pas entre elles. Ils sont libres de circuler. Les molécules ou atomes n’ont pas assez d’énergie pour échapper à l’attraction de leurs voisins. Les molécules ou atomes ont assez d’énergie pour bouger autour de leurs voisins mais pas pour leur échapper complètement.

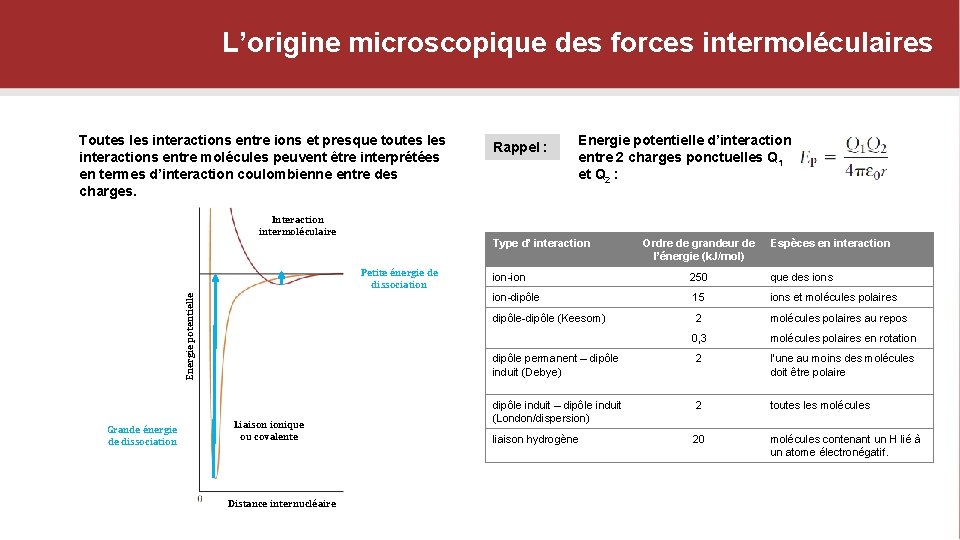
L’origine microscopique des forces intermoléculaires Toutes les interactions entre ions et presque toutes les interactions entre molécules peuvent être interprétées en termes d’interaction coulombienne entre des charges. Rappel : Energie potentielle d’interaction entre 2 charges ponctuelles Q 1 et Q 2 : Interaction intermoléculaire Type d’ interaction Energie potentielle Petite énergie de dissociation Grande énergie de dissociation Liaison ionique ou covalente Distance internucléaire Ordre de grandeur de l’énergie (k. J/mol) Espèces en interaction ion-ion 250 que des ion-dipôle 15 ions et molécules polaires dipôle-dipôle (Keesom) 2 molécules polaires au repos 0, 3 molécules polaires en rotation dipôle permanent – dipôle induit (Debye) 2 l’une au moins des molécules doit être polaire dipôle induit – dipôle induit (London/dispersion) 2 toutes les molécules liaison hydrogène 20 molécules contenant un H lié à un atome électronégatif.

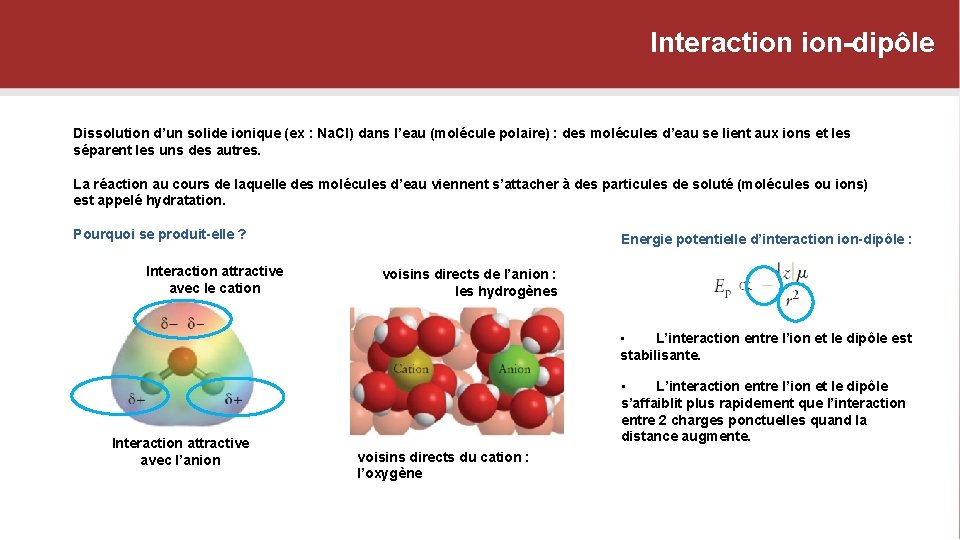
Interaction ion-dipôle Dissolution d’un solide ionique (ex : Na. Cl) dans l’eau (molécule polaire) : des molécules d’eau se lient aux ions et les séparent les uns des autres. La réaction au cours de laquelle des molécules d’eau viennent s’attacher à des particules de soluté (molécules ou ions) est appelé hydratation. Pourquoi se produit-elle ? Interaction attractive avec le cation Energie potentielle d’interaction ion-dipôle : voisins directs de l’anion : les hydrogènes • L’interaction entre l’ion et le dipôle est stabilisante. Interaction attractive avec l’anion • L’interaction entre l’ion et le dipôle s’affaiblit plus rapidement que l’interaction entre 2 charges ponctuelles quand la distance augmente. voisins directs du cation : l’oxygène

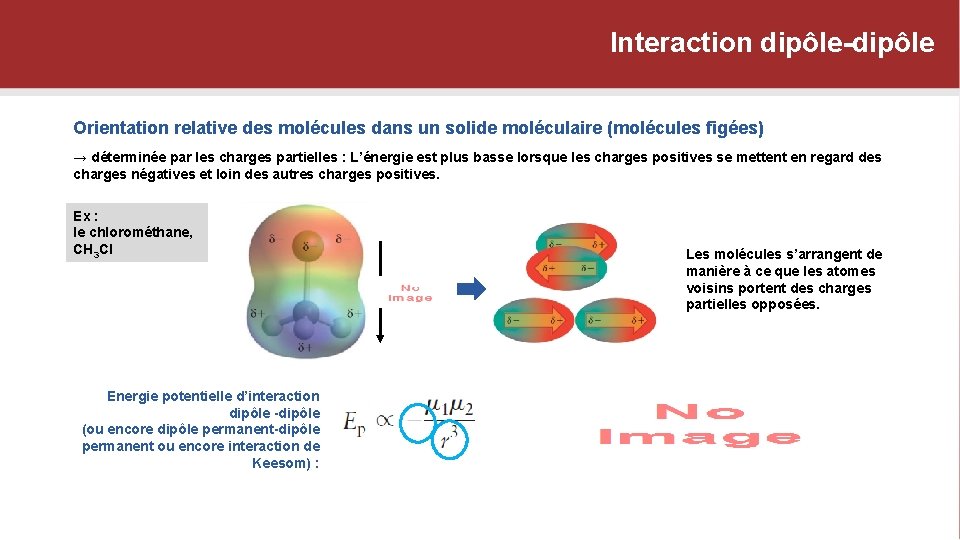
Interaction dipôle-dipôle Orientation relative des molécules dans un solide moléculaire (molécules figées) → déterminée par les charges partielles : L’énergie est plus basse lorsque les charges positives se mettent en regard des charges négatives et loin des autres charges positives. Ex : le chlorométhane, CH 3 Cl Energie potentielle d’interaction dipôle -dipôle (ou encore dipôle permanent-dipôle permanent ou encore interaction de Keesom) : Les molécules s’arrangent de manière à ce que les atomes voisins portent des charges partielles opposées.

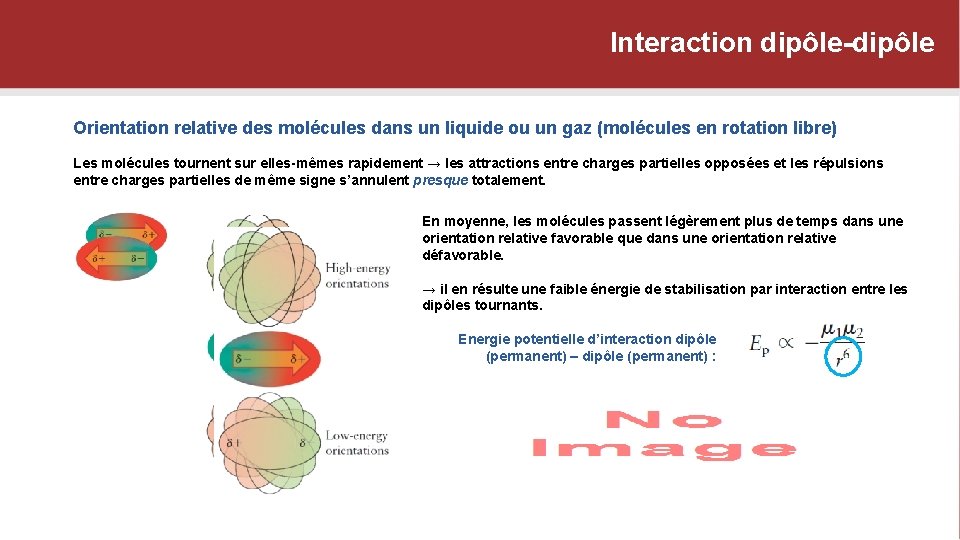
Interaction dipôle-dipôle Orientation relative des molécules dans un liquide ou un gaz (molécules en rotation libre) Les molécules tournent sur elles-mêmes rapidement → les attractions entre charges partielles opposées et les répulsions entre charges partielles de même signe s’annulent presque totalement. Orientations de haute énergie En moyenne, les molécules passent légèrement plus de temps dans une orientation relative favorable que dans une orientation relative défavorable. → il en résulte une faible énergie de stabilisation par interaction entre les dipôles tournants. Energie potentielle d’interaction dipôle (permanent) – dipôle (permanent) : Orientations de basse énergie

Forces intermoléculaires et points d’ébullition Plus les molécules sont en interaction forte (plus elles sont liées fortement les unes aux autres) et plus il faut fournir d’énergie pour les séparer. Gaz Liquide Solide moléculaire Amplitude des interactions intermoléculaires À pression constante, il faut fournir de l’énergie (par ex en chauffant) pour passer de l’état solide à l’état liquide puis à l’état gazeux : il faut extraire les molécules des forces qui les maintiennent dans la phase condensée. . • Plus les interaction intermoléculaires sont fortes dans le solide et plus le point de fusion est haut. • Plus les interactions intermoléculaires sont fortes dans le liquide et plus le point d’ébullition est haut.

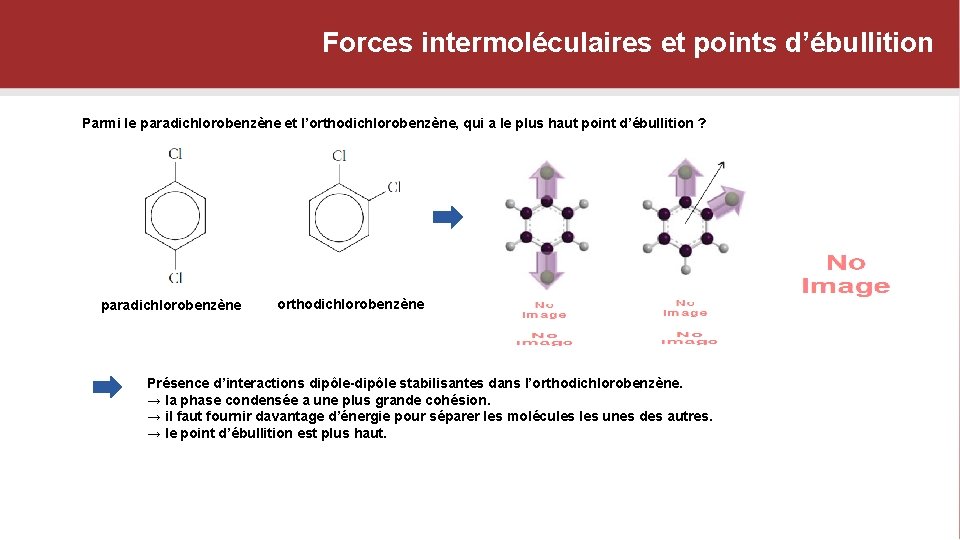
Forces intermoléculaires et points d’ébullition Parmi le paradichlorobenzène et l’orthodichlorobenzène, qui a le plus haut point d’ébullition ? paradichlorobenzène orthodichlorobenzène Présence d’interactions dipôle-dipôle stabilisantes dans l’orthodichlorobenzène. → la phase condensée a une plus grande cohésion. → il faut fournir davantage d’énergie pour séparer les molécules unes des autres. → le point d’ébullition est plus haut.


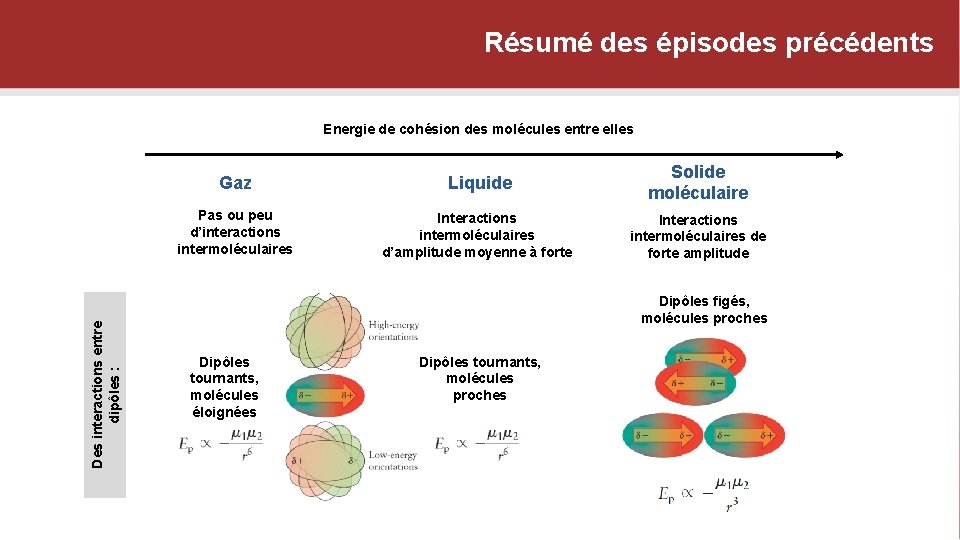
Résumé des épisodes précédents Des interactions entre dipôles : Energie de cohésion des molécules entre elles Gaz Liquide Solide moléculaire Pas ou peu d’interactions intermoléculaires Interactions intermoléculaires d’amplitude moyenne à forte Interactions intermoléculaires de forte amplitude Dipôles figés, molécules proches Dipôles tournants, molécules éloignées Dipôles tournants, molécules proches

Interaction dipôle induit-dipôle induit Il existe en fait des interactions attractives même entre molécules apolaires : Le dibrome Br 2 est strictement apolaire et pourtant, il est liquide (et non gazeux) à pression atmosphérique et à T =25°C. Comment les molécules sont-elles liées les unes aux autres dans la phase condensée ? Le moment dipolaire induit La formule de Lewis donne une description statique de la distribution des électrons. → en moyenne au cours du temps, les charges partielles sont nulles, la molécule est apolaire. Mais…

Interaction dipôle induit-dipôle induit Le dipôle instantané sur une molécule déforme le nuage électronique de la molécule voisine. Il induit l’apparition d’un dipôle instantané sur celle-ci (charges partielles opposées en regard les unes des autres). Le premier dipôle fluctue dans le temps mais le nuage électronique de la molécule voisine s’adapte instantanément et ainsi, le dipôle induit suit le premier dipôle. Les 2 dipôles instantanés s’attirent l’un l’autre. C’est l’interaction dipôle induit-dipôle induit, encore appelée interaction de London ou interaction de dispersion. Fluctuations au cours du temps Energie potentielle d’interaction dipôle induit-dipôle induit : Interaction à courte portée.

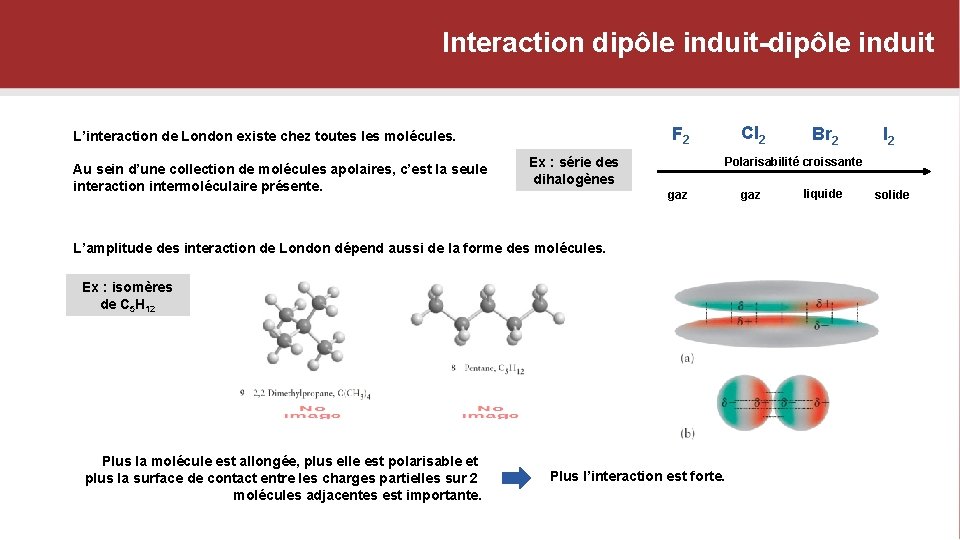
Interaction dipôle induit-dipôle induit Au sein d’une collection de molécules apolaires, c’est la seule interaction intermoléculaire présente. Cl 2 F 2 L’interaction de London existe chez toutes les molécules. Ex : série des dihalogènes I 2 Polarisabilité croissante gaz L’amplitude des interaction de London dépend aussi de la forme des molécules. Ex : isomères de C 5 H 12 Plus la molécule est allongée, plus elle est polarisable et plus la surface de contact entre les charges partielles sur 2 molécules adjacentes est importante. Br 2 Plus l’interaction est forte. gaz liquide solide

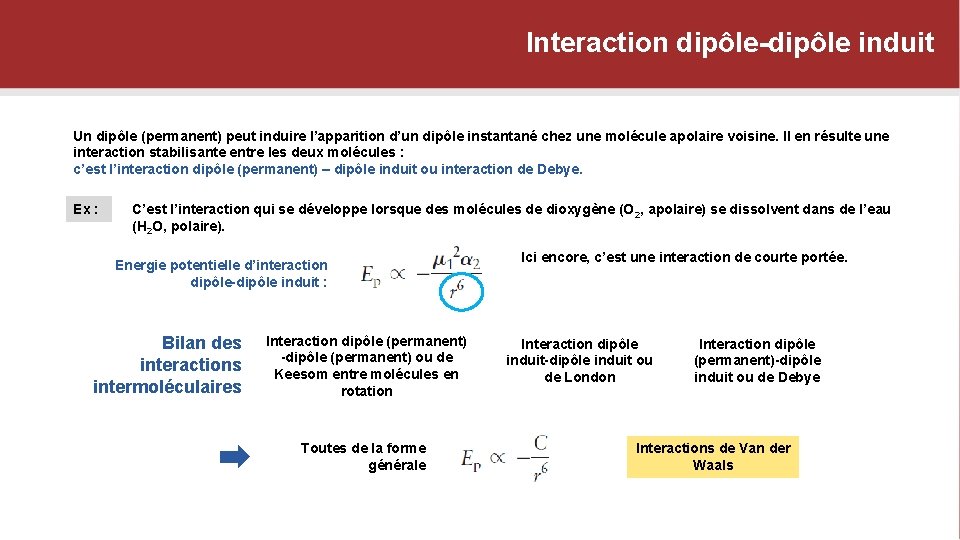
Interaction dipôle-dipôle induit Un dipôle (permanent) peut induire l’apparition d’un dipôle instantané chez une molécule apolaire voisine. Il en résulte une interaction stabilisante entre les deux molécules : c’est l’interaction dipôle (permanent) – dipôle induit ou interaction de Debye. Ex : C’est l’interaction qui se développe lorsque des molécules de dioxygène (O 2, apolaire) se dissolvent dans de l’eau (H 2 O, polaire). Energie potentielle d’interaction dipôle-dipôle induit : Bilan des interactions intermoléculaires Interaction dipôle (permanent) -dipôle (permanent) ou de Keesom entre molécules en rotation Toutes de la forme générale Ici encore, c’est une interaction de courte portée. Interaction dipôle induit-dipôle induit ou de London Interaction dipôle (permanent)-dipôle induit ou de Debye Interactions de Van der Waals

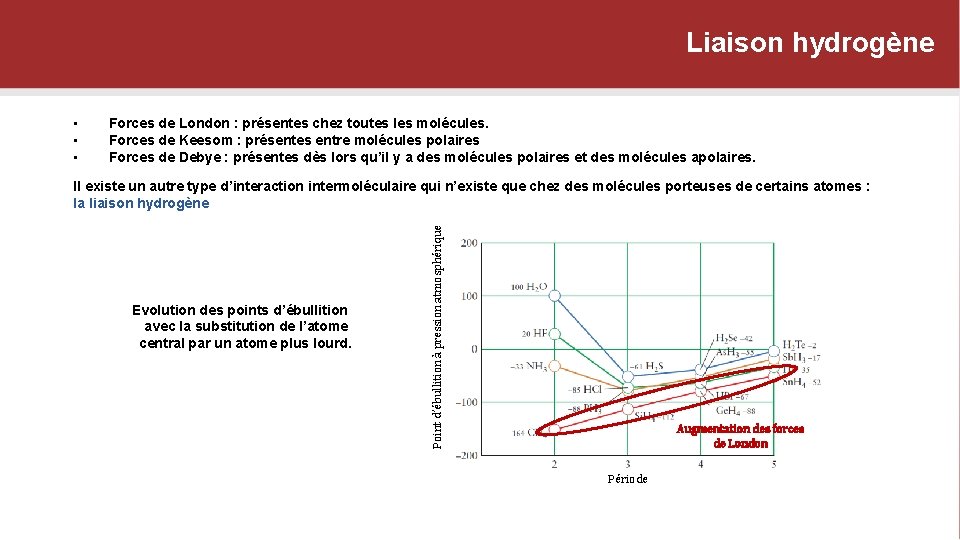
Liaison hydrogène • • • Forces de London : présentes chez toutes les molécules. Forces de Keesom : présentes entre molécules polaires Forces de Debye : présentes dès lors qu’il y a des molécules polaires et des molécules apolaires. Evolution des points d’ébullition avec la substitution de l’atome central par un atome plus lourd. Point d’ébullition à pression atmosphérique Il existe un autre type d’interaction intermoléculaire qui n’existe que chez des molécules porteuses de certains atomes : la liaison hydrogène Augmentation des forces de London Période

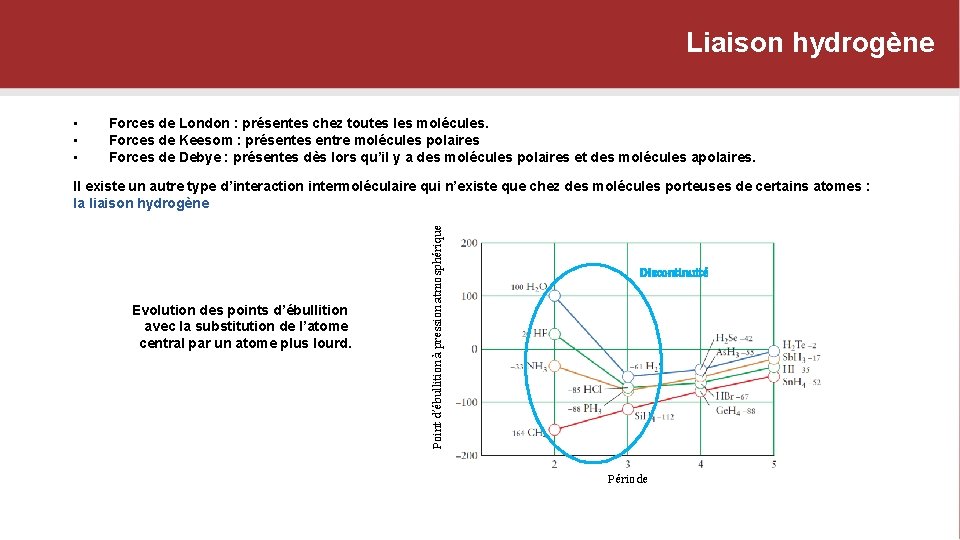
Liaison hydrogène • • • Forces de London : présentes chez toutes les molécules. Forces de Keesom : présentes entre molécules polaires Forces de Debye : présentes dès lors qu’il y a des molécules polaires et des molécules apolaires. Evolution des points d’ébullition avec la substitution de l’atome central par un atome plus lourd. Point d’ébullition à pression atmosphérique Il existe un autre type d’interaction intermoléculaire qui n’existe que chez des molécules porteuses de certains atomes : la liaison hydrogène Discontinuité Période

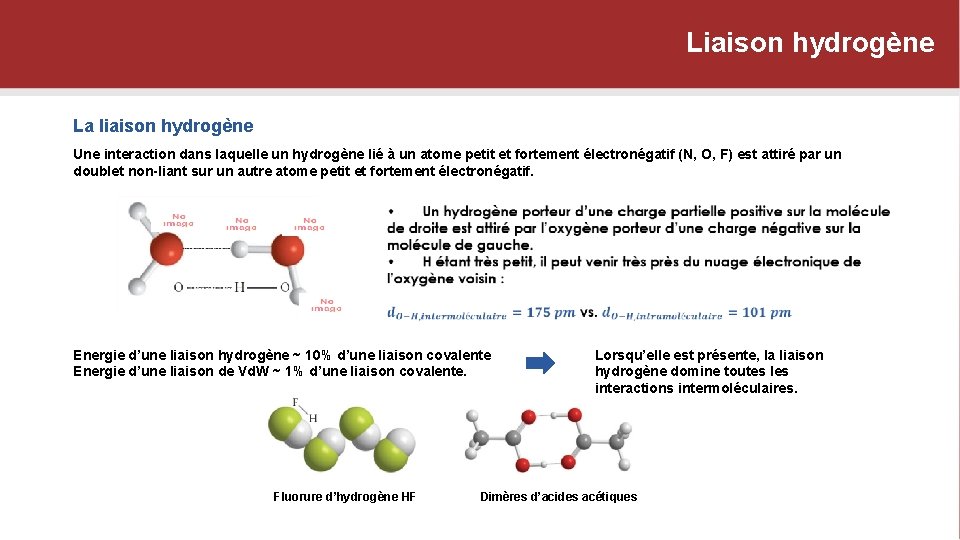
Liaison hydrogène La liaison hydrogène Une interaction dans laquelle un hydrogène lié à un atome petit et fortement électronégatif (N, O, F) est attiré par un doublet non-liant sur un autre atome petit et fortement électronégatif. Energie d’une liaison hydrogène ~ 10% d’une liaison covalente Energie d’une liaison de Vd. W ~ 1% d’une liaison covalente. Fluorure d’hydrogène HF Lorsqu’elle est présente, la liaison hydrogène domine toutes les interactions intermoléculaires. Dimères d’acides acétiques

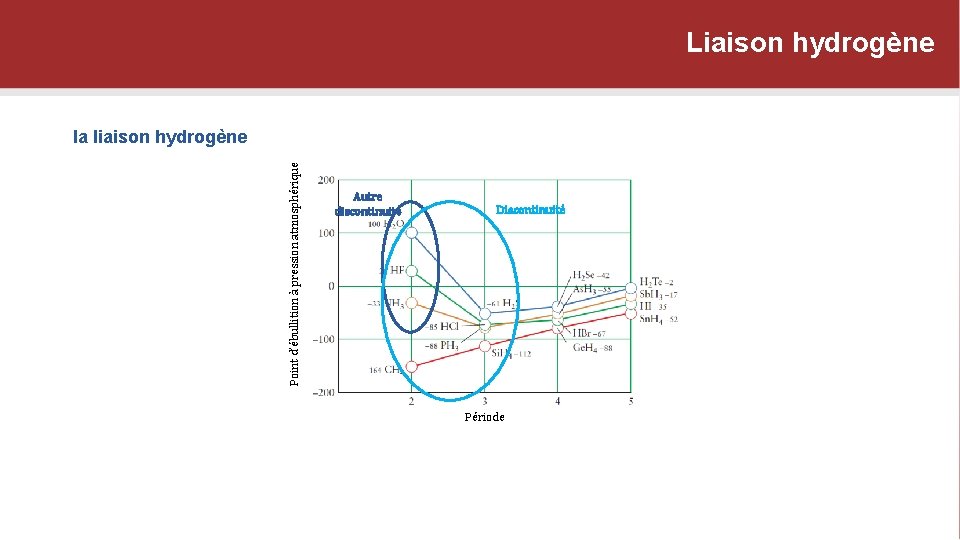
Liaison hydrogène Point d’ébullition à pression atmosphérique la liaison hydrogène Autre discontinuité Discontinuité Période

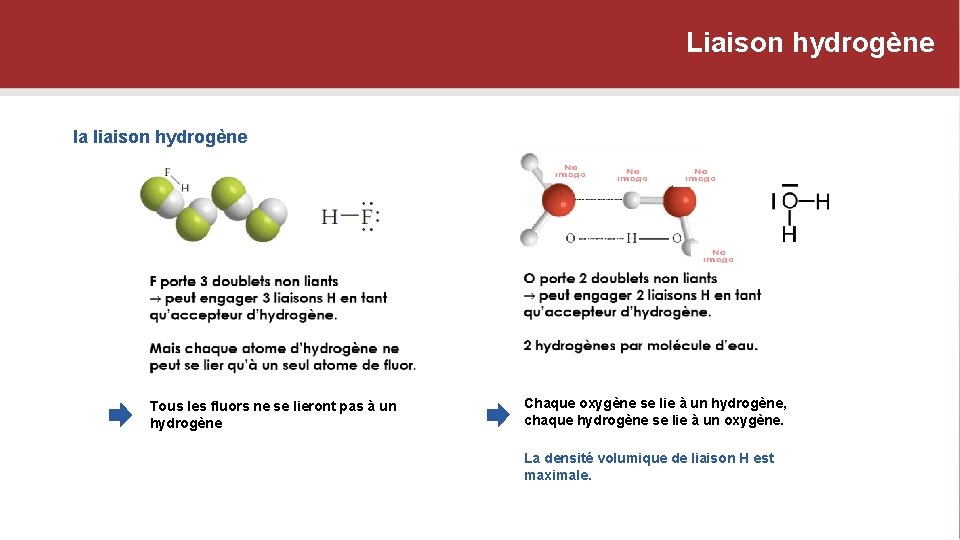
Liaison hydrogène la liaison hydrogène Tous les fluors ne se lieront pas à un hydrogène Chaque oxygène se lie à un hydrogène, chaque hydrogène se lie à un oxygène. La densité volumique de liaison H est maximale.

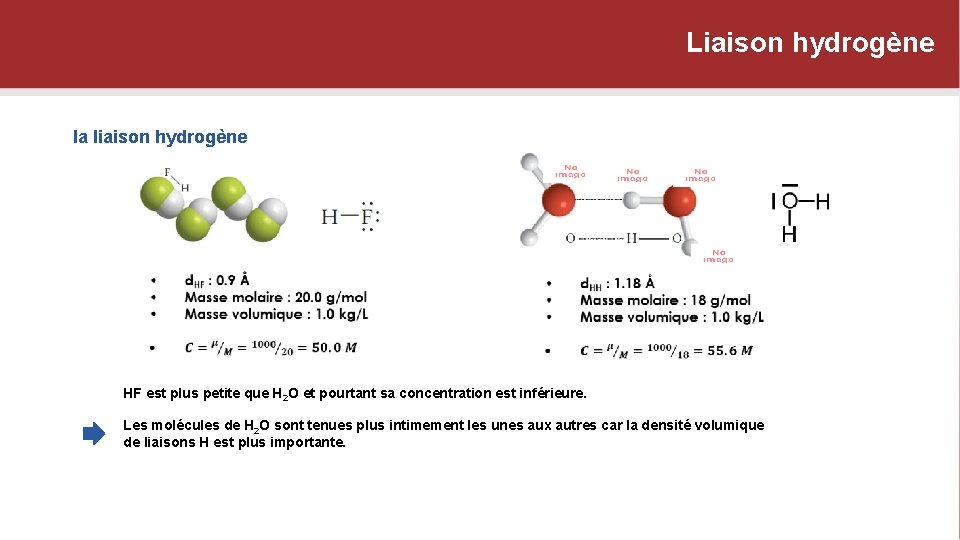
Liaison hydrogène la liaison hydrogène HF est plus petite que H 2 O et pourtant sa concentration est inférieure. Les molécules de H 2 O sont tenues plus intimement les unes aux autres car la densité volumique de liaisons H est plus importante.

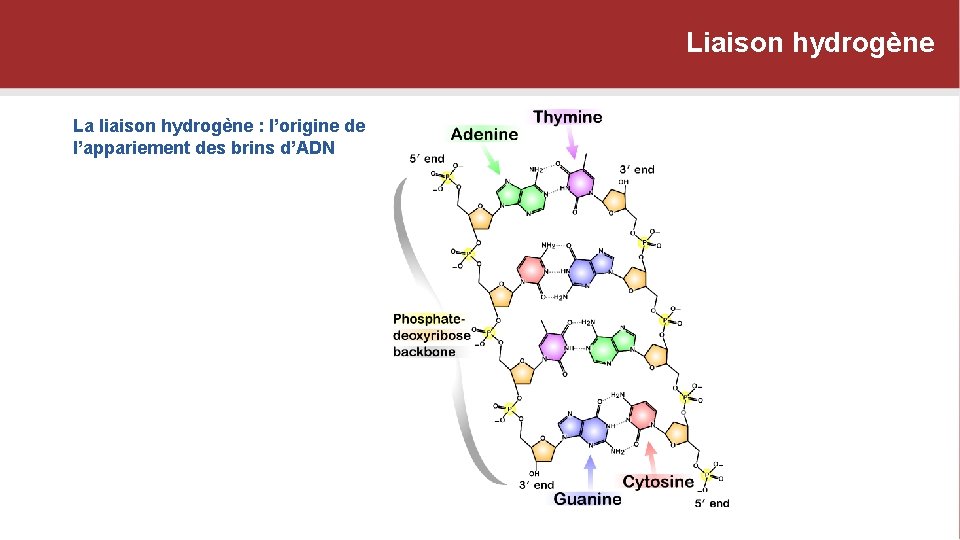
Liaison hydrogène La liaison hydrogène : l’origine de l’appariement des brins d’ADN

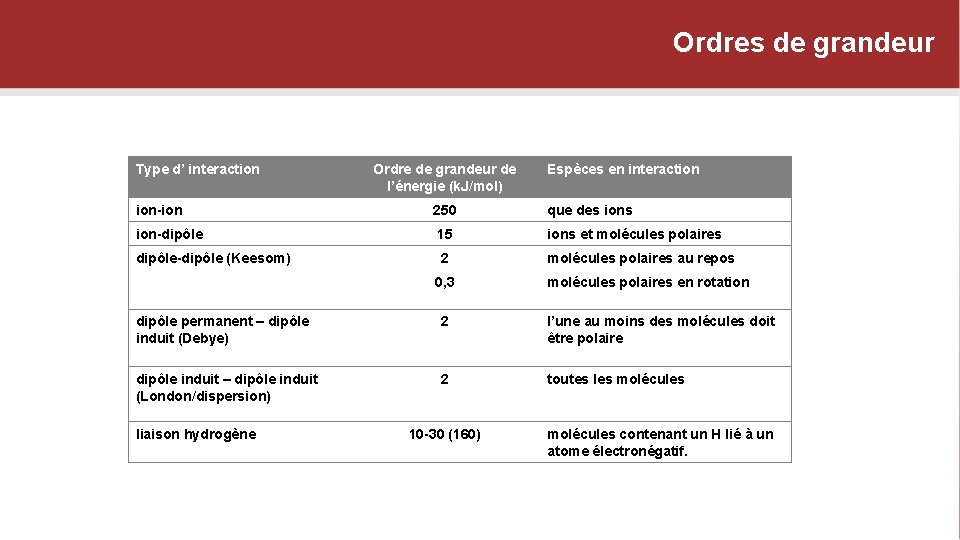
Ordres de grandeur Type d’ interaction Ordre de grandeur de l’énergie (k. J/mol) Espèces en interaction ion-ion 250 que des ion-dipôle 15 ions et molécules polaires dipôle-dipôle (Keesom) 2 molécules polaires au repos 0, 3 molécules polaires en rotation dipôle permanent – dipôle induit (Debye) 2 l’une au moins des molécules doit être polaire dipôle induit – dipôle induit (London/dispersion) 2 toutes les molécules liaison hydrogène 10 -30 (160) molécules contenant un H lié à un atome électronégatif.

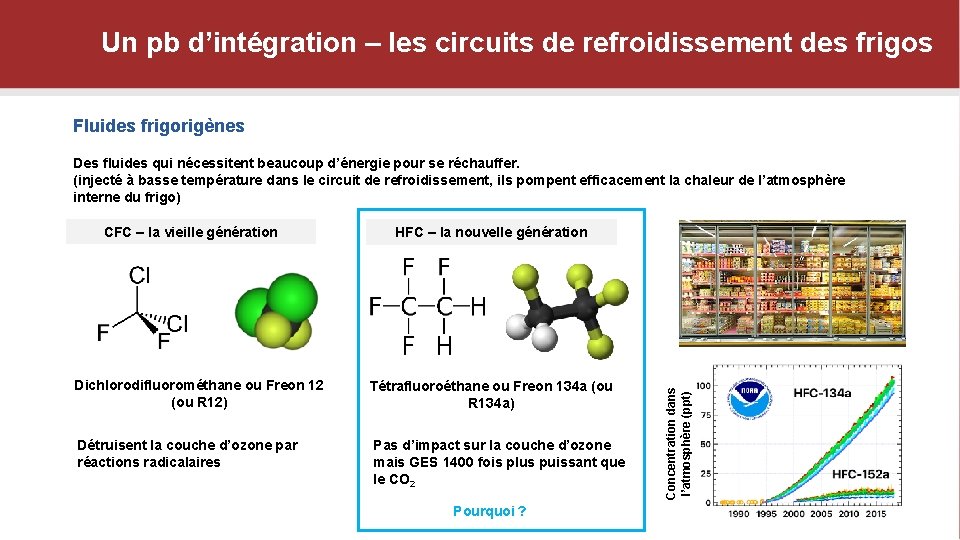
Un pb d’intégration – les circuits de refroidissement des frigos Fluides frigorigènes Des fluides qui nécessitent beaucoup d’énergie pour se réchauffer. (injecté à basse température dans le circuit de refroidissement, ils pompent efficacement la chaleur de l’atmosphère interne du frigo) HFC – la nouvelle génération Dichlorodifluorométhane ou Freon 12 (ou R 12) Tétrafluoroéthane ou Freon 134 a (ou R 134 a) Détruisent la couche d’ozone par réactions radicalaires Pas d’impact sur la couche d’ozone mais GES 1400 fois plus puissant que le CO 2 Pourquoi ? Fuites : jusqu’à 25% Concentration dans l’atmosphère (ppt) CFC – la vieille génération

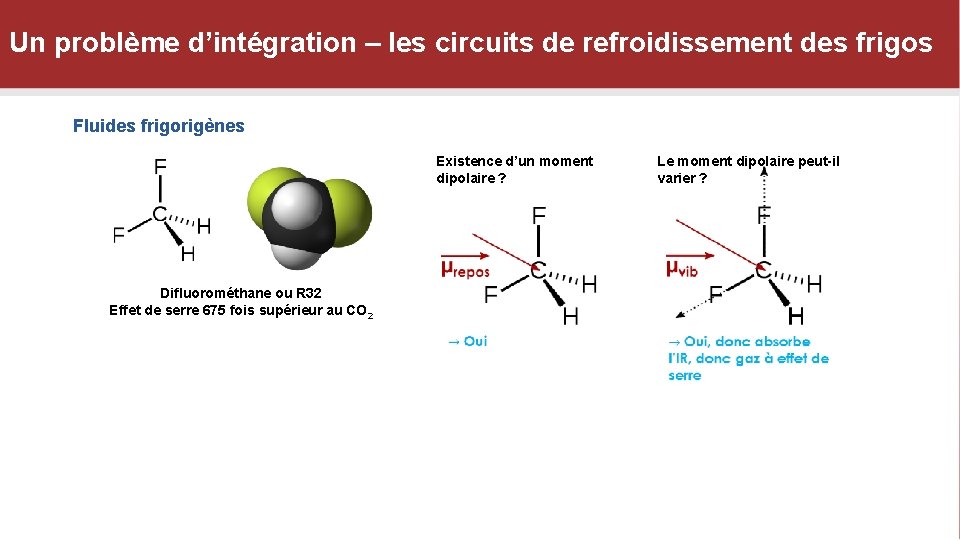
Un problème d’intégration – les circuits de refroidissement des frigos Fluides frigorigènes Existence d’un moment dipolaire ? Difluorométhane ou R 32 Effet de serre 675 fois supérieur au CO 2 Le moment dipolaire peut-il varier ?

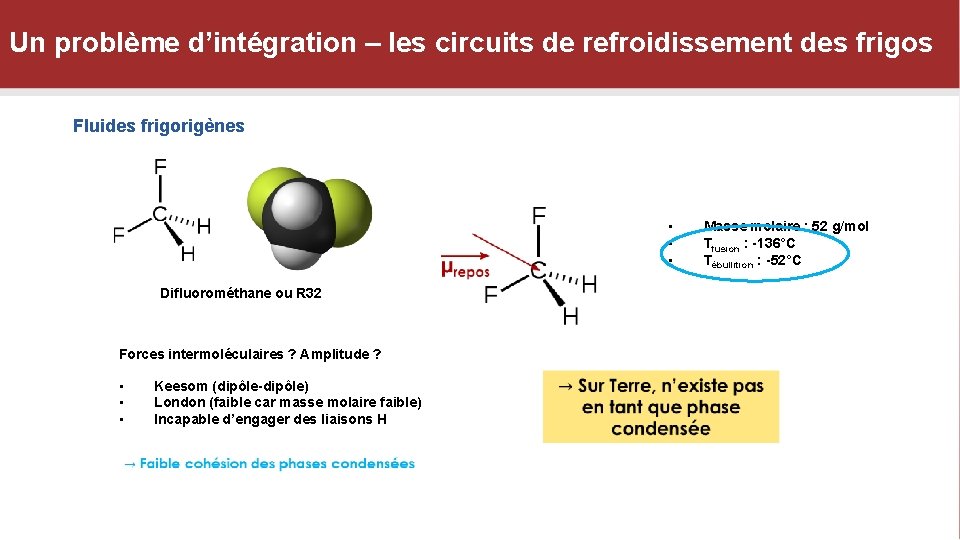
Un problème d’intégration – les circuits de refroidissement des frigos Fluides frigorigènes • • • Difluorométhane ou R 32 Forces intermoléculaires ? Amplitude ? • • • Keesom (dipôle-dipôle) London (faible car masse molaire faible) Incapable d’engager des liaisons H Masse molaire : 52 g/mol Tfusion : -136°C Tébullition : -52°C

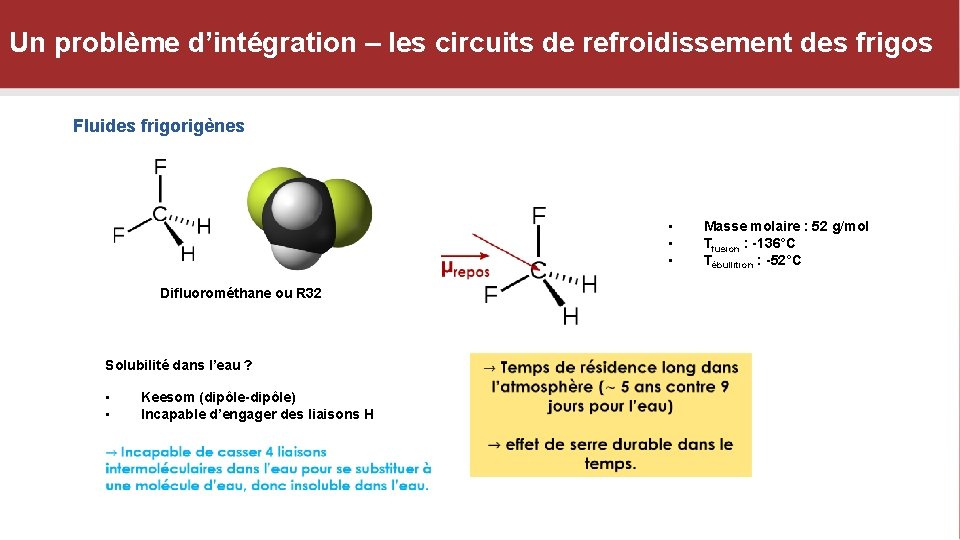
Un problème d’intégration – les circuits de refroidissement des frigos Fluides frigorigènes • • • Difluorométhane ou R 32 Solubilité dans l’eau ? • • Keesom (dipôle-dipôle) Incapable d’engager des liaisons H Masse molaire : 52 g/mol Tfusion : -136°C Tébullition : -52°C

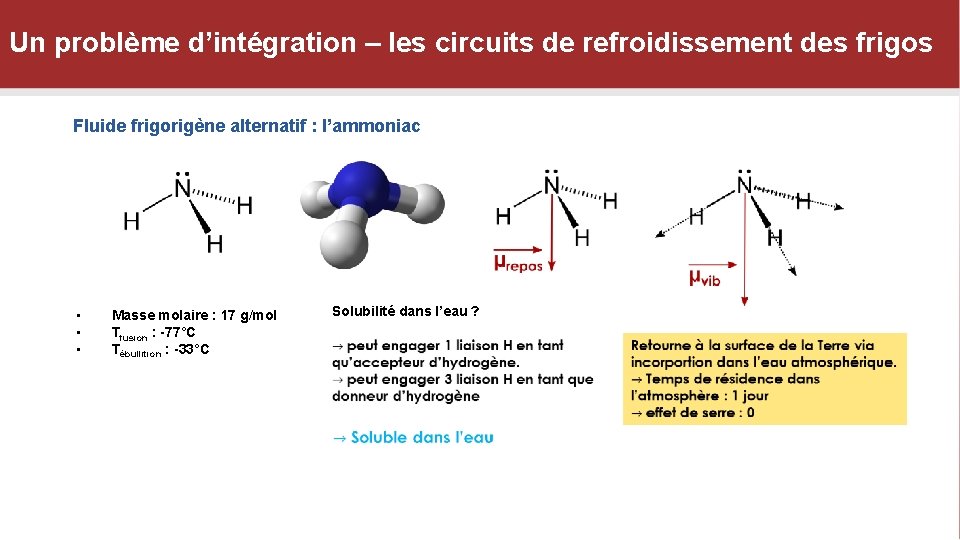
Un problème d’intégration – les circuits de refroidissement des frigos Fluide frigorigène alternatif : l’ammoniac • • • Masse molaire : 17 g/mol Tfusion : -77°C Tébullition : -33°C Solubilité dans l’eau ?
