Periodiske system Snak med sidemanden I skal skiftes





















- Slides: 27

Periodiske system

Snak med sidemanden I skal skiftes til at fortælle noget I ved om det periodiske system Noter omkring på arket

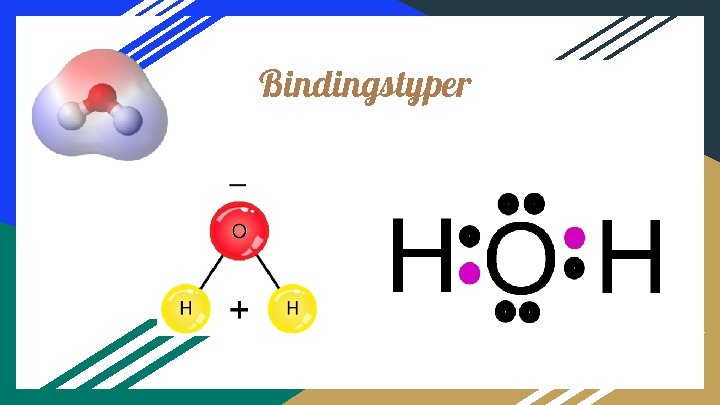
Bindingstyper

Dem vi arbejder med Ionbinding Kovalent binding (også kaldet elektronpar-binding) (Metalbindinger)

Oktet-reglen Det er elektronerne i atomernes yderste skal, der afgør, hvilke kemiske bindinger atomet kan danne. Atomerne vil helst have 8 elektroner i yderste skal (eller have fyldt deres yderste skal). Derfor forsøger de at lave bindinger, så de får 8 elektroner i yderste skal. Dette princip kaldes for oktet-reglen. Ædelgasser

Teori De forskellige grundstoffer har forskellig evne til at optage eller afgive elektroner. Nogle vil gerne optage elektroner for at få fyldt deres yderste skal, mens andre gerne vil afgive elektroner. Hvis de afgiver alle deres yderste elektroner til et andet atom, vil den næst-yderste elektronskal i stedet blive den yderste.

Ionbindinger Ved ionbindinger holdes atomerne sammen af elektriske kræfter mellem positive og negative ioner. Hvis ét atom meget gerne vil afgive én elektron, mens et andet atom meget gerne vil optage én elektron, kan elektronen flyttes helt fra et atom til et andet. Atomet, som afgiver elektronen, bliver positivt ladet, mens modtageren bliver negativt ladet.

Ionbindinger De forskellige ladninger gør, at atomerne bindes sammen, og at der opstår en ionbinding. Det kendes fx fra almindeligt bordsalt (Na. Cl). Her har natrium afgivet én elektron til chlor. Fordi ionbindinger danner salte, kaldes de også for saltbindinger. Ionbindinger er bindinger mellem metal og ikke-metal.

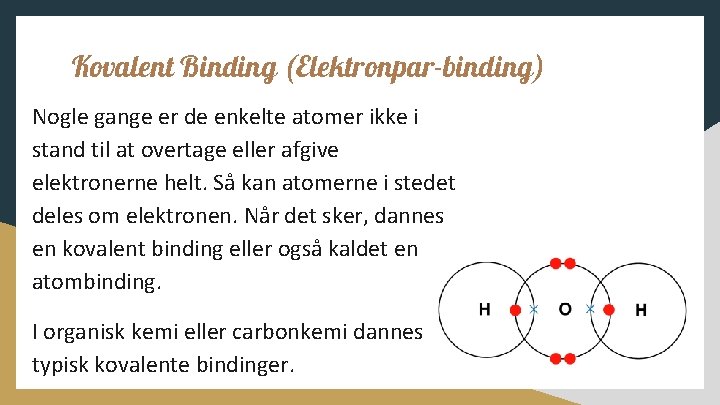
Kovalent Binding (Elektronpar-binding) Nogle gange er de enkelte atomer ikke i stand til at overtage eller afgive elektronerne helt. Så kan atomerne i stedet deles om elektronen. Når det sker, dannes en kovalent binding eller også kaldet en atombinding. I organisk kemi eller carbonkemi dannes typisk kovalente bindinger.

Forskellel mellem ionbinding og kovalent binding Ion-binding: afgiver/modtager Kovalentbinding: deler elektroner

polære kovalente bindinger Det findes to typer kovalente bindinger (elektronparbindinger). Den upolære kovalente binding , som forekommer mellem to atomer med samme elektronegativitet, og den polære kovalente binding som sker mellem to atomer med forskellig elektronegativitet. Forskellen mellem dem er, at molekylet til en polær kovalent binding danner et polært molekyle. De upolære og de polære bindinger kan heller ikke blandes sammen, men vil dele sig i lag. Man kan f. eks. prøve at blande benzin, som er upolært, med vand som er polært, så kan man se at benzinen bare vil ligge sig oven på vandet.

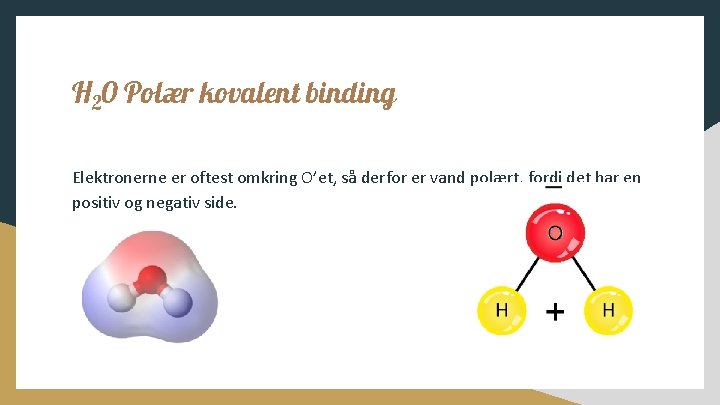
H 20 Polær kovalent binding Elektronerne er oftest omkring O’et, så derfor er vand polært, fordi det har en positiv og negativ side.

Metalbinding Den tiltrækkende kraft, som binder metallerne sammen, kaldes metalbindinger. Når metal-atomer binder sig til hinanden, som fx i et stykke jern, virker det som om, at de yderste elektroner ikke tilhører et specielt atom. De bevæger sig frit fra et atom til et andet. Det ser ud som om, at metaller er positive ioner, der er omgivet af en ”sø” af elektroner. Fordi elektronerne "flyder" rundt mellem metal-atomerne, er metaller gode til at lede varme og elektricitet.



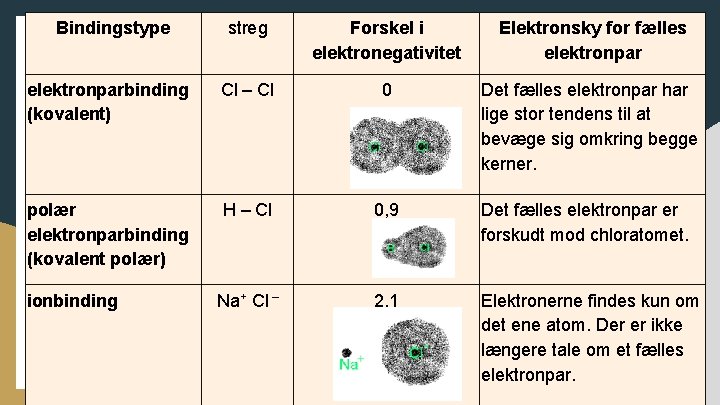
Bindingstype streg Forskel i elektronegativitet Elektronsky for fælles elektronparbinding (kovalent) Cl – Cl 0 Det fælles elektronpar har lige stor tendens til at bevæge sig omkring begge kerner. polær elektronparbinding (kovalent polær) H – Cl 0, 9 Det fælles elektronpar er forskudt mod chloratomet. Na+ Cl – 2, 1 Elektronerne findes kun om det ene atom. Der er ikke længere tale om et fælles elektronpar. ionbinding

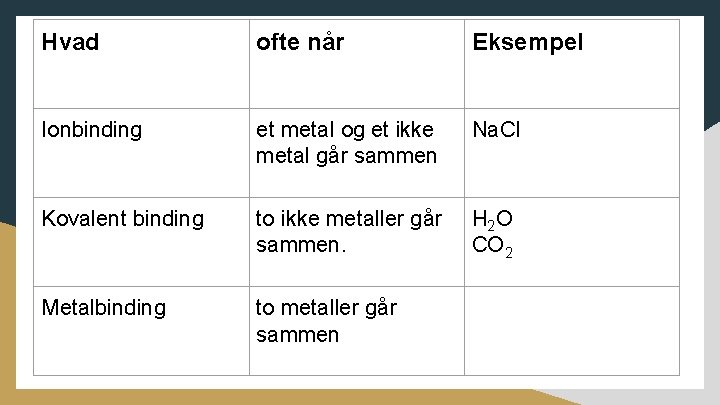
Hvad ofte når Eksempel Ionbinding et metal og et ikke metal går sammen Na. Cl Kovalent binding to ikke metaller går sammen. H 2 O CO 2 Metalbinding to metaller går sammen


Prikformler og reaktionsligninger

Afstemning af reaktionsligninger

CH 4 + O 2 +energi → CO 2 + H 2 O CH 4 + 2 O 2 +energi → CO 2 + 2 H 2 O

Cl + O 3 → Cl. O + O 2

H 2 3 H 2 + + N 2 → → NH 3 2 NH 3

NH 3 4 NH 3 + O 2 + 5 O 2 → → NO 4 NO + H 2 O + 6 H 2 O

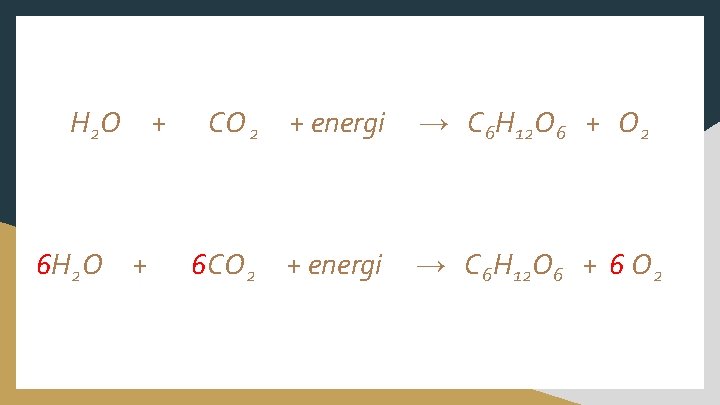
H 2 O 6 H 2 O + + CO 2 + energi → C 6 H 12 O 6 + O 2 6 CO 2 + energi → C 6 H 12 O 6 + 6 O 2

C 6 H 12 O 6 + O 2 → H 2 O C 6 H 12 O 6 + 6 O 2 → 6 H 2 O + CO 2 + 6 CO 2 + energi

Phet. colorado Søg på: phet kemi ligninger Derefter arbejde videre på papir.
 Hvor i det periodiske system står atomer med 5 skaller?
Hvor i det periodiske system står atomer med 5 skaller? Når skal man skrive tall med bokstaver
Når skal man skrive tall med bokstaver Periodiske system elektroner
Periodiske system elektroner ædelgasreglen
ædelgasreglen Tildeling af oxidationstal
Tildeling af oxidationstal 9 klasse pensum
9 klasse pensum Revm arapça tanımı
Revm arapça tanımı En dag skal vi alle dø
En dag skal vi alle dø Skala interwałowa
Skala interwałowa Hårførner
Hårførner Hvor skal vi sove i nat melodi
Hvor skal vi sove i nat melodi Hvad skal en opsigelse indeholde
Hvad skal en opsigelse indeholde Skal international
Skal international Parentetiske relativsætninger
Parentetiske relativsætninger Kippis englanniksi
Kippis englanniksi Tenn lys et lys skal brenne
Tenn lys et lys skal brenne Open closed and isolated system
Open closed and isolated system Circularory system
Circularory system Negativ potens
Negativ potens Multiplikation med parenteser
Multiplikation med parenteser Förenkla uttryck med parenteser
Förenkla uttryck med parenteser Y = -2x + 4
Y = -2x + 4 Hur många tändstickor i en ask
Hur många tändstickor i en ask Ana ascenção e silva
Ana ascenção e silva Träd rosa blommor
Träd rosa blommor Etiske utfordringer med velferdsteknologi
Etiske utfordringer med velferdsteknologi Ratio
Ratio Foca fakulteti
Foca fakulteti