Partie chimie Chapitre 1 Les proprits physiques de









- Slides: 14

Partie chimie Chapitre 1 : Les propriétés physiques de l’eau I. Les trois états physiques de l’eau 1. Comment se présente l’eau sur Terre ? II. Propriétés des trois états physiques de l'eau 1. Propriétés de l'eau à l'état liquide 2. Propriétés de l’eau à l’état solide 3. Propriétés de la vapeur d'eau III Apprendre à mesurer le Volume 1. « Les cubes russes » 2. Les unités de volume IV. Apprendre à mesurer la masse 1. Les unités de masse 2. Point méthode : les conversions

V Le cycle de l’eau 1. Organigramme des changements d'états physiques 2. Définitions des changements d'état 3. Comment identifier la présence d’eau? V Etude des changements d'état physiques 1. Etude de la vaporisation de l’eau a. Apport d’énergie b. Température d’ébullition 2. Etude de la solidification de l’eau a. La masse d’eau b. Le volume d’eau

Partie chimie PLAN 1 Chapitre 1 : Les propriétés physiques de l'eau I Les trois états physiques de l’eau 1. Comment se présente l’eau sur Terre ? L'eau est présente sur Terre sous trois états physiques : La glace : eau à l’ état solide ( iceberg, glacier, neige …) L'eau liquide : l'état liquide (rivière, océan, nuage, pluie …) La vapeur d'eau : l'état gazeux (dans l’atmosphère, elle est invisible) Aller voir activité N° 1 : Les trois états physiques de l’eau

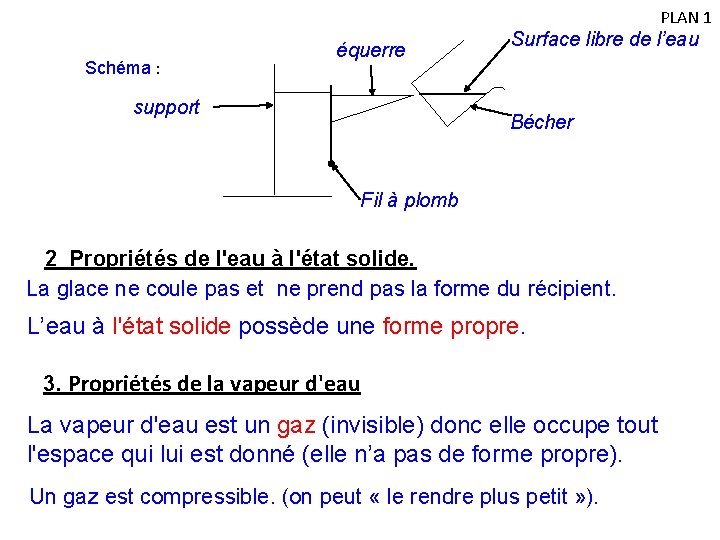
PLAN 1 II. Propriétés des trois états physiques de l'eau Aller voir activité N° 2 : Les propriétés des liquides 1. Propriétés de l'eau à l'état liquide L'eau liquide coule et prend toujours la forme du récipient qui la contient. L’eau à l'état liquide ne possède pas de forme propre. La surface libre de l'eau (au repos) est plane et horizontale.

PLAN 1 Schéma : équerre support Surface libre de l’eau Bécher Fil à plomb 2 Propriétés de l'eau à l'état solide. La glace ne coule pas et ne prend pas la forme du récipient. L’eau à l'état solide possède une forme propre. 3. Propriétés de la vapeur d'eau La vapeur d'eau est un gaz (invisible) donc elle occupe tout l'espace qui lui est donné (elle n’a pas de forme propre). Un gaz est compressible. (on peut « le rendre plus petit » ).

PLAN 1 III Apprendre à mesurer le Volume Aller voir activité N° 3 : Savoir mesurer le volume d'un liquide Conclusion : on mesure le volume d'un liquide à l'aide d'une éprouvette graduée. L’unité de l’éprouvette graduée est le millilitre. 1. « Les cubes russes » Sauter 12 cm pour coller les cubes russes lorsque je vous les aurai rendus. Ce qu'il faut retenir : 1 L = 1 dm 3 1 m. L = 1 cm 3 2. Les unités de volume

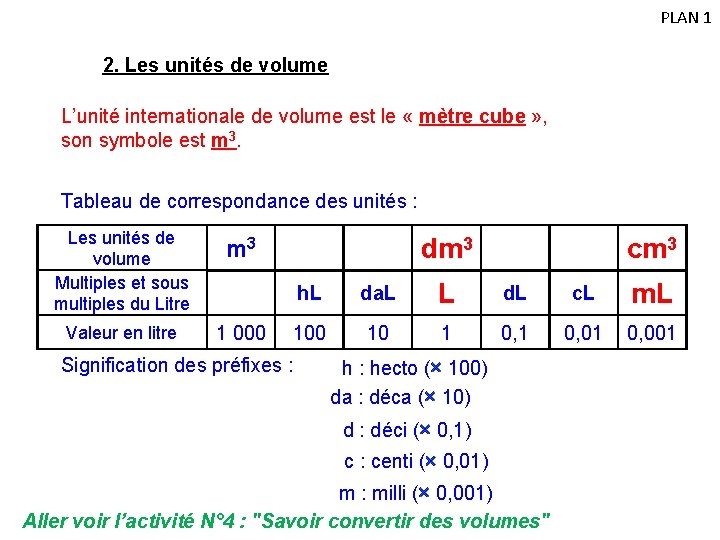
PLAN 1 2. Les unités de volume L’unité internationale de volume est le « mètre cube » , son symbole est m 3. Tableau de correspondance des unités : Les unités de volume Multiples et sous multiples du Litre m 3 Valeur en litre 1 000 dm 3 cm 3 h. L da. L L d. L c. L m. L 100 10 1 0, 01 0, 001 Signification des préfixes : h : hecto (× 100) da : déca (× 10) d : déci (× 0, 1) c : centi (× 0, 01) m : milli (× 0, 001) Aller voir l’activité N° 4 : "Savoir convertir des volumes"

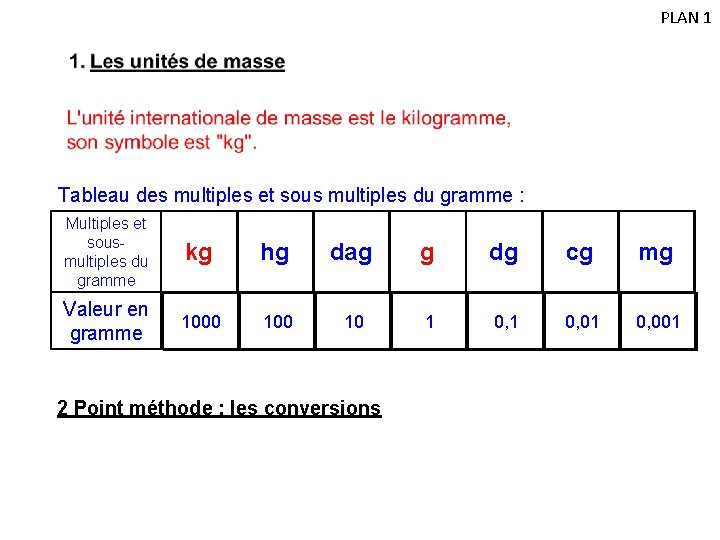
IV. Apprendre à mesurer la masse PLAN 1 Aller voir l’activité N° 5 : "Savoir mesurer la masse d'un solide ou d'un liquide" Conclusion: La masse se mesure à l'aide d'une balance. L’unité de la balance est le gramme. Un litre d'eau liquide a une masse de un kilogramme (1 m. L d'eau pèse donc 1 g). Remarque : Faire la tare permet de ne pas mesurer la masse du récipient vide. 1. Les unités de masse L'unité internationale de masse est le kilogramme, son symbole est "kg".

PLAN 1 Tableau des multiples et sous multiples du gramme : Multiples et sousmultiples du gramme kg hg dag g dg cg mg Valeur en gramme 1000 10 1 0, 01 0, 001 2 Point méthode : les conversions

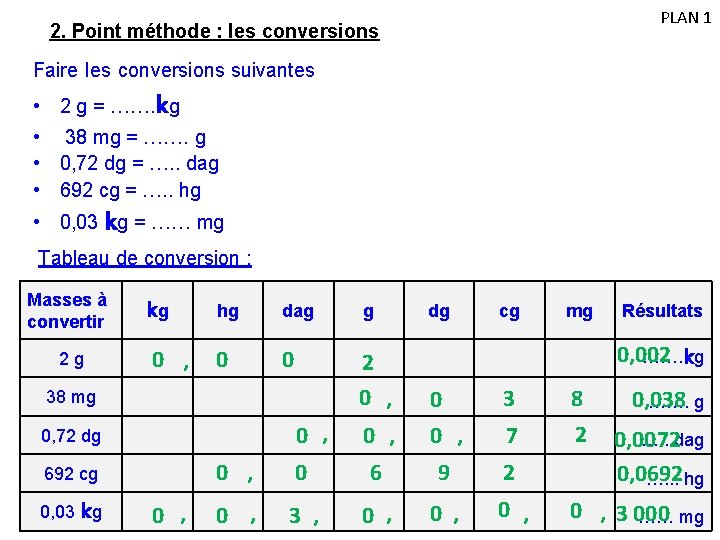
PLAN 1 2. Point méthode : les conversions Faire les conversions suivantes • 2 g = ……. kg • 38 mg = ……. g • 0, 72 dg = …. . dag • 692 cg = …. . hg • 0, 03 kg = …… mg Tableau de conversion : Masses à convertir 2 g kg 0 , hg dag g 0 0 2 0 , 0 3 8 0, 038 ……. g 0 , 7 2 0 , 0 6 9 2 …. . dag 0, 0072 0, 0692 …. . . hg 0 , 3 , 0 , 38 mg 0, 72 dg 692 cg 0, 03 kg 0 , dg cg mg Résultats 0, 002 ……. kg 0 , 3 000 …… mg

PLAN 2 V L’eau et ses changement d’état physique Aller voir l’activité : Le cycle de l’eau Conclusion : l’eau sur Terre change constamment d’état physique. 1. Organigramme des changements d'états physiques Etat solide fusion solidification Etat liquide vaporisation liquéfaction Etat gazeux

2. Définitions des changements d'état Solidification : Fusion : Vaporisation : Liquéfaction : PLAN 2 La solidification est le passage de l’état liquide à l’état solide. Verbe : se solidifier La fusion est le passage de l’état solide à l’état liquide. Verbe : fondre La vaporisation est le passage de l’état liquide à l‘état gazeux. Verbe : se vaporiser La liquéfaction est le passage de l’état gazeux à l’état liquide. Verbe : se liquéfier

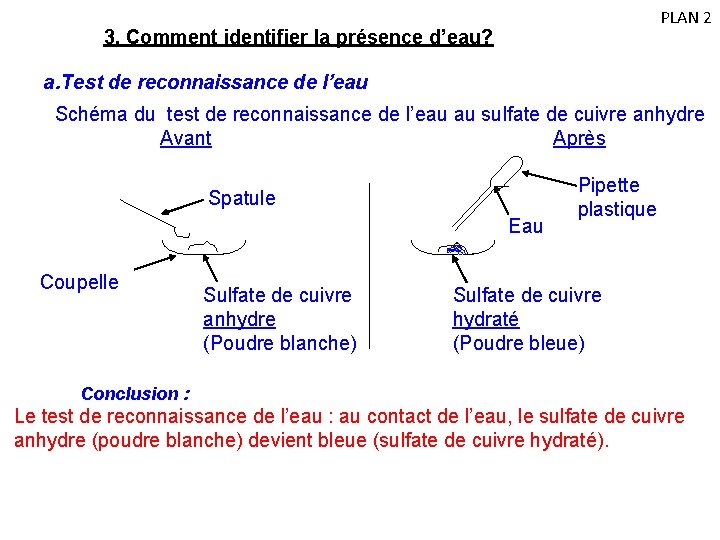
PLAN 2 3. Comment identifier la présence d’eau? a. Test de reconnaissance de l’eau Schéma du test de reconnaissance de l’eau au sulfate de cuivre anhydre Avant Après Spatule Eau Coupelle Sulfate de cuivre anhydre (Poudre blanche) Pipette plastique Sulfate de cuivre hydraté (Poudre bleue) Conclusion : Le test de reconnaissance de l’eau : au contact de l’eau, le sulfate de cuivre anhydre (poudre blanche) devient bleue (sulfate de cuivre hydraté).

PLAN 2 V Etude des changements d'état physiques 1. Etude de la vaporisation de l’eau a. Apport d’énergie Pour que l'eau se vaporise, il faut lui apporter de l'énergie en chauffant Le chauffage provoque l'augmentation de la température de l'eau liquide. b. Température d’ébullition A 100°C, l'eau se vaporise : sa température d’ébullition est donc 100°C. Tant qu'il reste de l'eau liquide, la température reste constante à 100°C. 2. Etude de la solidification de l’eau a. La masse d’eau La masse d'eau ne change pas lors d'un changement d'état de l'eau. b. Le volume d’eau Lorsque l’eau gèle, elle gonfle (son volume augmente). Lors d'un changement d'état le volume d’eau change.
 Chimie partie 2
Chimie partie 2 Proprits
Proprits Le petit prince résumé
Le petit prince résumé Le petit prince chapitre 24
Le petit prince chapitre 24 Lecture analytique petit pays chapitre 30
Lecture analytique petit pays chapitre 30 Tirez pas sur le scarabée résumé complet
Tirez pas sur le scarabée résumé complet Loi des proportions définies exemple
Loi des proportions définies exemple Chapitre 26 dernier jour d'un condamné
Chapitre 26 dernier jour d'un condamné Synecdoque et métonymie
Synecdoque et métonymie Région hypogastrique
Région hypogastrique Partie prenante management
Partie prenante management Fonction en escalier
Fonction en escalier Résumé route de chlifa
Résumé route de chlifa Partie de poisson
Partie de poisson 85
85