Organisk Spektroskopi Applied Spectroscopy KJM 3000 Vr 10















- Slides: 19

Organisk Spektroskopi Applied Spectroscopy KJM 3000 Vår 10 Kurset overlapper med KJ 220 og KJM 4000 Pensumbok : ”Introduction to Spectroscopy” by Pavia, Lampman, Kriz

Praktisk informasjon Kursansvarlig, foreleser og kollokvieansvarlig: Tore Hansen, rom Ø 303, torehans@kjemi. uio. no Forelesninger og kollokvier: Ø 316, ons/tor 12. 15 og 14. 15 Kommunikasjon vha e-mail og hjemmesiden. Ingen krav til oppmøte på kollokvier og forelesninger, men 80% av øvingsoppgavene må være innlevert og godkjent for å avlegge eksamen. Ingen karakter på øvingsoppgaver.

Mål : Studenten skal være istand til å bruke spektroskopiske metoder til å bestemme konstitusjonen av organiske molekyler. Plan: ca. 25 timer forelesning og ca. 40 timer kollokvier. Øvelse i anvendt bruk av metodene er vektlagt i forhold til teori. Siste kollokvie: tor 13. mai. Eksamen: torsdag 3. juni skriftlig 3 timer. Fire spektroskopiske metoder : UV/VIS, IR, NMR og MS. Disse metodene gir komplementær info, og til sammen er de et meget godt verktøy til identifikasjon og strukturoppklaring av små mengder (mg) av ukjente forbindelser.

Fremdriftsplan KJM 3000 -V 10 Uke ons tor 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 Gen IR 1/IR 2 IR 3/IR 4 NMR 1/NMR 2 NMR 5/NMR 6 NMR 9/NMR 10 K 3 K 5 MS 1/MS 2 K 7 påske K 9 K 11 K 13 K 15 K 17 K 19 UV 1/UV 2 K 1 K 2 NMR 3/NMR 4 NMR 7/NMR 8 NMR 11/NMR 12 K 4 K 6 MS 3/MS 4 K 8 påske K 10 K 12 K 14 K 16 K 18 K 20 Siste kollokvium: K 20, torsdag 13. mai Eksamen: 3. juni, kl. 14. 30, 3 timer skriftlig

Generelt Spektroskopi : Studie av vekselvirkning mellom elektromagnetisk stråling og materie (molekyler)

Elektromagnetisk stråling Elektromagnestisk stråling kan beskrives som : En bølgebevegelse • =c = bølgelengde, = frekvens, c = lyshastighet En partikkelbevegelse E=h • E = energi, = frekvens, h = Planck’s konstant

Ved å flytte om får man : = c/ Siden c = konstant, vil frekvens og bølgelende være omvendt proporsjonale. Dersom frekvensen på ”lyset” er den samme som frekvensen til en egenbevegelse av molekylet (f. eks. ) en vibrasjon) vil molekylet kunne absorbere energi. Vi sier da at ”lyset” og molekylets bevegelse er i resonans.

En egenbegelse i et molekyl kan f. eks. tilsvare vibrasjon av en binding. H Cl = 9 · 1013 s-1 Tilsvarer en frekvens og bølgelengde som svarer til elektromagnetisk stråling i IR-området.

Vekselvirkning mellom lys og materie generelt Et molekyl har mange stasjonære energinivåer (E). For hvert energinivå er det tilordnet en bølgefunksjon (Ψ). E 2 _______ Ψ 2 ΔE = E 1 – E 2 = hν E 1 _______ Ψ 1 Hvis vi belyser med en frekvens som tilsvarer ΔE kan molekylet absorbere energi og innta et høyere energinivå.

Emisjonsspektroskopi : Molekylet undergår en overgang fra et energinivå (E 2) til et lavere (E 1) og emiterer energiutbyttet i form av et lyskvant. E 2 _______ Ψ 2 ΔE = E 1 – E 2 = hν E 1 _______ Ψ 1 Absorbsjonsspektroskopi: Man måler lysmengden som absorberes som funksjon av lysets bølgelengde. Et lyskvant absorberes og molekylet undergår en overgang fra et energinivå (E 1) til et høyere (E 2).

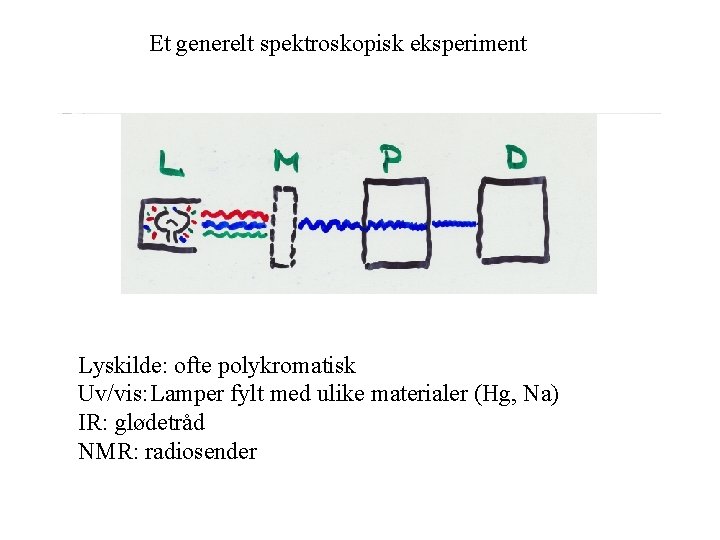
Et generelt spektroskopisk eksperiment Lyskilde: ofte polykromatisk Uv/vis: Lamper fylt med ulike materialer (Hg, Na) IR: glødetråd NMR: radiosender

Detektorer UV/VIS: fotomultiplikator, diode array IR: varmefølsom elektronisk komponent NMR: radiomottaker Energien som detekteres gjøres om til et spenningssignal og overføres til en pennskriver eller datamaskin. Et spektrum registreres ved å måle absorbans samtidig med at bølgelengden varieres (scanning).

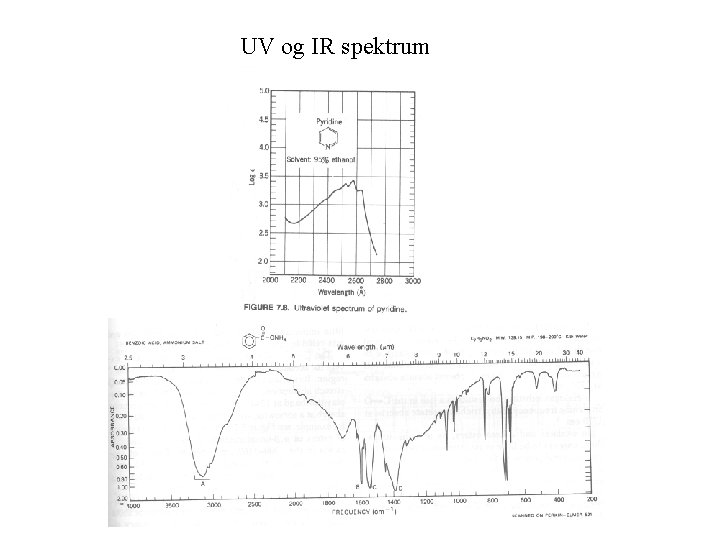
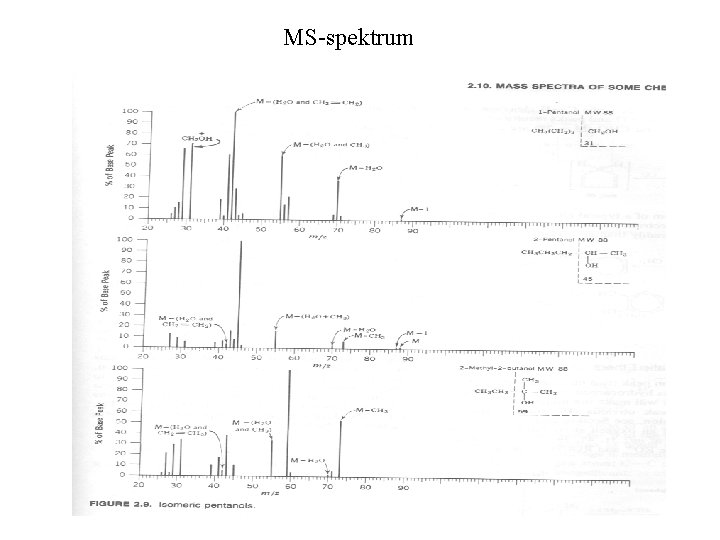
Fire metoder UV: 200 – 380 nm. Brukes til å primært detektere konjugerte systemer. Eksitering av elektroner i konjugerte systemer gir absorbans i dette området. IR: 4000 – 400 cm-1. Brukes til å detektere og identifisere vibrasjoner relatert til ulike funksjonelle grupper. NMR: Atomkjerner som absorberer radiobølger når de er plassert i et sterkt magnetfelt. MS: Måler masse/ladning forhold av organiske ioner

200 MHz NMR-instrument

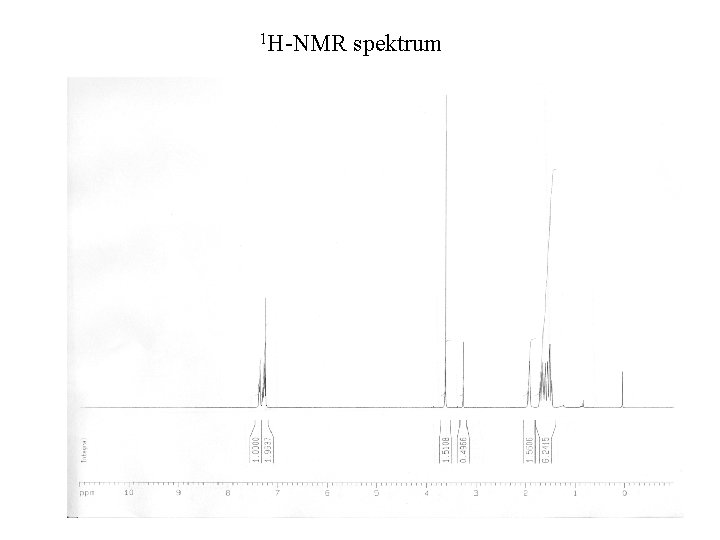
1 H-NMR spektrum

UV og IR instrumenter

UV og IR spektrum

MS-instrument i serie med GC

MS-spektrum
 Spektroskopi bintang
Spektroskopi bintang Ir spektroskopi
Ir spektroskopi Titan qui eut 3000 fils et 3000 filles
Titan qui eut 3000 fils et 3000 filles 3000+3000+2000
3000+3000+2000 Vekststrategi
Vekststrategi Ansoff vækstmatrice
Ansoff vækstmatrice Organisk dyspepsi
Organisk dyspepsi Organisk hallucinos
Organisk hallucinos Karboxylsyra
Karboxylsyra Isosbestic point
Isosbestic point Slit spectroscopy
Slit spectroscopy Lambert beer law and its limitations
Lambert beer law and its limitations Spectroscopy
Spectroscopy Uv visible spectroscopy introduction
Uv visible spectroscopy introduction Atomic fluorescence spectroscopy principle
Atomic fluorescence spectroscopy principle Theory of atomic absorption spectroscopy
Theory of atomic absorption spectroscopy Flame aas
Flame aas Spectroscopy problem set
Spectroscopy problem set Spectroscopy and its types
Spectroscopy and its types Spectroscopy
Spectroscopy