Les ractions en solutions Retour sur les tats












- Slides: 15

Les réactions en solutions

Retour sur les états de la matière Les états condensés trouvent leur origine dans l’agrégation des molécules. Cette cohésion résulte des interactions intermoléculaires L’agitation des molécules s’oppose à cette cohésion. Celle-ci est de nature thermique et confère la mobilité aux molécules. Forces de cohésion >> Agitation thermique Etat Solide Rigidité Positions fixes Forces de cohésion << Agitation thermique Etat Gazeux mouvements libres Forces de cohésion Agitation thermique Etat Liquide Fluidité Positions libres, mobilité restreinte

Les corps en solution. Quelques faits d ’expérience: . . . Introduisent les notions de: Corps solubles Electrolytes Dissolution H 2 O, C 6 H 12 O 6, Na. Cl, Ag. Cl, CH 3 COOH, . . . insolubles non-électrolytes Dissociation Electrolyse

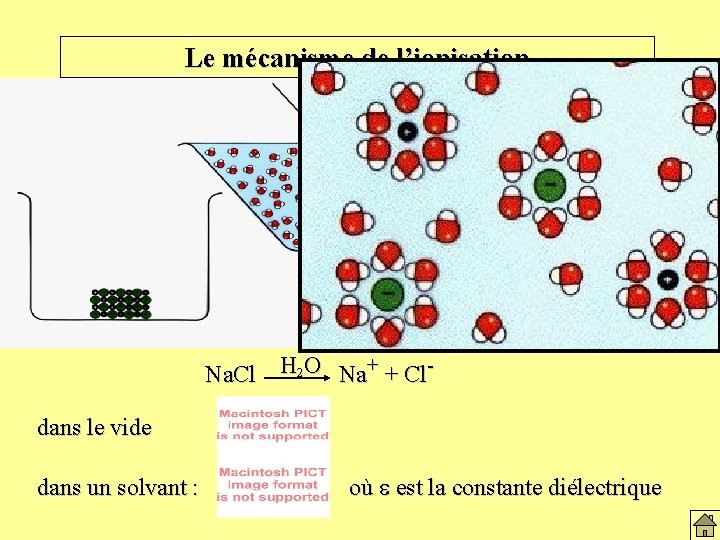
Le mécanisme de l’ionisation Na. Cl H 2 O Na+ + Cldans le vide dans un solvant : où e est la constante diélectrique

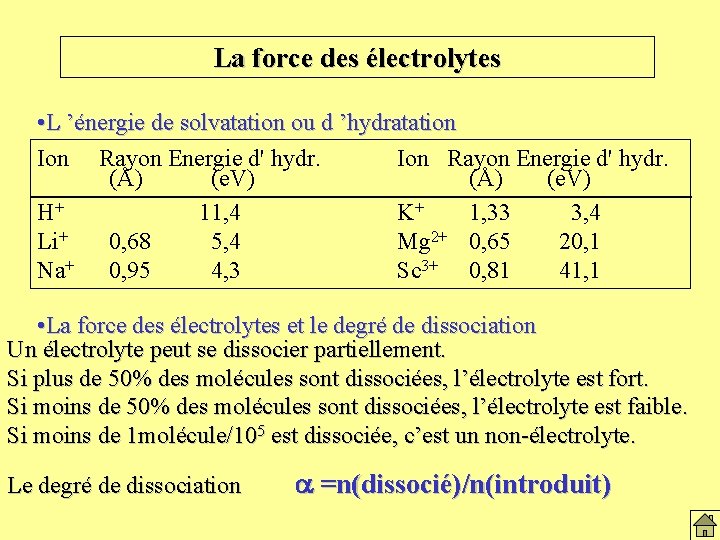
La force des électrolytes • L ’énergie de solvatation ou d ’hydratation Ion Rayon Energie d' hydr. (Å) (e. V) H+ 11, 4 K+ 1, 33 3, 4 Li+ 0, 68 5, 4 Mg 2+ 0, 65 20, 1 Na+ 0, 95 4, 3 Sc 3+ 0, 81 41, 1 • La force des électrolytes et le degré de dissociation Un électrolyte peut se dissocier partiellement. Si plus de 50% des molécules sont dissociées, l’électrolyte est fort. Si moins de 50% des molécules sont dissociées, l’électrolyte est faible. Si moins de 1 molécule/105 est dissociée, c’est un non-électrolyte. Le degré de dissociation a =n(dissocié)/n(introduit)

La force des électrolytes Pour CH 3 COOH, seules 3 molécules sur 1000 se dissocient: a=0, 003 CH 3 COOH CH 3 COO- + H + La pesée d ’une mole à mettre en solution Solution 1 M en Ac. OH, La Concentration engagée C vaut 1 M=1 mol/l En fait, la solution contient 0, 997 CH 3 COOH et 0, 003 CH 3 COO- et H+ La Concentration à l’équilibre [CH 3 COOH] = 0, 997 mol/l et [CH 3 COO- ] = [H+] 0, 003 mol/l Il faut donc distinguer ces deux concentrations: [CH 3 COOH] = C*(1 -a) et [CH 3 COO- ] = [H+] = CF*a

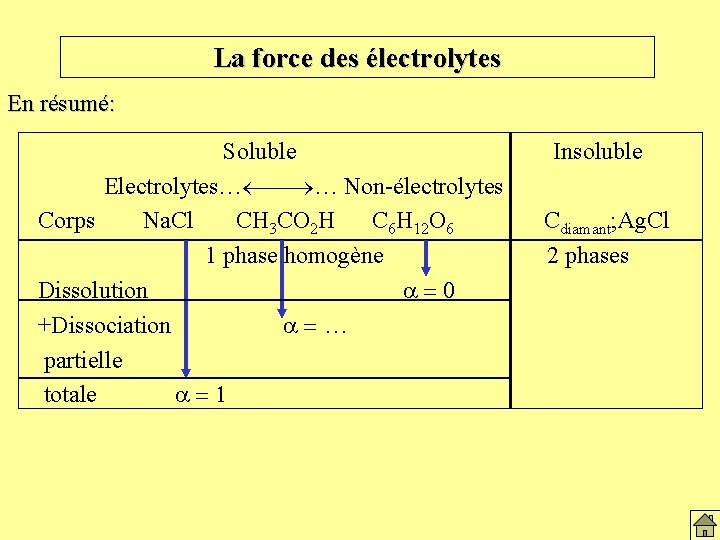
La force des électrolytes En résumé: Soluble Electrolytes… ¾ … Non-électrolytes Corps Na. Cl CH 3 CO 2 H C 6 H 12 O 6 1 phase homogène Dissolution a=0 +Dissociation a=… partielle totale a=1 Insoluble Cdiamant; Ag. Cl 2 phases

Les grands types de réaction • Les réactions de précipitation • Les réactions Acides / Bases • Les réactions d ’oxydo-réduction • Les réactions de complexation

Les Réactions d ’oxydo-réduction On observe une variation du Nombre d’Oxydation des éléments dans diverses réactions : Ce sont les Réactions d’oxydo-réduction. Une oxydation est une transformation dans laquelle N. O. Elle s’accompagne d’une perte d’électrons: Cu 2+ + 2 e. Une réduction est une transformation dans laquelle N. O. Elle s’accompagne d’un gain d’électrons: Cl 2 + 2 e- 2 Cl Un oxydant est un réactif qui provoque l’oxydation. Il sera donc capteur d’électrons et subira la réduction. Exemple: Cl 2 Un réducteur est un réactif qui provoque la réduction. Il sera donc donneur d’électrons et subira l’oxydation. Exemple: Cu

Les Réactions d ’oxydo-réduction Les réactions sont inversibles. Donc à chaque oxydant est associé un réducteur et inversement. Oxydants: Cu 2+, Cl 2 Réducteurs: Cu, Cl. On forme ainsi des couples redox associant forme oxydée et forme réduite On écrira donc : Cu 2+ + 2 e- Cu Cl 2 + 2 e- 2 Cl Ox + ne- Red Ces couples se représentent sous le forme: Cl 2/Cl-, Cu 2+/Cu, H+/H 2 La forme oxydée apparaissant en tête du couple Ox/Red, La réaction d’oxydo-réduction résulte de l’échange d’électrons entre deux couples, l’un agissant comme oxydant, l’autre comme réducteur.

Les Réactions d ’oxydo-réduction La réaction d’oxydo-réduction résulte de l’échange d’électrons entre deux couples, l’un agissant comme oxydant, l’autre comme réducteur. Cu 2+ + 2 e. Cl 2 + 2 e- 2 Cl - I II Cl 2 + Cu 2++ 2 Cl- Cu. Cl 2 Ox 1 + Red 2 Ox 2 + Red 1 I et II sont des demi-réactions Un autre exemple 2 Fe. SO 4 + 2 Ce(SO 4)2 ¾¾ Fe 2(SO 4)3 + Ce 2(SO 4)3 L'oxydation Fe 2+ ¾¾ Fe 3+ + e- La réduction Ce 4+ + e- ¾¾ Ce 3+

Les Réactions d ’oxydo-réduction 2 Fe. SO 4 + 2 Ce(SO 4)2 ¾¾ Fe 2(SO 4)3 + Ce 2(SO 4)3 (I) Mais aussi: Fe 2(SO 4)3 + Sn. SO 4 ¾¾ 2 Fe. SO 4 + Sn(SO 4)2 (II) L'oxydation Sn 2+ ¾¾ Sn 4+ + 2 e(a) La réduction Fe 3+ + e¾¾ Fe 2+ (b) au total: (a) + 2(b) Sn 2+ + 2 Fe 3+ ¾¾ Sn 4+ + 2 Fe 2+ Le Fe s’oxyde dans I et se réduit dans II. Conclusion: Ce est un oxydant plus fort que Fe, mais Fe est plus fort que Sn. Par comparaison, on peut classer les oxydants. Oxydant fort… Ce+4/Ce+3 > Fe+3/Fe+2 > Sn+4/Sn+2 …Oxydant faible.

Les règles d’écriture 1) Identification des réactifs et produits et détermination des nombres d'oxydation des atomes. 2) Identification des oxydant et réducteur par analyse de la variation des nombres d'oxydation. 3) Ecriture des demi-réactions sans coefficients, mais avec l'échange d'électrons. Pour chaque demi-réaction: a) obtention du bilan de charge. b) obtention du bilan de masse. 4) Normalisation du nombre d'électrons impliqués dans les demiréactions. 5) Addition des demi-réactions normalisées pour obtenir la réaction totale. 6) S'il y a lieu, obtention de la réaction moléculaire par neutralisation des charges résiduelles et formation des molécules neutres.

Quelques exemples supplémentaires a) S + O 2 ¾¾ SO 2 Réducteur Oxydant (III) S ¾¾ S 4+ + 4 e. O 2 + 4 e- ¾¾ 2 O 2 S + O 2 ¾¾ SO 2 b) 2 Fe. Cl 2 + Cl 2 ¾¾ 2 Fe. Cl 3 Réducteur Oxydant (IV) [ Fe 2+ ¾¾ Fe 3+ + e- ]*2 Cl 2 + 2 e- ¾¾ 2 Cl- 2 Fe 2+ + Cl 2 + 4 Cl- ¾¾ 2 Fe 3+ + 6 Cl 2 Fe. Cl 2 + Cl 2 ¾¾ 2 Fe. Cl 3

Quelques exemples supplémentaires c) H 2 S + Na. Cl. O ¾¾ H 2 O + Na. Cl + S Réducteur Oxydant S 2 - ¾¾ S 0 + 2 e. Cl. O- + 2 e- + 2 H+ ¾¾ Cl- + H 2 O d) Fe. SO 4 + KMn. O 4 ¾¾ Fe 2(SO 4)3 +Mn. SO 4 Oxydant Réducteur (V) (VI) Mn. O 4 - + 5 e- + 8 H+ ¾¾ Mn 2+ + 4 H 2 O [ Fe 2+ ¾¾ Fe 3+ + e- ]*5 (a) (b) 5 Fe 2+ + Mn. O 4 - + 8 H+ ¾¾ 5 Fe 3+ + Mn 2+ + 4 H 2 O 10 Fe. SO 4 + 2 KMn. O 4 + 8 H 2 SO 4 ¾¾ 5 Fe 2(SO 4)3 +K 2 SO 4 +2 Mn. SO 4+ 8 H 2 O
 Profil réactionnel
Profil réactionnel Allez vous en sur les places et sur les parvis
Allez vous en sur les places et sur les parvis Tit for two tats
Tit for two tats Catherine tats
Catherine tats Avantages de la gestion axée sur les résultats
Avantages de la gestion axée sur les résultats Chanson les cigognes sont de retour
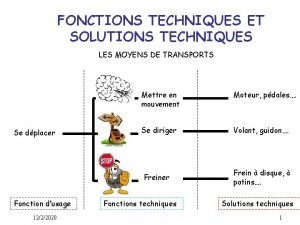
Chanson les cigognes sont de retour Fonctions techniques
Fonctions techniques Titrage indirect exemple
Titrage indirect exemple Caselin
Caselin Retour sommaire
Retour sommaire Veinomotricité
Veinomotricité Ketel
Ketel Les femmes sont sur la terre victor hugo
Les femmes sont sur la terre victor hugo Les femmes sont sur la terre
Les femmes sont sur la terre Victor hugo introduction
Victor hugo introduction Exemple dossier oral brevet
Exemple dossier oral brevet