Leis Ponderais Apostila 3 Setor 532 mdulo 11









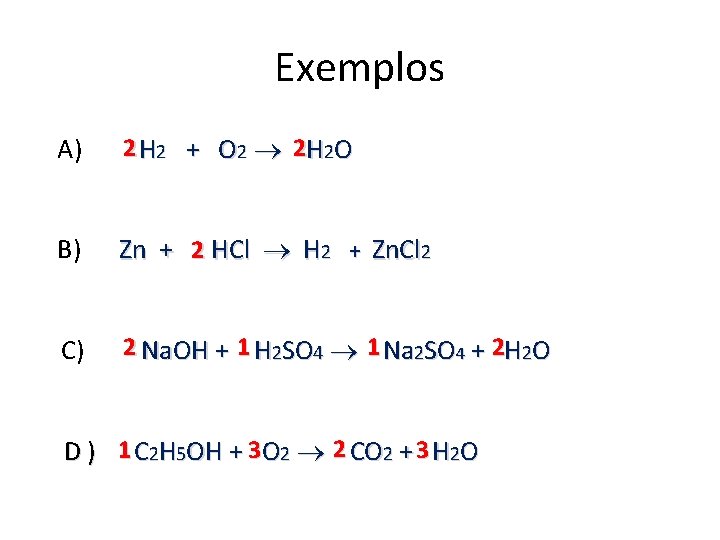





- Slides: 21

Leis Ponderais Apostila 3 – Setor 532 –módulo 11 página 369

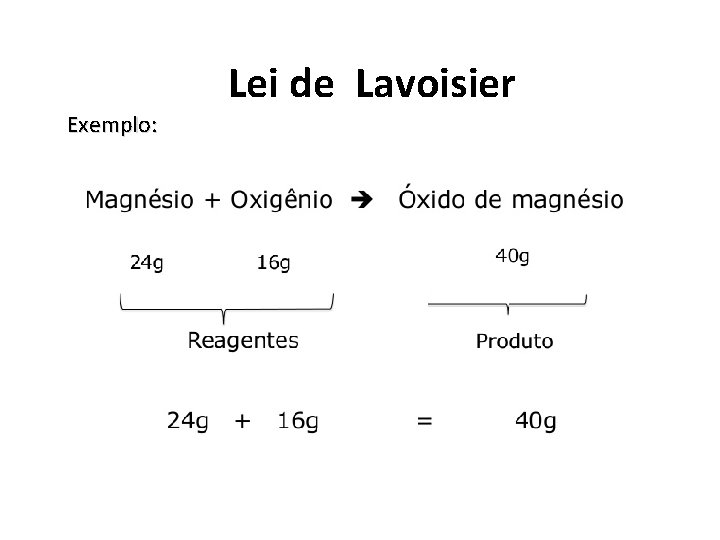
Lei de Lavoisier Ø Lei de Conservação das Massas. Quando uma reação é realizada em sistema fechado a massa sempre é conservada Ou seja: Ø A soma das massas das substâncias reagentes é igual à soma das massas dos produtos da reação.

Exemplo: Lei de Lavoisier

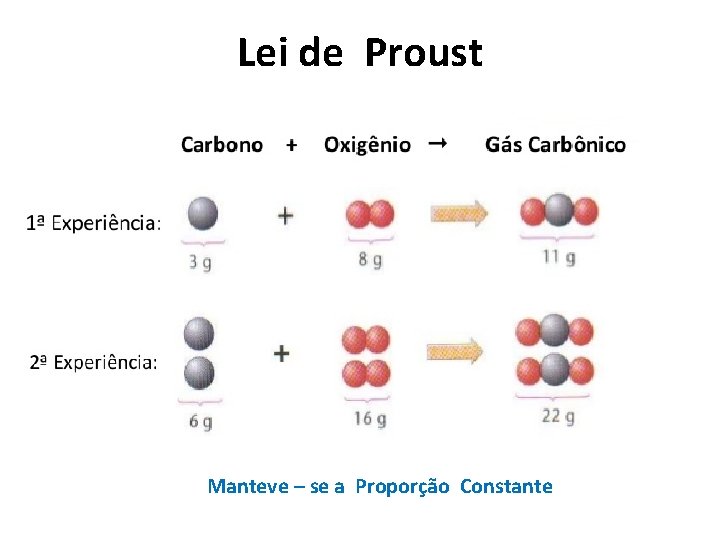
Lei de Proust Ø Lei das proporções definidas. As substâncias reagem sempre na mesma proporção para formar outra substância. Ou seja: Ø Em uma reação química, a relação entre as massas das substâncias participantes é sempre constante.

Lei de Proust Manteve – se a Proporção Constante

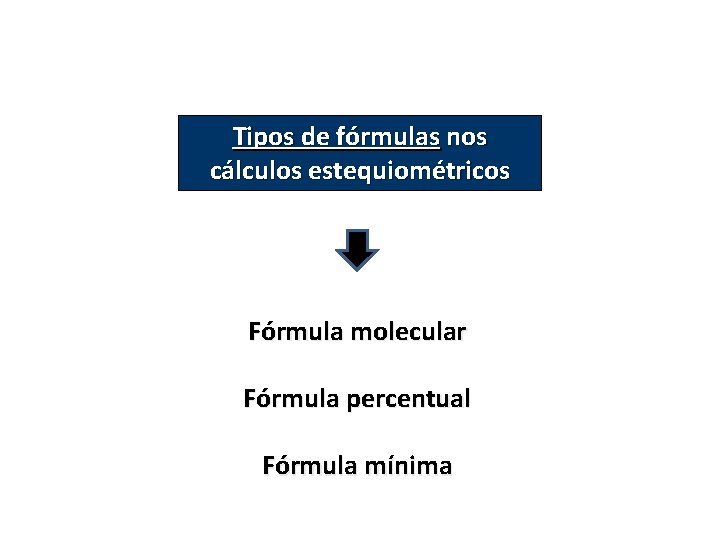
Fórmulas Químicas

QUÍMICA, 2º Ano do Ensino Médio Cálculos estequiométricos: fórmula percentual e fórmula mínima. Tipos de fórmulas nos cálculos estequiométricos Fórmula molecular Fórmula percentual Fórmula mínima

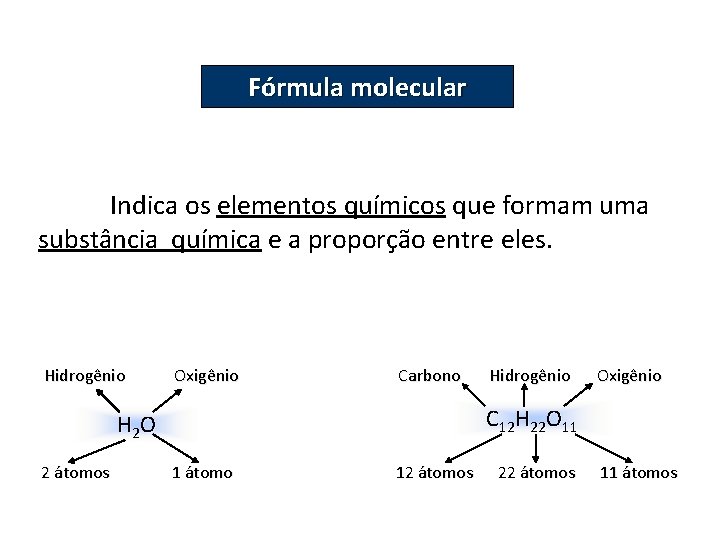
QUÍMICA, 2º Ano do Ensino Médio Cálculos estequiométricos: fórmula percentual e fórmula mínima. Fórmula molecular Indica os elementos químicos que formam uma substância química e a proporção entre eles. Hidrogênio Oxigênio Carbono Oxigênio C 12 H 22 O 11 H 2 O 2 átomos Hidrogênio 1 átomo 12 átomos 22 átomos 11 átomos

QUÍMICA, 2º Ano do Ensino Médio Cálculos estequiométricos: fórmula percentual e fórmula mínima Fórmula Percentual A fórmula percentual ou centesimal indica a massa de cada elemento químico que existe em 100 partes de massa da substância, ou seja, indica a porcentagem em massa do elemento na substância.

Exemplo O metano é um gás incolor, sua molécula é tetraédrica e apolar, de pouca solubilidade na água e, quando adicionado ao ar, transforma -se em mistura de alto teor inflamável. Sabendo que sua fórmula molecular é CH 4 e que as massas atômicas do carbono e do hidrogênio são, respectivamente, 12 e 1, qual sua fórmula percentual?

QUÍMICA, 2º Ano do Ensino Médio Cálculos estequiométricos: fórmula percentual e fórmula mínima. Fórmula Mínima A fórmula mínima ou empírica indica a proporção mínima, em números inteiros, dos átomos de cada elemento químico em uma molécula da substância.

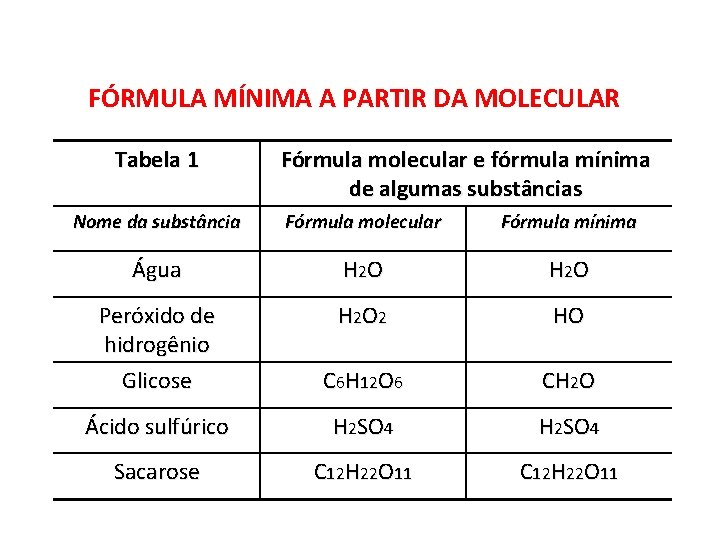
QUÍMICA, 2º Ano do Ensino Médio Cálculos estequiométricos: fórmula percentual e fórmula mínima. FÓRMULA MÍNIMA A PARTIR DA MOLECULAR Tabela 1 Fórmula molecular e fórmula mínima de algumas substâncias Nome da substância Fórmula molecular Fórmula mínima Água H 2 O Peróxido de hidrogênio Glicose H 2 O 2 HO C 6 H 12 O 6 CH 2 O Ácido sulfúrico H 2 SO 4 Sacarose C 12 H 22 O 11

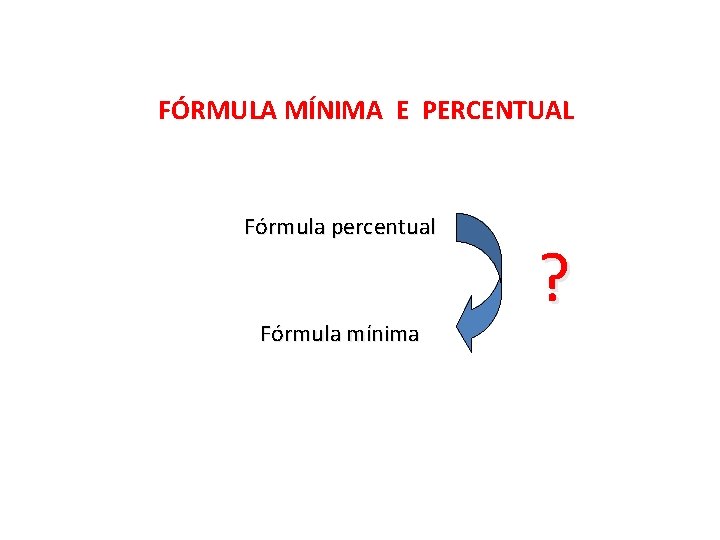
QUÍMICA, 2º Ano do Ensino Médio Cálculos estequiométricos: fórmula percentual e fórmula mínima FÓRMULA MÍNIMA E PERCENTUAL Fórmula percentual Fórmula mínima ?

Exemplo Calcule a fórmula mínima de um composto que apresenta 43, 4% de sódio, 11, 3% de carbono e 45, 3% de oxigênio (massas atômicas: Na = 23, C = 12, O = 16).

Balanceamento de Equações – Método das tentativas
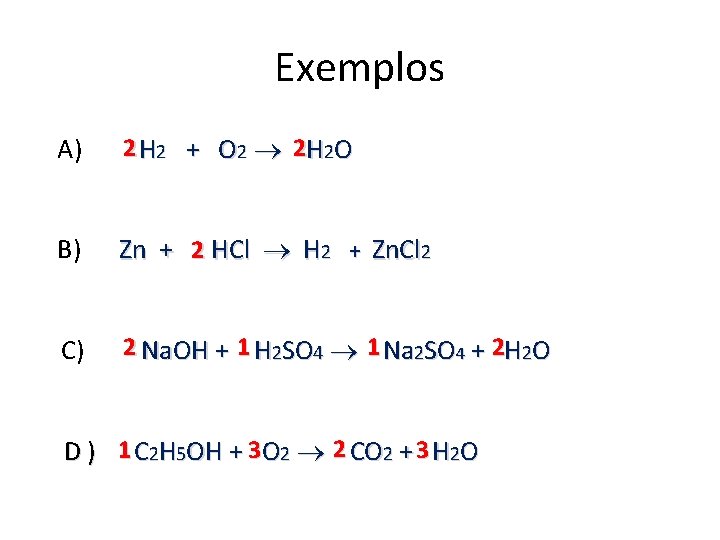
Exemplos A) 2 H 2 + O 2 2 H 2 O B) Zn + 2 HCl H 2 + Zn. Cl 2 C) 2 Na. OH + 1 H 2 SO 4 1 Na 2 SO 4 + 2 H 2 O D ) 1 C 2 H 5 OH + 3 O 2 2 CO 2 + 3 H 2 O

Exercícios – página 369




Bons Estudos
 Lei
Lei Leis ponderais e balanceamento
Leis ponderais e balanceamento Lavoisier lei
Lavoisier lei Mdulo
Mdulo Apostila unip
Apostila unip Regra do paralelogramo vetores exercícios
Regra do paralelogramo vetores exercícios Contabilidade do terceiro setor
Contabilidade do terceiro setor Exercícios de coesão referencial 7 ano com gabarito
Exercícios de coesão referencial 7 ano com gabarito Pastoral familiar casos especiais
Pastoral familiar casos especiais Uma chapa com forma de um setor de raio 20 cm
Uma chapa com forma de um setor de raio 20 cm Setor primario secundario e terciario
Setor primario secundario e terciario Area do setor circular
Area do setor circular Setor primario da economia no brasil
Setor primario da economia no brasil O que é setor quinario
O que é setor quinario Setor primario secundario e terciario
Setor primario secundario e terciario Formula do setor circular
Formula do setor circular Carlos alberto calixto mattar
Carlos alberto calixto mattar Ese 532
Ese 532 Sda hymn 532
Sda hymn 532 Unrollk
Unrollk Ese 532
Ese 532 Ese 532
Ese 532