MODELOS ATMICOS APOSTILA 1 SETOR 531 MDULOS 1











- Slides: 27

MODELOS ATÔMICOS APOSTILA 1 –SETOR 531 MÓDULOS 1 E 2 PÁGINA 346 E 348

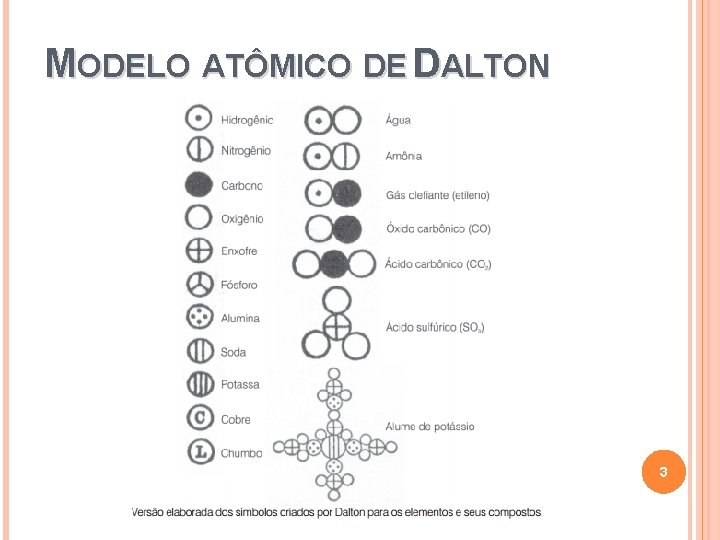
MODELO ATÔMICO DE DALTON ü A matéria é formada por partículas extremamente pequenas chamadas átomos; üOs átomos são esferas maciças e indivisíveis; üModelo da bola de bilhar üOs átomos com as mesmas constituem um elemento químico; propriedades, üElementos diferentes são constituídos por átomos com propriedades diferentes. üAs reações químicas são rearranjos, união e separação, de átomos. 2

MODELO ATÔMICO DE DALTON 3

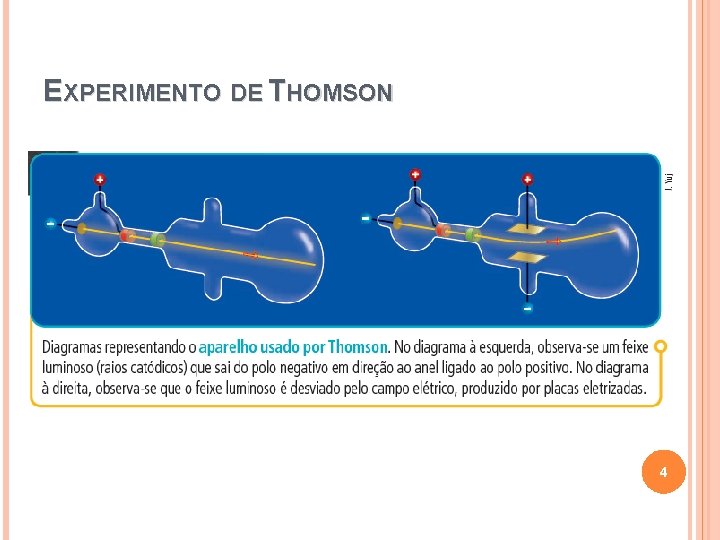
EXPERIMENTO DE THOMSON 4

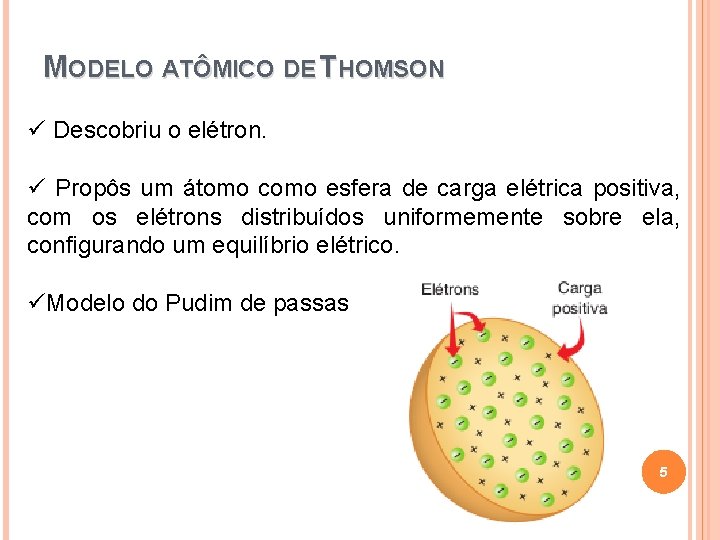
MODELO ATÔMICO DE THOMSON ü Descobriu o elétron. ü Propôs um átomo como esfera de carga elétrica positiva, com os elétrons distribuídos uniformemente sobre ela, configurando um equilíbrio elétrico. üModelo do Pudim de passas 5

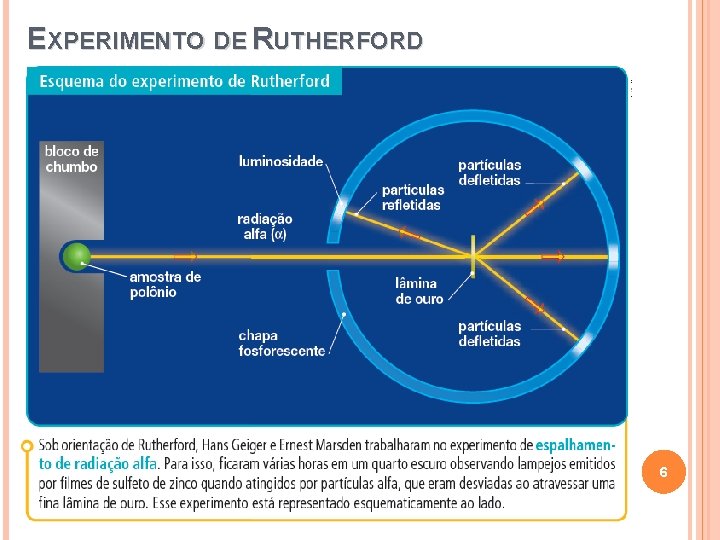
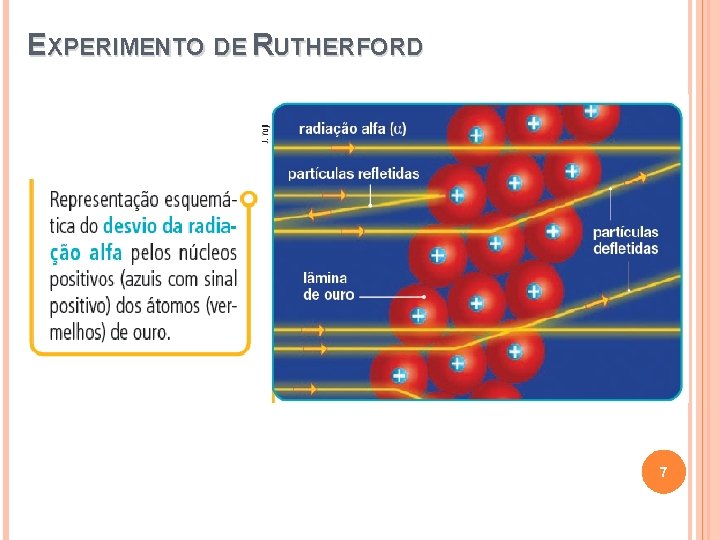
EXPERIMENTO DE RUTHERFORD 6

EXPERIMENTO DE RUTHERFORD 7

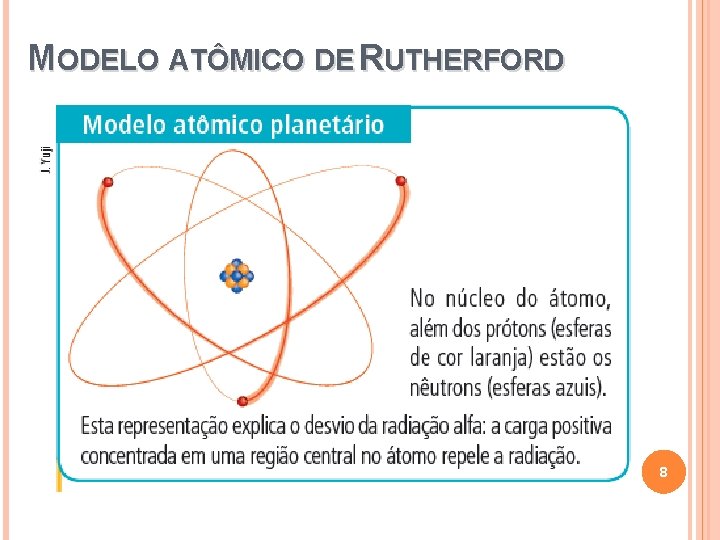
MODELO ATÔMICO DE RUTHERFORD 8

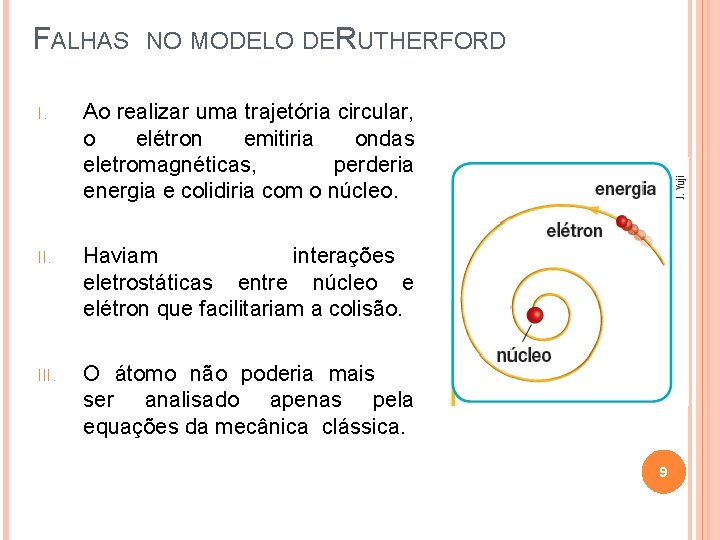
FALHAS NO MODELO DERUTHERFORD I. Ao realizar uma trajetória circular, o elétron emitiria ondas eletromagnéticas, perderia energia e colidiria com o núcleo. II. Haviam interações eletrostáticas entre núcleo e elétron que facilitariam a colisão. III. O átomo não poderia mais ser analisado apenas pela equações da mecânica clássica. 9

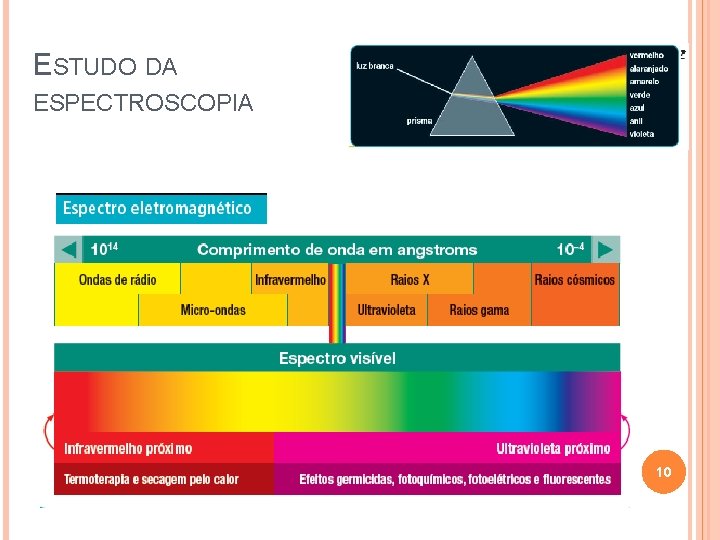
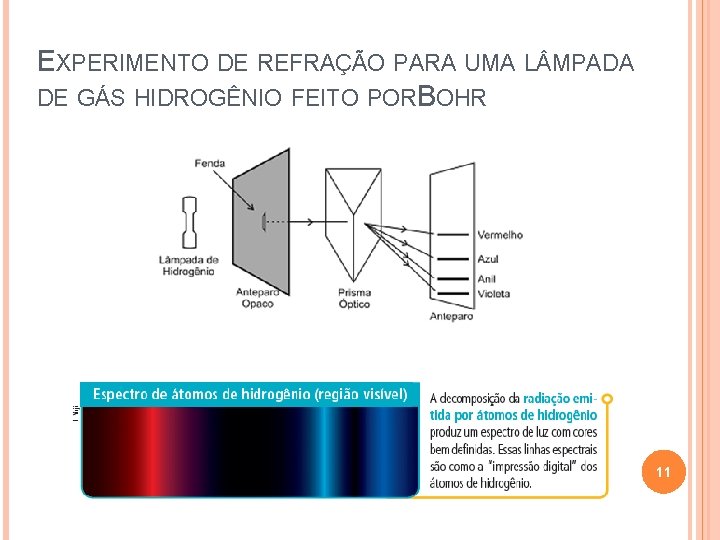
ESTUDO DA ESPECTROSCOPIA 10

EXPERIMENTO DE REFRAÇÃO PARA UMA L MPADA DE GÁS HIDROGÊNIO FEITO PORBOHR 11

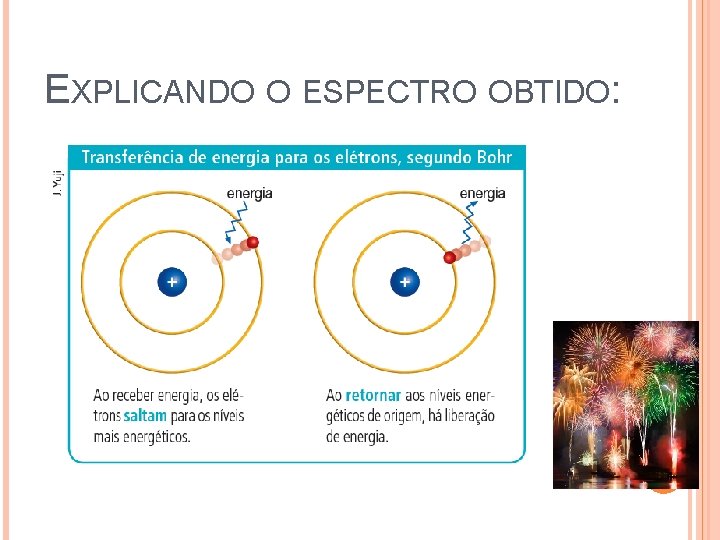
EXPLICANDO O ESPECTRO OBTIDO: 12

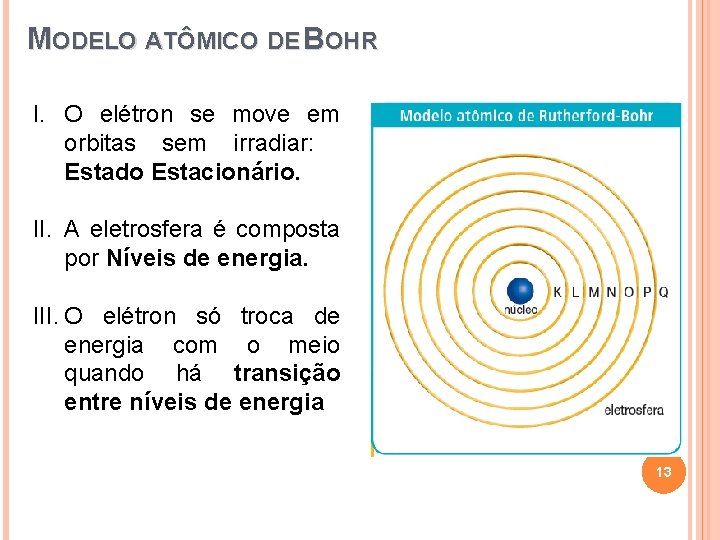
MODELO ATÔMICO DE BOHR I. O elétron se move em orbitas sem irradiar: Estado Estacionário. II. A eletrosfera é composta por Níveis de energia. III. O elétron só troca de energia com o meio quando há transição entre níveis de energia 13

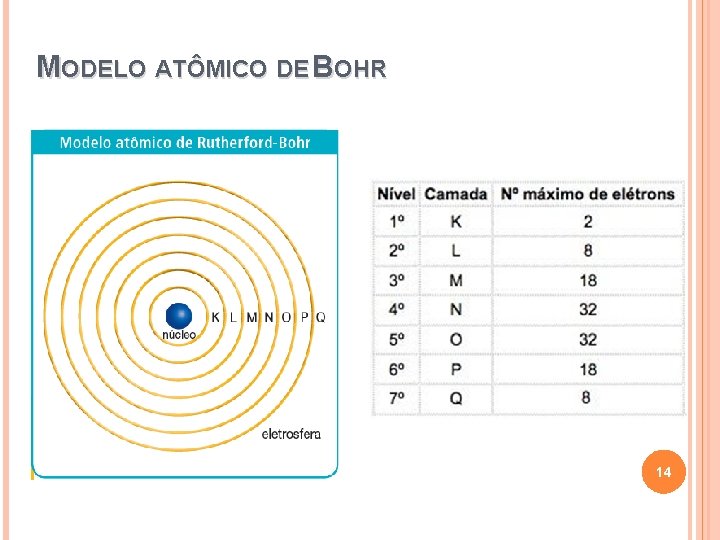
MODELO ATÔMICO DE BOHR 14

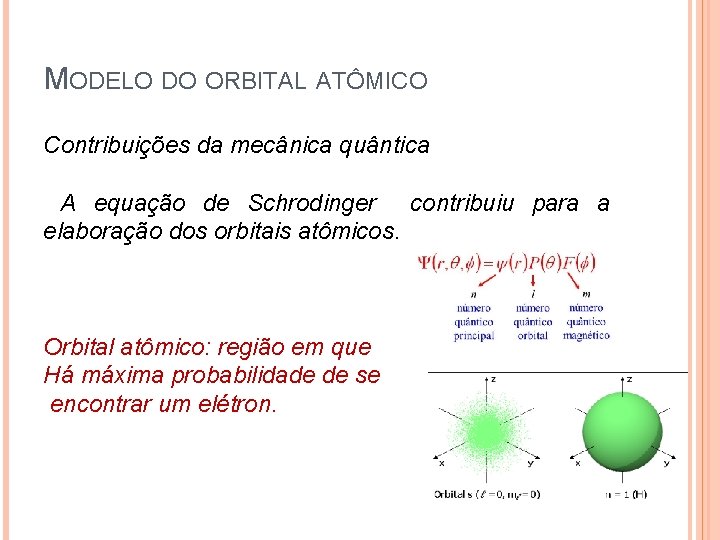
MODELO DO ORBITAL ATÔMICO Contribuições da mecânica quântica ØPrincipio da dualidade de Broglie: O elétron pode se comportar como onda ou partícula. Principio da incerteza de Heisemberg: é impossível determinar simultaneamente e com precisão a posição e a velocidade de um elétron. Ø 15

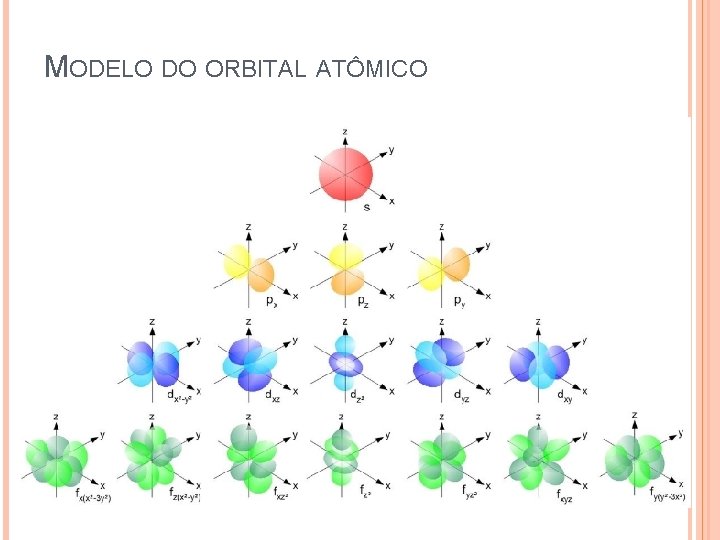
MODELO DO ORBITAL ATÔMICO Contribuições da mecânica quântica A equação de Schrodinger contribuiu para a elaboração dos orbitais atômicos. Orbital atômico: região em que Há máxima probabilidade de se encontrar um elétron. 16

MODELO DO ORBITAL ATÔMICO 17

EXERCÍCIOS MÓDULO 1 – PÁGINA 346 MÓDULO 2 - PÁGINA 348 18

19

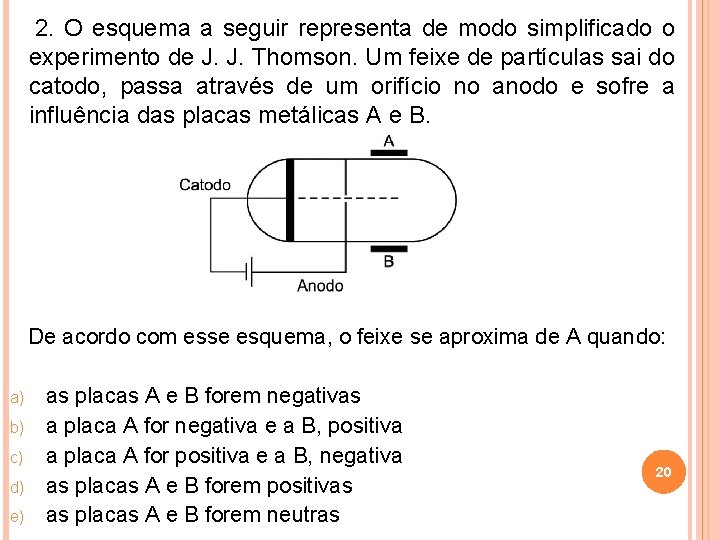
2. O esquema a seguir representa de modo simplificado o experimento de J. J. Thomson. Um feixe de partículas sai do catodo, passa através de um orifício no anodo e sofre a influência das placas metálicas A e B. De acordo com esse esquema, o feixe se aproxima de A quando: a) b) c) d) e) as placas A e B forem negativas a placa A for negativa e a B, positiva a placa A for positiva e a B, negativa as placas A e B forem positivas as placas A e B forem neutras 20

21

22

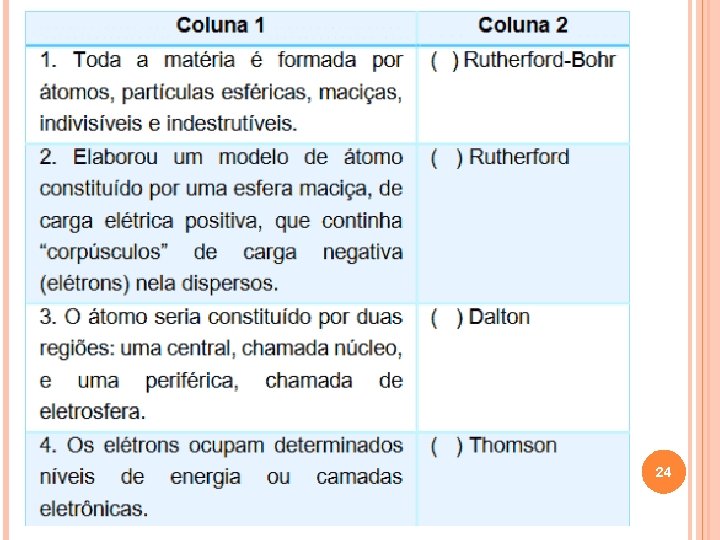
1. Uma forma de determinar a extensão de uma fratura em um osso do corpo é por meio do uso do equipamento de Raios X. Para que essa tecnologia e outros avanços tecnológicos pudessem ser utilizados, um grande passo teve de ser dado pelos cientistas: a concepção científica do modelo atômico. Sobre o modelo atômico proposto, associe as afirmações da coluna 1, com seus respectivos responsáveis, na coluna 2. A sequência correta de preenchimento dos parênteses da coluna 2, de cima para baixo, é: a) 3– 4 – 1 – 2. b) 4 – 2 – 1 – 3. c) 2 – 3 – 1 – 4. d) 3 – 2 – 1 – 4. 23 e) 4– 3– 1– 2

24

2. Considere os modelos atômicos de Dalton, Thomson e Rutherford-Bohr e os fenômenos: I. II. Conservação de massa nas transformações químicas. Emissão de luz verde quando sais de cobre são aquecidos por uma chama. a) Quais desses modelos possuem partículas dotadas de carga elétrica? b) Identifique os modelos atômicos interpretar cada um dos fenômenos que permitem 25

26

BONS ESTUDOS 27