Konsep Mol dan Stoikiometri Dede Trie Kurniawan S


































- Slides: 44

Konsep Mol dan Stoikiometri Dede Trie Kurniawan, S. Si

Unsur, Senyawa dan Formula Unsur Dapat terdiri dari Atom tunggal atau Molekul Senyawa Merupakan kombinasi dua atau lebih unsur Suatu senyawa biasanya dituliskan dalam suatu Formula (Rumus Molekul). dan Rumus Empirik untuk senyawa-senyawa Ionik

Muatan dari Beberapa Kation dan Anion

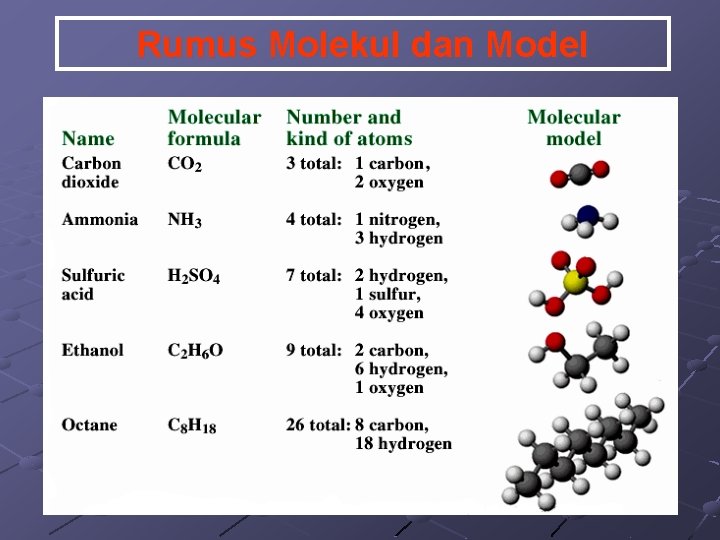
Rumus Molekul dan Model

Penamaan Senyawa Molekul Biner non-Logam + non-Logam Untuk senyawa yang terbentuk dari dua unsur non. Logam, maka unsur yang lebih bersifat logam dituliskan terlebih dahulu. Untuk menunjukkan jumlah suatu unsur pembentuk molekul, maka digunakan angka Yunani. Contoh, mono = 1 ; di = 2 ; tri = 3 ; tetra = 4 penta = 5 ; heksa = 6 ; hepta = 7 ; okta = 8

Senyawa-Senyawa yang Umum H 2 O Air (water) NH 3 ammonia N 2 O dinitrogen monoksida CO karbon monoksida CS 2 karbon disulfida SO 3 sulfur trioksida CCl 4 karbon tetraklorida PCl 5 fosfor pentaklorida SF 6 sulfur heksaflorida

Muatan dari Beberapa Kation dan Anion

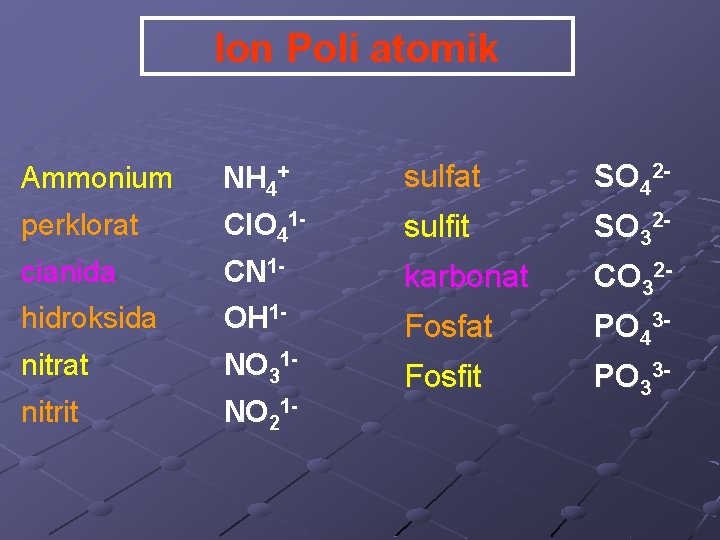
Ion Poli atomik Ammonium NH 4+ sulfat SO 42 - perklorat Cl. O 41 - sulfit SO 32 - cianida CN 1 - karbonat CO 32 - hidroksida OH 1 - Fosfat nitrat NO 31 - PO 43 - nitrit NO 21 - Fosfit PO 33 -

Aturan Bilangan Oksidasi Ø Bilangan oksidasi unsur-unsur golongan IA : +1 Ø Bilangan oksidasi unsur-unsur golongan II A : +2 Ø Bilangan oksidasi unsur-unsur golongan VII A : -1, Ø Ø kecuali jika berikatan dengan oksigen (Cl, Br, dan I) Bilangan oksidasi unsur H : +1, kecuali jika berikatan dengan logam Bilangan oksidasi unsur O : -2, kecuali jika berikat-an dengan F atau membentuk senyawa peroksida Bilangan oksidasi total untuk suatu senyawa = nol Bilangan oksidasi total untuk ion poliatom = muatannya

Muatan dari Beberapa Kation dan Anion

contoh: Na. Cl BO Na = +1 (golongan IA) BO Cl = -1 (golongan VIIA) Mg. O O 2 F 2 BO F = -1 BO O = +1 Na. H BO Mg = +2 (golongan IIA) BO O = -2 HCl. O 2 BO H = +1 BO O = -2 BO Cl = +3 BO Na = +1 BO H = -1

Coba : Hitunglah bilangan oksidasi dari logam Cu dalam senyawa Cu. Cl dan Cu. O! Hitunglah bilangan oksidasi unsur N pada ion NH 4+.

Penamaan Senyawa Molekul Biner Logam + non-Logam (Senyawa Ionik) Rumus senyawa : unsur LOGAM ditulis di depan Contoh : Natrium klorida ditulis Na. Cl, bukan Cl. Na Rumus senyawa ion ditentukan oleh perbandingan muatan kation dan anionnya, sehingga bersifat netral (muatan total = 0) contoh: Cu 2+ + S 2 Al 3+ + SO 42 - Cu. S Al 2(SO 4)3

Nama Senyawa : logam + nonlogam + ida contoh : Na. Cl Ca. Cl 2 Na 2 SO 4 : : : natrium klorida kalsium klorida natrium sulfat Note : jika logam memiliki lebih dari satu bilangan oksidasi, maka untuk membedakan bilangan oksidasinya, harus dituliskan dalam tanda kurung dengan angka romawi!! Contoh : Fe. Cl 2 Fe. Cl 3 Sn. O Sn 2 O : : besi (II) klorida besi (III) klorida timah (II) oksida timah (I) oksida

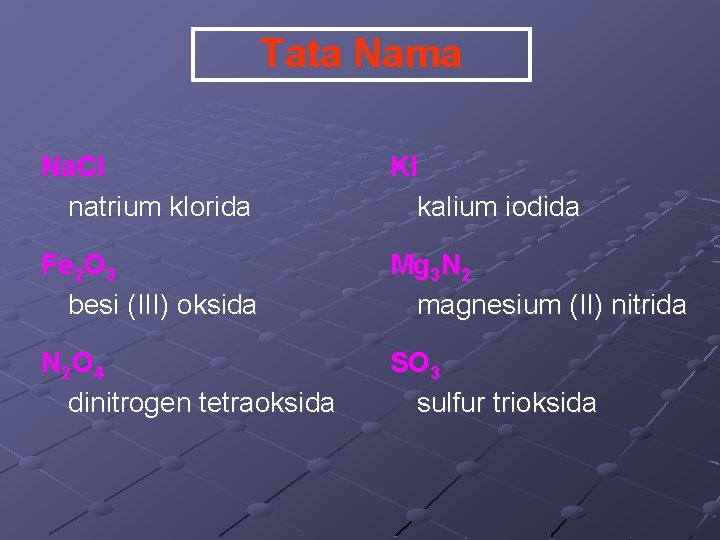
Tata Nama Na. Cl natrium klorida KI kalium iodida Fe 2 O 3 besi (III) oksida Mg 3 N 2 magnesium (II) nitrida N 2 O 4 dinitrogen tetraoksida SO 3 sulfur trioksida

Tata Nama NH 4 NO 3 ammonium nitrat KCl. O 4 kalium perklorat Ca. CO 3 kalsium karbonat Na. OH natrium hidroksida


PERSAMAAN REAKSI Menggambarkan reaksi kimia yang terdiri atas rumus kimia pereaksi dan hasil reaksi disertai koefisiennya masing-masing PENTING!!! Ø Reaksi kimia mengubah zat-zat asal (pereaksi/ reaktan) menjadi zat baru (produk). Ø Jenis dan jumlah atom yang terlibat dalam reaksi tidak berubah. Ø Ikatan kimianya yang berubah, dimana ikatan kimia pereaksi diputus dan terbentuk ikatan kimia baru dalam produknya.

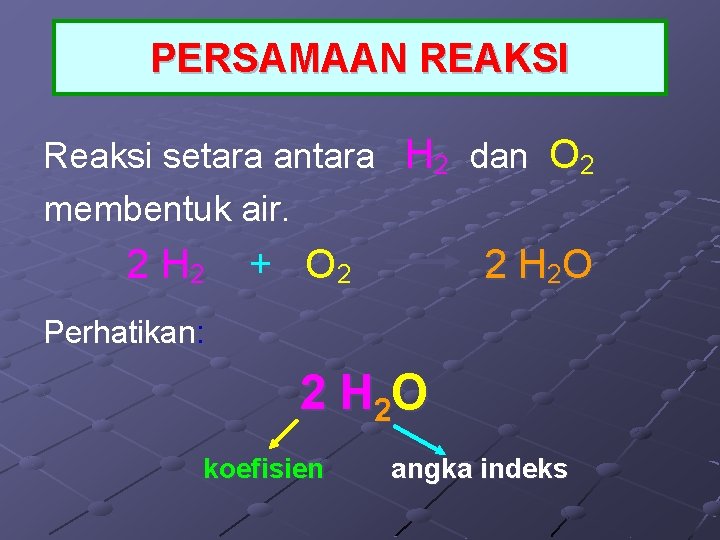
PERSAMAAN REAKSI Reaksi setara antara H 2 dan O 2 membentuk air. 2 H 2 + O 2 2 H 2 O Perhatikan: 2 H 2 O koefisien angka indeks

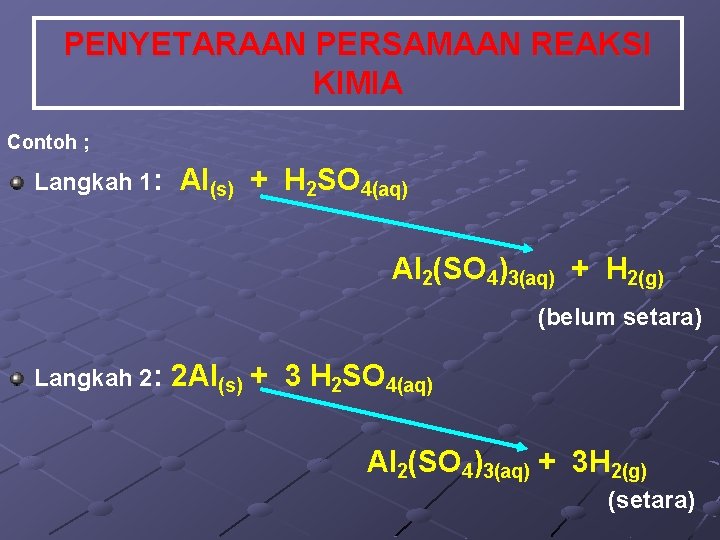
PENYETARAAN PERSAMAAN REAKSI KIMIA Contoh ; Langkah 1: Al(s) + H 2 SO 4(aq) Al 2(SO 4)3(aq) + H 2(g) (belum setara) Langkah 2: 2 Al(s) + 3 H 2 SO 4(aq) Al 2(SO 4)3(aq) + 3 H 2(g) (setara)

PENYETARAAN PERSAMAAN REAKSI KIMIA Ø LANGKAH-LANGKAH PENYETARAAN: Ø Tetapkan koefisien salah satu zat (biasanya yang paling kompleks), sama dengan 1, dan zat lain dengan abjad. Ø Setarakan lebih dahulu unsur yang berkaitan langsung dengan zat yang diberi koefisien 1. Ø 3. Setarakan unsur lain. Biasanya unsur O diseta- rakan paling akhir.

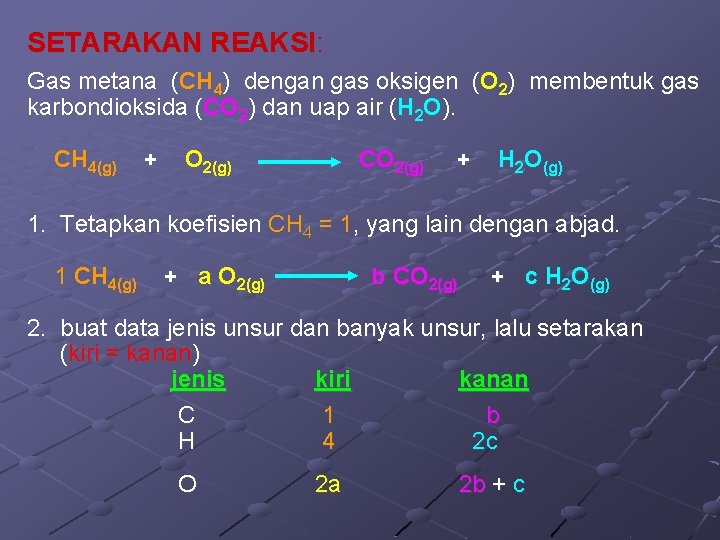
SETARAKAN REAKSI: Gas metana (CH 4) dengan gas oksigen (O 2) membentuk gas karbondioksida (CO 2) dan uap air (H 2 O). CH 4(g) + O 2(g) CO 2(g) + H 2 O(g) 1. Tetapkan koefisien CH 4 = 1, yang lain dengan abjad. 1 CH 4(g) + a O 2(g) b CO 2(g) + c H 2 O(g) 2. buat data jenis unsur dan banyak unsur, lalu setarakan (kiri = kanan) jenis kiri kanan C 1 b H 4 2 c O 2 a 2 b + c

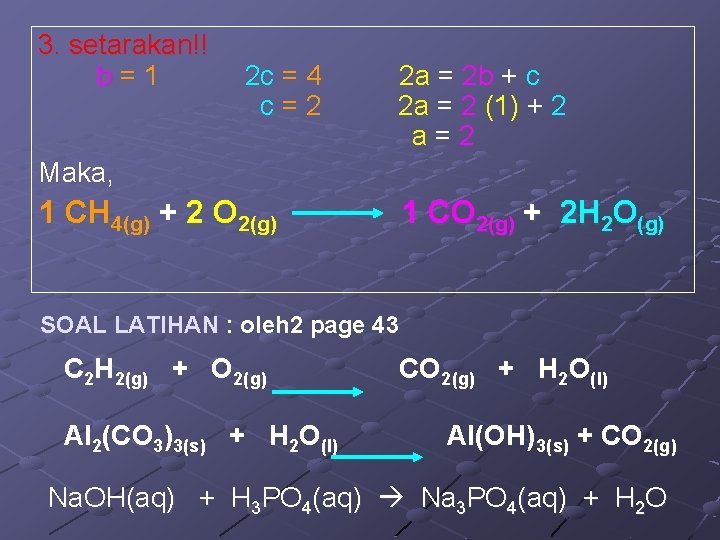
3. setarakan!! b=1 2 c = 4 c=2 2 a = 2 b + c 2 a = 2 (1) + 2 a=2 Maka, 1 CH 4(g) + 2 O 2(g) 1 CO 2(g) + 2 H 2 O(g) SOAL LATIHAN : oleh 2 page 43 C 2 H 2(g) + O 2(g) Al 2(CO 3)3(s) + H 2 O(l) CO 2(g) + H 2 O(l) Al(OH)3(s) + CO 2(g) Na. OH(aq) + H 3 PO 4(aq) Na 3 PO 4(aq) + H 2 O

Stoikiometri stoi·kio·metri kata benda 1. Perhitungan jumlah (kuantitas) dari reaktan dan produk di dalam suatu reaksi kimia. 2. Hubungan jumlah (kuantitas) antara reaktan dan produk di dalam suatu reaksi kimia.

Massa Molar (mr) Massa Molar adalah merupakan jumlah seluruh massa atom pembentuk molekul. atau Jumlah seluruh massa atom yang tertulis dalam formula (rumus molekul). massa molar = Σ massa atom Contoh, HNO 3 massa molar = massa atom H + massa atom N + 3 massa atom O = 1, 008 + 14, 0067 + 3 (15, 9994)

Satu Mol dari Beberapa Molekul Ionik

Contoh Berapa massa molar etanol, C 2 H 5 OH? Massa molar C 2 H 5 O 1 H 1 adalah, = 2 (BA. C) + 5 (BA. H) + 1 (BA. O) + 1 (BA. H) = 2 (12, 011) + 5 (1, 00797) + 1 (15, 9994) + 1 (1, 00797) = 46, 069 g/mol

Contoh Berapa jumlah molekul karbon dioksida yang terdapat dalam 10, 00 g karbon dioksida? Masa Molar CO 2 = 1 (BA. C) + 2 (BA. O) = 1 (12, 011) + 2 (15, 9997) = 44, 01 g/mol Jumlah mol CO 2 adalah ; mol CO 2 = 10, 00 g = (10, 00 g)(1 mol/44, 01 g) = (10, 00)(1 mol/44, 01) = 0, 2272 mol

Persen Komposisi Selain dengan melihat jumlah atom, rumus molekul juga dapat dinyatakan dengan persentase atom-atom penyusunnya massa atom A dalam senyawa X 100% % massa A = Total massa molar senyawa Dalam CO 2 terdapat 27, 3 % atom karbon dan 72, 7 % atom oksigen

Persen Komposisi adalah, penggambaran sua-tu senyawa berdasarkan jumlah relativ semua unsur yang terdapat di dalam senyawa tersebut. Contoh: Berapa % komposisi dari kloroform, CHCl 3, yang merupakan zat anestesi (anesthetic) dalam bidang Kedokteran?

Kadar Zat Dalam Campuran Satuan yang umum digunakan untuk menyatakan kadar salah satu zat yang terdapat di dalam suatu campuran adalah, Kandungan Oksigen di dalam udara adalah 20 %. Hitunglah volume udara dalam liter yang mengandung 10 liter oksigen.

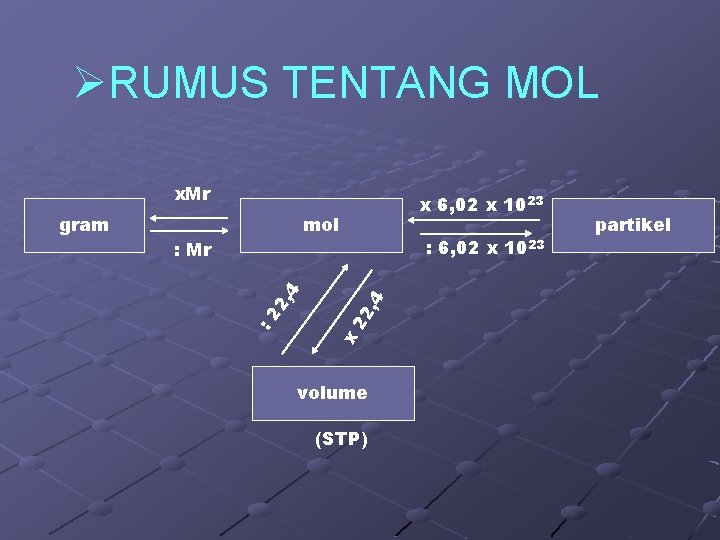
ØRUMUS TENTANG MOL x. Mr mol 22 , 4 : 6, 02 x 1023 x 2, 4 : Mr : 2 gram x 6, 02 x 1023 volume (STP) partikel

Contoh Tentukan mol dari : n n n n 8 g atom kalsium 32 g Na. OH 3, 01 x 1022 buah atom natrium 6, 02 x 1024 buah molekul air 67, 2 L gas CO 2 pada STP 2 L larutan HCl 0, 32 M Jika data Ar Ca=40, Na = 23, O=16, H=1

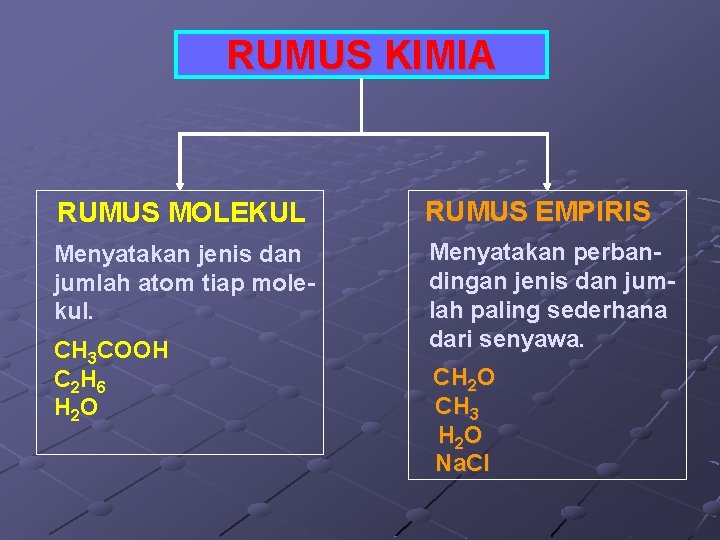
RUMUS KIMIA RUMUS MOLEKUL RUMUS EMPIRIS Menyatakan jenis dan jumlah atom tiap molekul. Menyatakan perbandingan jenis dan jumlah paling sederhana dari senyawa. CH 3 COOH C 2 H 6 H 2 O CH 3 H 2 O Na. Cl

Penentuan Rumus Empiris secara Eksperimen Rumus Empiris = menyatakan jenis unsur dan perbandingan paling sederhana dari jumlah atom masing-masing unsur dalam satu molekul senyawa. Jenis unsur Massa Perbandingan mol RE

Penentuan Rumus Molekul dari Rumus Empiris Mr = (Massa rumus empiris)n RM = (RE)n

Rumus Empiris (Formula Empirik) Rumus Empiris adalah suatu rumus kimia yang menyatakan perbandingan jenis dan jumlah atom yang paling kecil. Contoh ; n n n CH 2 O C 3 H 8 H 2 O

contoh; Asetilena, C 2 H 2, and benzena, C 6 H 6, memiliki rumus empiris yang sama, yaitu : Asetilena C 2 H 2 Benzena C 6 H 6 Rumus empiris CH

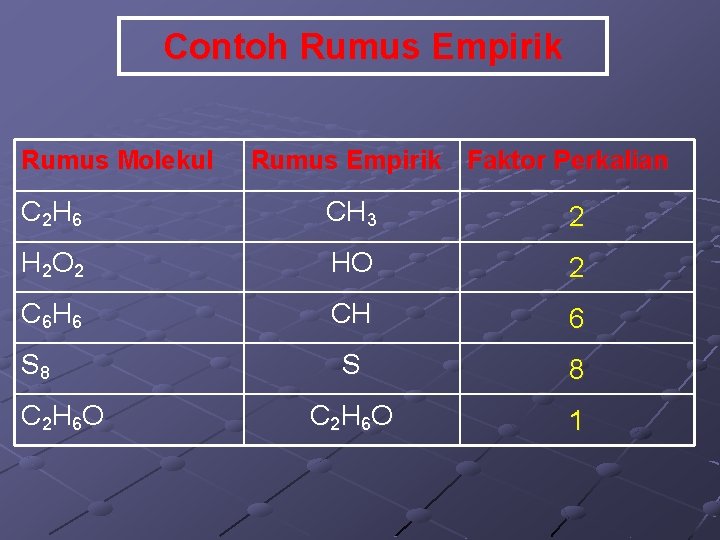
Contoh Rumus Empirik Rumus Molekul Rumus Empirik Faktor Perkalian C 2 H 6 CH 3 2 H 2 O 2 HO 2 C 6 H 6 CH 6 S 8 C 2 H 6 O 1 S 8 C 2 H 6 O

Perhitungan Stoikiometri dari Reaksi Pembakaran Contoh. Asam Askorbat (Vitamin-C) terdiri dari 40, 92 % C, 4, 58 % H dan 54, 50 % O (persen berat). Hasil analisa berat molekul vitamin C adalah 176 amu. Apa rumus empirik dan rumus molekul vitamin C tersebut?

Alur Perhitungan Rumus Empirik dan Rumus Molekul % Berat Unsur-Unsur Umpamakan 100 gram Hitung Berat Setiap Unsur (gram) Gunakan Berat Atom Hitung Jumlah mol Setiap Unsur Hitung Perbandingan Setiap mol Unsur Rumus Empirik Samakan Berat Molekul Rumus Empirik dengan Berat Molekul yang Diketahui Ø Rumus Molekul Ø Ø Ø Ø

coba Pada pembakaran 15 m. L gas hidrokarbon diperlukan 75 m. L gas oksigen dan dihasilkan 45 m. L gas carbondioksida dan sejumlah uap air. Jika diukur pada P dan T yang sama, rumus Hidrokarbon tersebut adalah?

Oleh - Oleh Pada pembakaran 9 gram senyawa Organik (Cx. Hy. Oz) dihasilkan 13, 2 gram gas CO 2 dan 5, 4 gram H 2 O. Tentukan rumus empiris senyawa tersebut! Tentukan rumus Molekul jika Mr (massa molar) nya 180!

Oleh – oleh lagi 92 gram senyawa mengandung C, H dan O dibakar sempurna dengan oksigen menghasilkan 176 gram CO 2, 108 Gram H 2 O. Bila diketahui Mr senyawa tersebut adalah 46. tentukan rumus Kimia senyawa tersebut!
 Peta konsep hukum dasar kimia
Peta konsep hukum dasar kimia Muhammad danang kurniawan
Muhammad danang kurniawan Defri kurniawan
Defri kurniawan Andi kurniawan adalah pemain
Andi kurniawan adalah pemain Kurniawan hartanto
Kurniawan hartanto Gsm protocol
Gsm protocol Anang mury kurniawan
Anang mury kurniawan Grans to moles
Grans to moles Mol to mol conversion
Mol to mol conversion What is 1 mole
What is 1 mole Mol to mol
Mol to mol What can be said about 1 mol ag and 1 mol au
What can be said about 1 mol ag and 1 mol au Contoh senyawa non stoikiometrik
Contoh senyawa non stoikiometrik Stochiometri mempelajari hubungan kuantitatif antara
Stochiometri mempelajari hubungan kuantitatif antara Peta kompetensi stoikiometri
Peta kompetensi stoikiometri Rangkuman stoikiometri
Rangkuman stoikiometri Stoikiometri adalah ilmu yang mempelajari tentang
Stoikiometri adalah ilmu yang mempelajari tentang Hukum lavoisier
Hukum lavoisier Hukum kekekalan massa
Hukum kekekalan massa Stoikiometri berasal dari bahasa yunani
Stoikiometri berasal dari bahasa yunani Grupo dede
Grupo dede Hande dede
Hande dede Düzmürd kalesi nerede
Düzmürd kalesi nerede El jefe dictator
El jefe dictator Dede willis
Dede willis Dede korkut
Dede korkut Dede korkut
Dede korkut Bingöl çobanları kimin eseri
Bingöl çobanları kimin eseri Tujuan dibentuknya persagi pada masa cita nasional adalah ?
Tujuan dibentuknya persagi pada masa cita nasional adalah ? Yaman dede imam hatip ortaokulu
Yaman dede imam hatip ortaokulu De la briandais trie
De la briandais trie Suffix trie example
Suffix trie example Binary trie
Binary trie Huffman encoding trie
Huffman encoding trie Trie performance
Trie performance Patricia trie
Patricia trie Ipv carve out
Ipv carve out Trie
Trie Multiway trie
Multiway trie Mol kütlesi
Mol kütlesi Berapa gram massa 5 mol glukosa (mr=180)
Berapa gram massa 5 mol glukosa (mr=180) Louis sneyder
Louis sneyder Peta konsep makanan dan minuman halal
Peta konsep makanan dan minuman halal Konsep dan prinsip kebutuhan istirahat dan tidur
Konsep dan prinsip kebutuhan istirahat dan tidur System garis atau line pada er model menunjukkan…..
System garis atau line pada er model menunjukkan…..