KEMISKA MNEN NO r 7 Mlarhjdens skola KEMINS





























- Slides: 35

KEMISKA ÄMNEN NO år 7 Mälarhöjdens skola KEMINS GRUNDER

ÄMNENS EGENSKAPER • • • Utseende Hårdhet Glans Färg Form Struktur Smak Doft Strömledningsförmåga Magnetiskt? KEMINS GRUNDER

ÄMNENS EGENSKAPER KEMINS GRUNDER

ÄMNENS TRE FASER • Ämnens tre faser: – Fast – Flytande – Gas • Nästan alla ämnen finns i de tre olika formerna • Smältpunkt och kokpunkt är olika för olika ämnen KEMINS GRUNDER

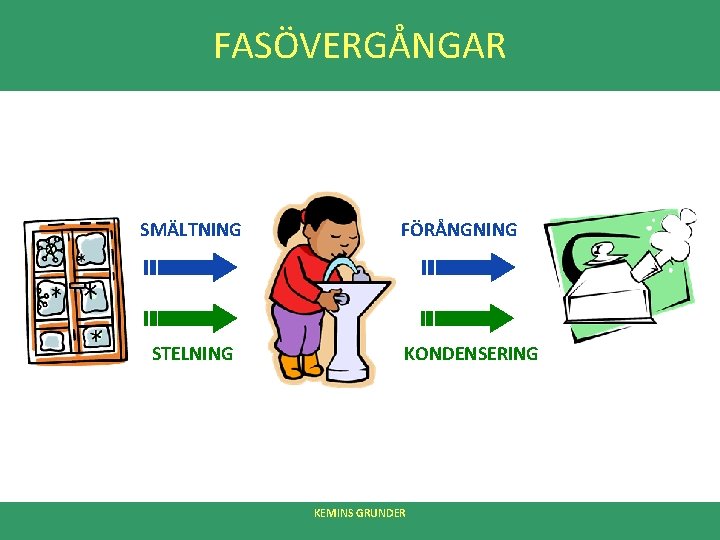
FASÖVERGÅNGAR SMÄLTNING STELNING FÖRÅNGNING KONDENSERING KEMINS GRUNDER

FYSIKALISK FÖRÄNDRING • De flesta ämnen kan förekomma i tre tillstånd → fast, flytande och gas. • Fysikalisk förändring – När ett ämne övergår från ett tillstånd till ett annat (t. ex. från fast till flytande form). – Ämnet behåller sina ursprungliga egenskaper när det återgår till ursprungstillståndet. • Ex: Om man värmer tenn så att det smälter, och sedan låter det svalna till fast form igen, så återfår tenn sina ursprungliga egenskaper. KEMINS GRUNDER

KEMISK FÖRÄNDRING • Ex: Om man värmer magnesium, börjar magnesiumet brinna och omvandlas till ett helt nytt ämne. Magnesiumoxid har bildats. • I ovanstående exempel har en kemisk reaktion skett, där magnesiumet har reagerat med syret i luften. • Magnesium + syre → magnesiumoxid http: //www. youtube. com/watch? v=u 89 w. G 8 q. GC 1 Y&feature=related KEMINS GRUNDER

KEMI GRUNDÄMNEN OCH KEMISKA FÖRENINGAR NO år 7 Mälarhöjdens skola KEMINS GRUNDER

ATOMER • ATOMER: Naturens byggstenar • Det finns drygt 100 stycken olika att bygga med. • Exempel: syre, väte, kol, svavel, järn, kvicksilver, bly, uran… KEMINS GRUNDER

MOLEKYLER • Atomerna kan kombineras på oändligt många olika sätt i teorin • MOLEKYL: Atomer som sitter ihop i en grupp (från 2 atomer till flera tusen) • Molekyler kan bestå av likadana atomer (t. ex. två syreatomer), eller av olika slags atomer (t. ex. vatten, där varje vattenmolekyl består av en syreatom och två väteatomer). KEMINS GRUNDER

ATOMER OCH MOLEKYLER I din kropp finns det cirka 5 000 000 000 atomer Människokroppen: Syre drygt 60 % Kol ca 20 % Väte ca 10 % Kväve ca 3 % Kalcium ca 2 % Fosfor ca 1 % Kalium ca 0, 4 % Svavel 0, 3 % Klor ca 0, 2 % Natrium ca 0, 1 % Magnesium ca 0, 1 % Andra spårämnen ( < 0, 01 %): Magnesium, bor, krom, kobolt, koppar, flor, jod, järn, selen, mangan, molybden, kisel, tenn, vanadium, zink KEMINS GRUNDER

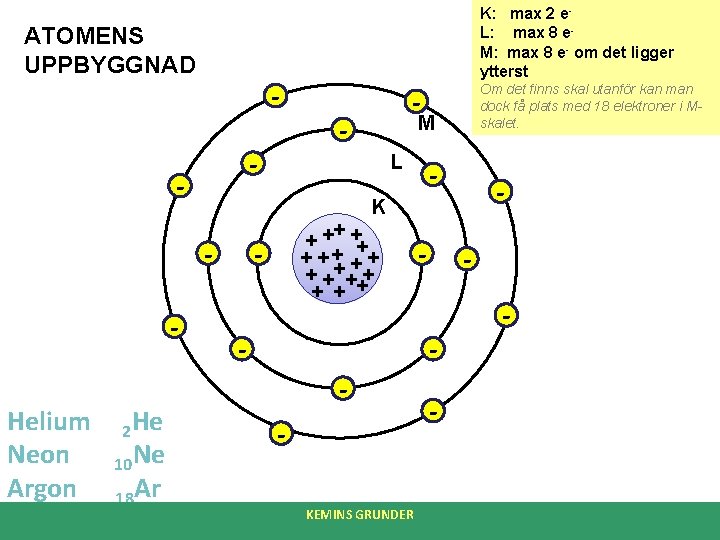
ATOMENS UPPBYGGNAD (Nils Bohrs modell) • I mitten av atomen finns atomkärnan • Atomkärnan består av protoner och neutroner. • Runt kärnan, i ett elektronmoln (skal), kretsar elektroner. • Protonerna är positivt laddade. Man säger att varje protons laddning är +1. • Elektronerna är negativt laddade. Man säger att varje elektrons laddning är -1. • Neutronen har ingen laddning. • Det finns lika många protoner som elektroner i en atom och atomen blir därmed elektriskt neutral. KEMINS GRUNDER

KEMISKA TECKEN • Jöns Jacob Berzelius (1779 -1848) införde kemiska tecken för varje grundämne. • Används över hela världen. • En eller två bokstäver ur ämnets latinska namn. Första bokstaven stor och andra liten. Grundämne Kemiskt tecken Väte H Syre O Järn Fe Kol C Svavel S Magnesium Mg KEMINS GRUNDER

ATOMNUMMER • Atomnumret anger hur många protoner det finns i kärnan. • Atomnumret sätts som regel nere till vänster om det kemiska tecknet. • Ex: Helium har 2 protoner (och därmed 2 elektroner). Helium har därmed atomnummer 2. Skrivs: 2 He KEMINS GRUNDER

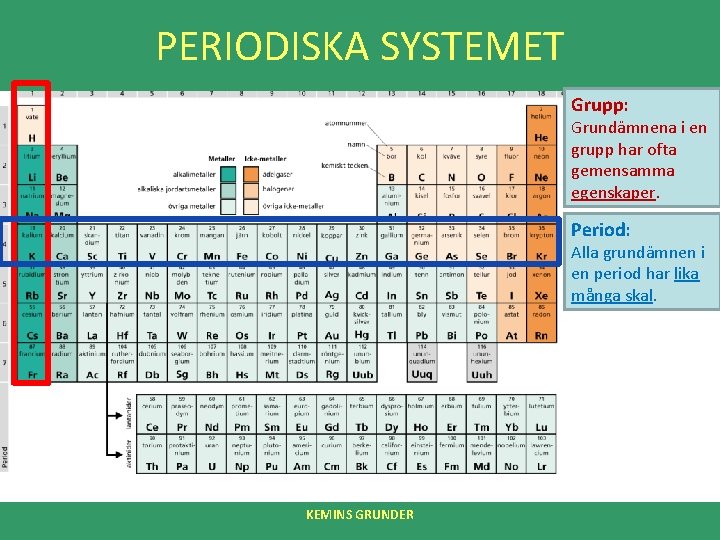
PERIODISKA SYSTEMET Grupp: Grundämnena i en grupp har ofta gemensamma egenskaper. Period: Alla grundämnen i en period har lika många skal. KEMINS GRUNDER

K: max 2 e. L: max 8 e. M: max 8 e- om det ligger ytterst ATOMENS UPPBYGGNAD - - Helium Neon Argon Krypton 2 He 10 Ne 18 Ar 36 Kr - M L - - K - Om det finns skal utanför kan man dock få plats med 18 elektroner i Mskalet. + ++ + + + +++ + + - - - KEMINS GRUNDER - -

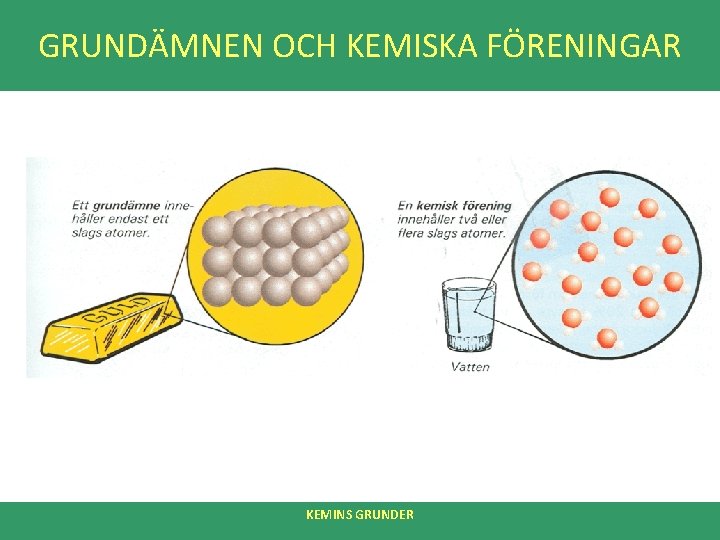
GRUNDÄMNEN OCH KEMISKA FÖRENINGAR • Ofta delar man in ämnen i grundämnen och kemiska föreningar • Grundämne – Drygt 100 i naturen – Ett ämne som bara består av en enda sorts atomer (t. ex. syreatomer eller kolatomer) – Delas in i metaller, icke-metaller och halvmetaller • Kemisk förening Innehåller fler än en sorts atomer. T. ex. vatten som består av syre- och väteatomer. KEMINS GRUNDER

METALLER, ICKE-METALLER OCH HALVMETALLER • Man delar upp grundämnena i metaller, icke-metaller och halvmetaller: • Metaller – – – Ca 80 % av alla grundämnen. De flesta metaller har ett litet antal elektroner i sitt yttersta skal Leder ström och värme bra Ofta hög densitet (tunga) Metallglans Ex: aluminium, bly, guld, järn, koppar, platina, silver, tenn, zink. • Icke-metaller – Ämne som saknar metalliska egenskaper (se ovan) • Halvmetaller – Grundämne med egenskaper mellan de rena metallerna och icke-metallerna KEMINS GRUNDER

GRUNDÄMNEN OCH KEMISKA FÖRENINGAR KEMINS GRUNDER

KEMINS SPRÅK • Alla grundämnen har en kemisk beteckning som är gemensam över hela världen. • En molekylformel visar hur atomerna sitter ihop i molekylerna. • Med hjälp av dessa förkortningar kan kemister skriva reaktionsformler som beskriver: – Hur ämnen är uppbyggda – Vad som händer när ämnen reagerar med varandra KEMINS GRUNDER Väte = H Syre = O Kol = C Kväve = N Järn = Fe Guld = Au Silver = Ag Vätgas = H 2 Syrgas = O 2 Vatten = H 2 O 2 H 2 + O 2 → 2 H 2 O

KEMINS SPRÅK Kemiska tecknet för syre är O. När syre förekommer som gas är atomerna bundna till varandra två och två så att de bildar små grupper, molekyler. En syremolekyl skrivs O 2 Två syremolekyler skrivs 2 O 2 Tre syremolekyler skrivs 3 O 2 KEMINS GRUNDER

MOLEKYLER Två syreatomer sitter ihop och bildar en syremolekyl. Syre har beteckningen O och en syremolekyl med två syreatomer betecknas med O 2. Två väteatomer och en syreatom sitter ihop och bildar en vattenmolekyl. Syre har beteckningen O, och väte H, så vatten har beteckningen H 2 O. Två syreatomer och en kolatom sitter ihop och bildar en koldioxidmolekyl (ordet ”di” betyder ”två”). Syre har beteckningen O, och kol C, så vatten har beteckningen CO 2. KEMINS GRUNDER

REAKTIONSFORMLER • • 1. 2. 3. 4. För att enkelt kunna beskriva vad som sker vid kemiska reaktioner så skriver man en reaktionsformel. Så här skriver man: Skriv först de ämnen du har från början. Sätt ett plustecken mellan varje ämne. Rita sedan en pil (som anger själva reaktionen). Till höger om pilen skriver du de ämnen som bildas. Obs! Det ska finnas lika många atomer av varje grundämne på båda sidor om pilen. KEMINS GRUNDER

ATT RITA GRUNDÄMNEN KEMINS GRUNDER

KEMI RENA ÄMNEN OCH BLANDNINGAR NO år 7 Mälarhöjdens skola KEMINS GRUNDER

RENA ÄMNEN OCH BLANDNINGAR • Rent ämne – I ett rent ämne finns bara en sorts molekyler. T. ex, destillerat vatten. – Rena ämnen är mycket sällsynta • Blandning – En blandning består av flera olika sorters molekyler. T. ex. kranvatten. – I en blandning är ämnena inte bundna till varandra. De ämnen som ingår har kvar sina kemiska egenskaper. – Ex: Svavel och järn i pulverform blandas. Järn är svart och magnetiskt men svavel är gult och omagnetiskt. När vi blandat dem kan vi skilja dem åt igen med en magnet. KEMINS GRUNDER

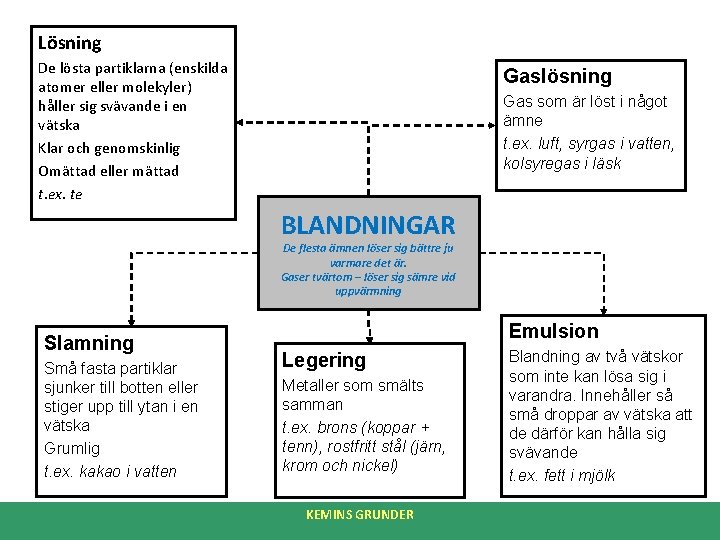
Lösning De lösta partiklarna (enskilda atomer eller molekyler) håller sig svävande i en vätska Klar och genomskinlig Omättad eller mättad t. ex. te Gaslösning Gas som är löst i något ämne t. ex. luft, syrgas i vatten, kolsyregas i läsk BLANDNINGAR De flesta ämnen löser sig bättre ju varmare det är. Gaser tvärtom – löser sig sämre vid uppvärmning Slamning Små fasta partiklar sjunker till botten eller stiger upp till ytan i en vätska Grumlig t. ex. kakao i vatten Emulsion Legering Metaller som smälts samman t. ex. brons (koppar + tenn), rostfritt stål (järn, krom och nickel) KEMINS GRUNDER Blandning av två vätskor som inte kan lösa sig i varandra. Innehåller så små droppar av vätska att de därför kan hålla sig svävande t. ex. fett i mjölk

MÄTTADE OCH OMÄTTADE LÖSNINGAR • En lösning är en blandning av ämnen, där ämnena som ingår har delat upp sig i så små bitar, att vi inte kan se dem → en lösning är ofta klar och genomskinlig. • De lösta partiklarna håller sig svävande i vätskan. • Vätskan i en lösning kallas för lösningsmedel. – Ex: saft (vatten = lösningsmedel) saltvatten (vatten = lösningsmedel) Målarfärg (lacknafta = lösningsmedel) • Omättad lösning – – – • Om man löser en liten mängd av ett ämne, t. ex. salt, så får man en utspädd lösning. Fortsätter man att hälla i mer av ämnet, blir lösningen koncentrerad. Så länge det går att lösa mer av ett ämne i lösningsmedlet är lösningen omättad. Mättad lösning – – – En lösning där lösningsmedlet inte längre kan lösa mer av det tillsatta ämnet. Ju högre temperatur lösningen har, desto mer av ämnet klarar den av att lösa. Om man lägger i sockerbitar i ett glas med vatten, så löses sockret upp och blandar sig till med vattnet till en lösning som ser ut som vanligt vatten, men smakar sött. Om man fortsätter att lägga i sockerbitar, klarar lösningen inte längre av att lösa upp sockret, som då lägger sig på botten → vi har fått en mättad lösning. KEMINS GRUNDER

SLAMNING OCH EMULSION • SLAMNING – Partiklar löser sig inte, utan de faller till botten eller stiger upp på ytan. – Grumlig. – Ex: kakao som man häller i vatten och rör runt. Efter att man låtit blandningen stå en stund faller partiklar ned på botten. – Slamning och emulsion är blandningar där de fasta partiklarna inte löser sig i vätskan, utan faller till botten eller stiger till ytan. – En slamning är grumlig (t. ex. kakao i vatten). • EMULSION – Liknar slamning. En blandning av två vätskor, som inte kan lösa sig i varandra. Mycket små droppar av en vätska svävar omkring i en annan vätska. – Ofta lägger sig vätskorna som skikt på varandra. (t. ex. matolja och vatten). – Om man lyckas finfördela ämnet till oerhört små droppar, kan de hålla sig svävande i lösningsmedlet utan att flyta upp. (t. ex. mjölk som innehåller små ”fettkulor” blandade i vatten. KEMINS GRUNDER

GASLÖSNINGAR • Blandning av gaser lösta i varandra. • T. ex. luft → kväve 78%, syre 21%, koldioxid, vattenånga och ädelgaser • Gaser löser sig lättare i vatten vid högt tryck och låg temperatur. – Ex: Kolsyrade läskedrycker – gasen koldioxid tillsätts under högt tryck. När man öppnar flaskan sjunker trycket → gasen går ur lösningen och det bildas bubblor som stiger till ytan. – När man värmer vatten bildas luftbubblor innan det kokar. Det är luft som varit löst i vatten och som avgår när temperaturen stiger (varmt vatten kan inte lösa lika mycket luft som kallt vatten). KEMINS GRUNDER

LEGERINGAR • Ämnen som framställs genom sammansmältning av grundämnen där minst en är en metall. • Har ofta andra egenskaper än de metaller som ingår. Är ofta starkare, och mer motståndskraftiga och har en lägre smältpunkt. Legering Ingående metaller Brons Koppar + tenn Lödtenn Bly + tenn Mässing Koppar + zink Nysilver Koppar + zink + nickel Rostfritt stål Järn + krom + nickel KEMINS GRUNDER

LÖSNINGSMEDEL • VATTEN – Det vanligaste lösningsmedlet. – Exempel: – Lösningsmedel för växter och levande varelser för näringsupptagning och transport. – Spolarvätska → alkohol + vatten – K-sprit + vatten i bensintank → förhindrar att vattnet fryser i bensintanken på vintern. – En del målarfärger (vattenlösliga) • ANDRA LÖSNINGSMEDEL – T. ex. lacknafta, aceton, terpentin för en del målarfärger KEMINS GRUNDER

KEMI SEPARERA ÄMNEN NO år 7 Mälarhöjdens skola KEMINS GRUNDER

SEPARERA ÄMNEN • Vanligaste metoderna är sedimentering, filtrering, destillering och indunstning. • SEDIMENTERING – – • För partiklar uppslammade i en vätska. Man avskiljer fasta partiklar genom att de antingen sjunker till botten eller flyter upp till ytan. Därefter för man över t. ex. det renade vattnet till en annan plats → dekantering. Ex: Reningsverk – sedimenteringsbassänger för att få bort föroreningar. FILTRERING – – – För partiklar uppslammade i en vätska. Vätskan hälls genom ett filter som innehåller små hål (porer), där vätskan (filtrat) kan passera men de fasta partiklarna stannar kvar. Ex: Kaffesump separeras från kaffet i ett filter. Rening av dricksvatten sker genom ett sandfilter (tjockt lager sand på botten av en bassäng). KEMINS GRUNDER

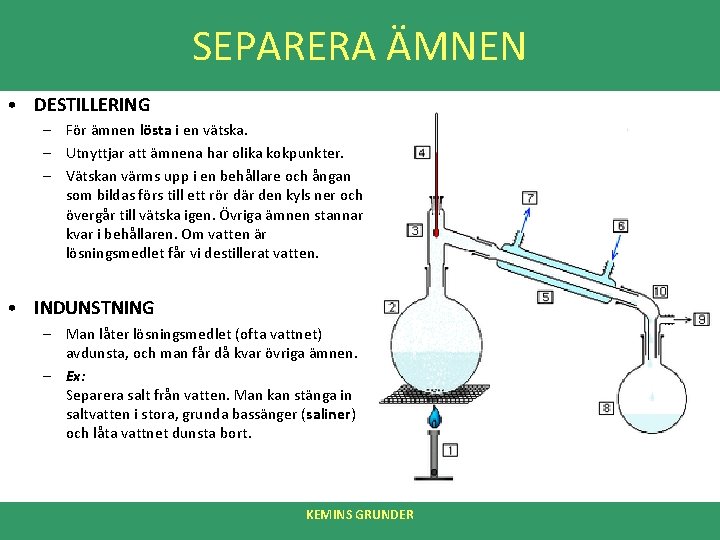
SEPARERA ÄMNEN • DESTILLERING – För ämnen lösta i en vätska. – Utnyttjar att ämnena har olika kokpunkter. – Vätskan värms upp i en behållare och ångan som bildas förs till ett rör där den kyls ner och övergår till vätska igen. Övriga ämnen stannar kvar i behållaren. Om vatten är lösningsmedlet får vi destillerat vatten. • INDUNSTNING – Man låter lösningsmedlet (ofta vattnet) avdunsta, och man får då kvar övriga ämnen. – Ex: Separera salt från vatten. Man kan stänga in saltvatten i stora, grunda bassänger (saliner) och låta vattnet dunsta bort. KEMINS GRUNDER
 Kemins historia
Kemins historia Avogadros konstant
Avogadros konstant Kvävemolekyler med kemiska tecken
Kvävemolekyler med kemiska tecken Permutacije bez ponavljanja
Permutacije bez ponavljanja Ugostiteljsko turisticka skola novi pazar
Ugostiteljsko turisticka skola novi pazar Bergius skola
Bergius skola Srednja medicinska škola slavonski brod
Srednja medicinska škola slavonski brod Matsedel lugnets skola
Matsedel lugnets skola Kdy začne zahřáté těleso svítit
Kdy začne zahřáté těleso svítit Srednja škola dugo selo bodovni prag
Srednja škola dugo selo bodovni prag Skolpliktsbevakande skola
Skolpliktsbevakande skola Druga osnovna škola petrinja
Druga osnovna škola petrinja Kamo nakon jezične gimnazije
Kamo nakon jezične gimnazije Industrijska strojarska škola zagreb
Industrijska strojarska škola zagreb Drvodjelska tehnička škola vinkovci
Drvodjelska tehnička škola vinkovci Biuretska reakcija
Biuretska reakcija Osnovna škola popovac
Osnovna škola popovac Glazbena škola zabok
Glazbena škola zabok Kolabra
Kolabra Analiticka hemija srednja skola
Analiticka hemija srednja skola Srednja škola andrije ljudevita adamića rijeka cijena
Srednja škola andrije ljudevita adamića rijeka cijena Kodanska skola
Kodanska skola Skola 17 novembra sabinov
Skola 17 novembra sabinov Justinijanova kodifikacija
Justinijanova kodifikacija Osnovna škola vladimir vidrić kutina
Osnovna škola vladimir vidrić kutina Dnevnik rada za praksu hotelijersko turistička škola
Dnevnik rada za praksu hotelijersko turistička škola Zadarska filološka škola
Zadarska filološka škola Skola hrhov
Skola hrhov Farmaceutsko fizioterapeutska skola
Farmaceutsko fizioterapeutska skola Pontavenská škola
Pontavenská škola Dovidenia kamarati uz ideme do skoly
Dovidenia kamarati uz ideme do skoly Vzor žiadosti o zamestnanie
Vzor žiadosti o zamestnanie Visoka medicinska skola cuprija
Visoka medicinska skola cuprija Srednja škola vrbovec
Srednja škola vrbovec Filozofske discipline
Filozofske discipline Waldorfská škola olomouc
Waldorfská škola olomouc