Isotopes Latome est constitu dun noyau central charg












- Slides: 13

Isotopes

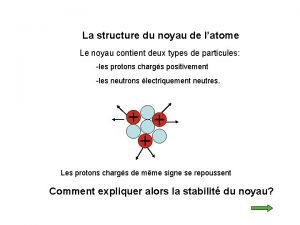
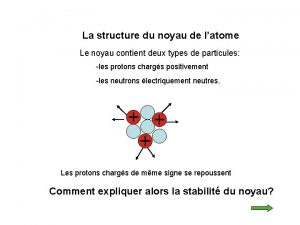
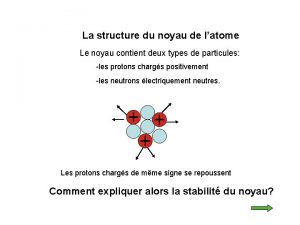
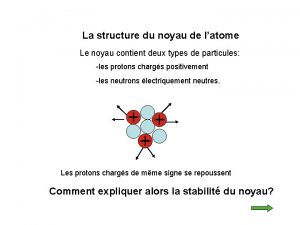
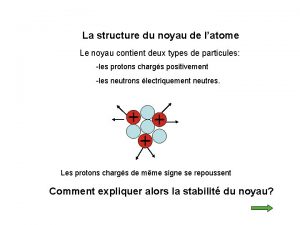
L’atome est constitué : ü d'un noyau central, chargé positivement, qui est un assemblage de protons et de neutrons. ü d'un nuage périphérique composé d'un cortège d'électrons, chargés négativement, qui tournent à des vitesses prodigieuses autour du noyau Particule Electron Proton Neutron Isotopes et masses exactes masse (uma) charge électrique (C) 5, 49. 10 -4 - 1, 6. 10 -19 1, 0073 + 1, 6. 10 -19 1, 0086 0 2

Classification des éléments Isotopes et masses exactes 3

Isotopes - Nombre de masse n Nombre de masse (A): – nombre de nucléons (protons + neutrons) Isotopes : atomes d’un même élément qui contiennent un nombre identique de protons mais un nombre différent de neutrons n Isotopes et masses exactes 4

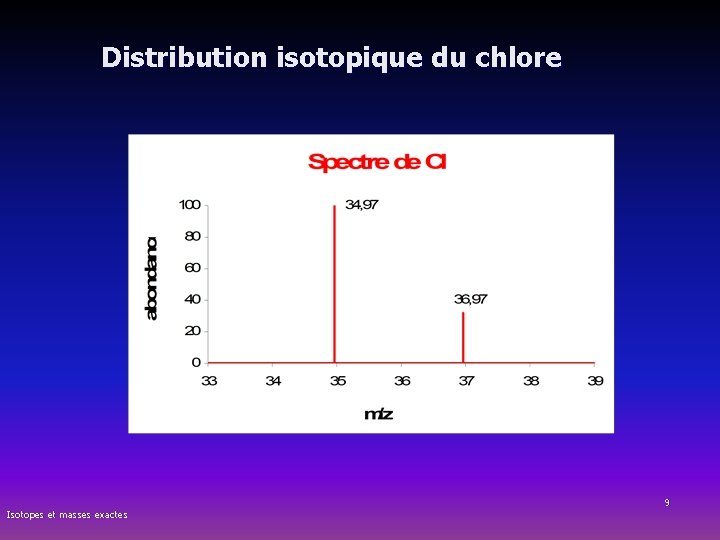
Isotopes - Nombre de masse Exemple : le chlore naturel (Z = 17 ) est constitué de 2 isotopes : le chlore-35 et le chlore-37 Nombre Z Nombre A Electrons Protons Neutrons = A-Z Isotopes et masses exactes chlore-35 chlore-37 17 17 35 37 17 17 18 17 17 20 5

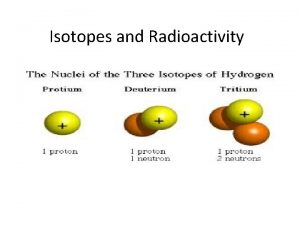
Isotopes Voici un exemple avec l’hydrogène: DEUTÉRIUM (H 2) PROTIUM (H 1) TRITIUM (H 3) N P P E N P E MASSE = 1 N E MASSE = 2 MASSE = 3 P E N PROTON ELECTRON NEUTRON

Abondance isotopique Masse atomique moyenne n Abondance isotopique = La quantité relative (%) de chaque isotope présent dans un élément n Masse atomique moyenne = Masse atomique apparaissant sur le tableau périodique et qui tient compte des isotopes et de leur abondance Exemple : nbre A Chlore-35 Chlore-37 masse isotopique 34, 97 36, 97 abondance en % (1) 75, 8% 24, 2% Masse atomique moyenne du chlore (MM) : = (0, 758 x 34, 97 uma) + (0, 242 x 36, 97 uma) = 35, 454 uma (1) Isotopes et masses exactes = nombre moyen d’isotope cité pour 100 atomes de l’élément

Masse atomique du chlore Masse atomique moyenne du chlore (MM) : = (0, 758 x 34, 97 uma) + (0, 242 x 36, 97 uma) = 35, 454 uma Isotopes et masses exactes 8

Distribution isotopique du chlore Isotopes et masses exactes 9

Calcul de la masse atomique moyenne: 1. Déterminer la masse atomique moyenne du carbone sachant qu’il est formé de deux isotopes; 12 C (98, 892%) et 13 C (1, 108%). 10

Calcul de la masse atomique moyenne: 2. Les trois isotopes naturels du néon, leurs proportions relatives et leurs masse atomiques respectives sont les suivantes : la proportion du néon 20 est de 90, 51% et sa masse est de 19, 99244 u; la proportion du néon 21 est de 0, 27% et sa masse est de 20, 99395 u; la proportion du néon 22 est de 9, 22% et sa masse est de 21, 99138 u. Calculer la masse atomique moyenne du néon. 11

Calcul de la masse atomique moyenne: 3. Le brome naturel est constitué de deux isotopes. 79 Br et 81 Br, dont les masses atomiques valent, respectivement 78, 918 u et 81, 916 u. Sachant que la proportion de brome 79 est de 50. 69% et que celui du brome 81 est de 49. 31%, calculer les la masse atomique moyenne du brome. 12

Calcul du pourcentage d’abondance de chaque isotope : 4. Le bore naturel est constitué de deux isotopes, 10 B et 11 B, dont les masses atomiques valent , respectivement, 10, 013 u et 11, 009 u. Sachant que la proportion de bore 10 est de 19. 88% et que celui du bore 11 est de 80. 12%, calculer les la masse atomique moyenne du brome. 13