La structure du noyau de latome Le noyau




- Slides: 10

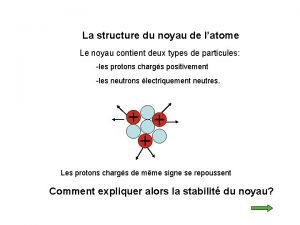
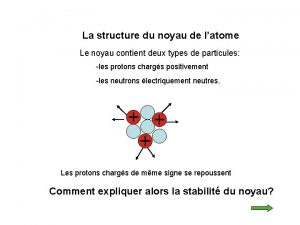
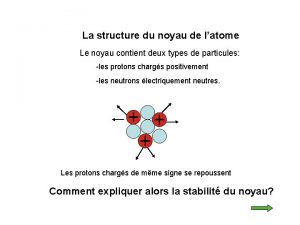
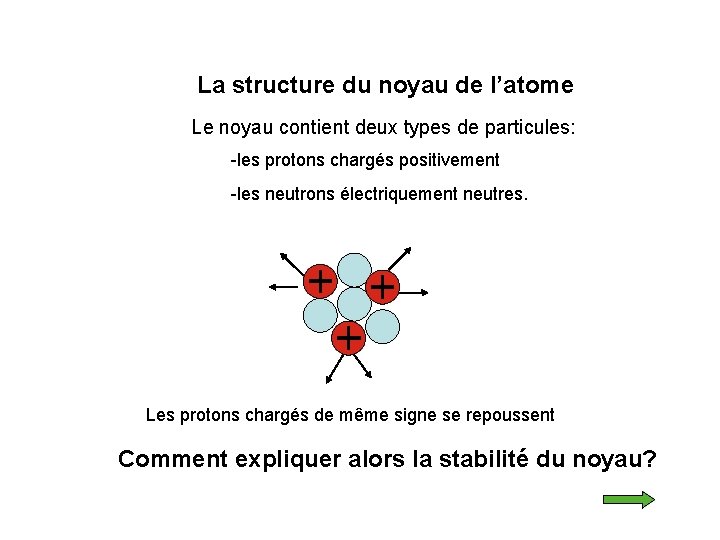
La structure du noyau de l’atome Le noyau contient deux types de particules: -les protons chargés positivement -les neutrons électriquement neutres. Les protons chargés de même signe se repoussent Comment expliquer alors la stabilité du noyau?

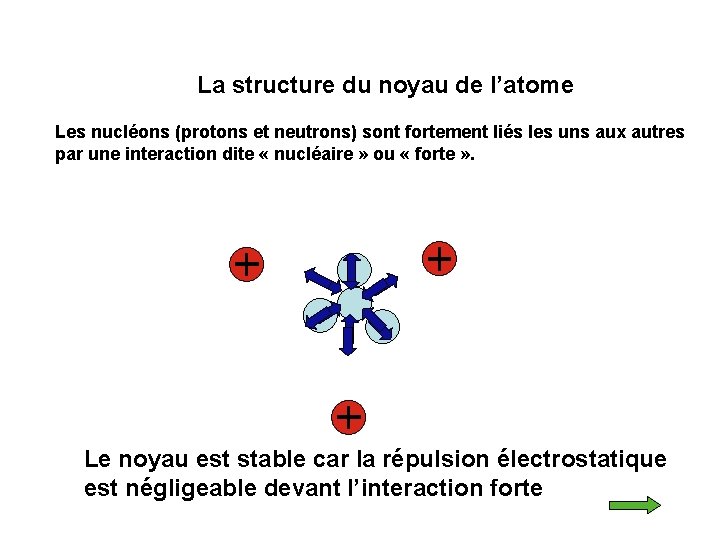
La structure du noyau de l’atome Les nucléons (protons et neutrons) sont fortement liés les uns aux autres par une interaction dite « nucléaire » ou « forte » . Le noyau est stable car la répulsion électrostatique est négligeable devant l’interaction forte

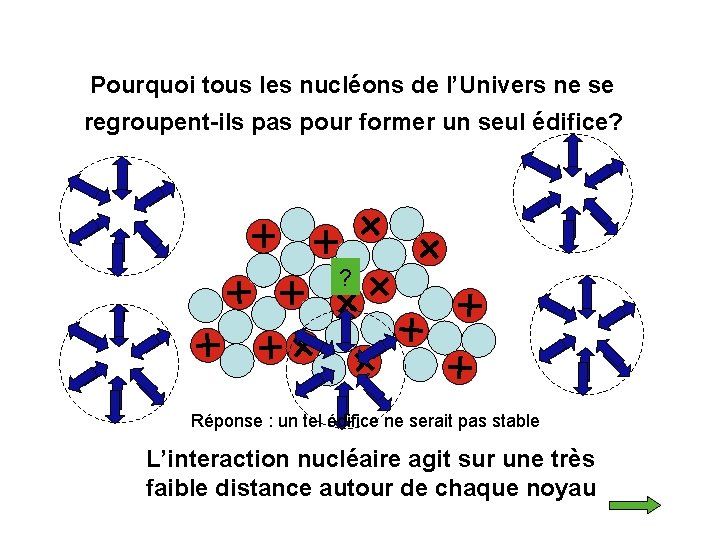
Pourquoi tous les nucléons de l’Univers ne se regroupent-ils pas pour former un seul édifice? ? Réponse : un tel édifice ne serait pas stable L’interaction nucléaire agit sur une très faible distance autour de chaque noyau

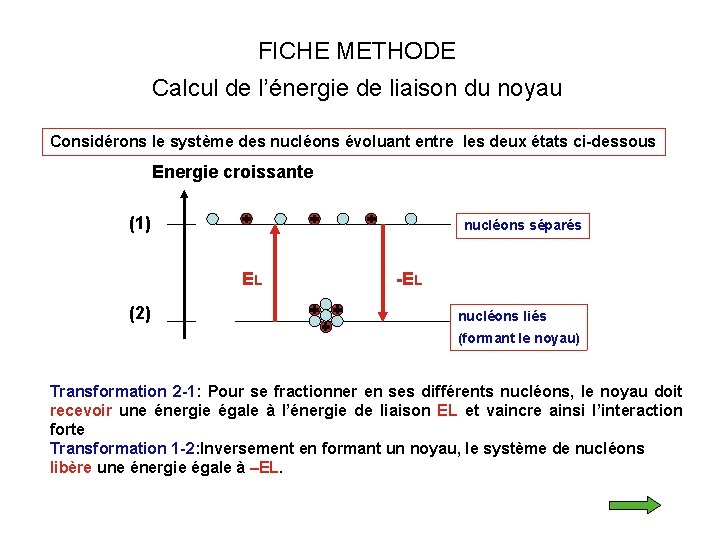
FICHE METHODE Calcul de l’énergie de liaison du noyau Considérons le système des nucléons évoluant entre les deux états ci-dessous Energie croissante (1) nucléons séparés EL (2) -EL nucléons liés (formant le noyau) Transformation 2 -1: Pour se fractionner en ses différents nucléons, le noyau doit recevoir une énergie égale à l’énergie de liaison EL et vaincre ainsi l’interaction forte Transformation 1 -2: Inversement en formant un noyau, le système de nucléons libère une énergie égale à –EL.

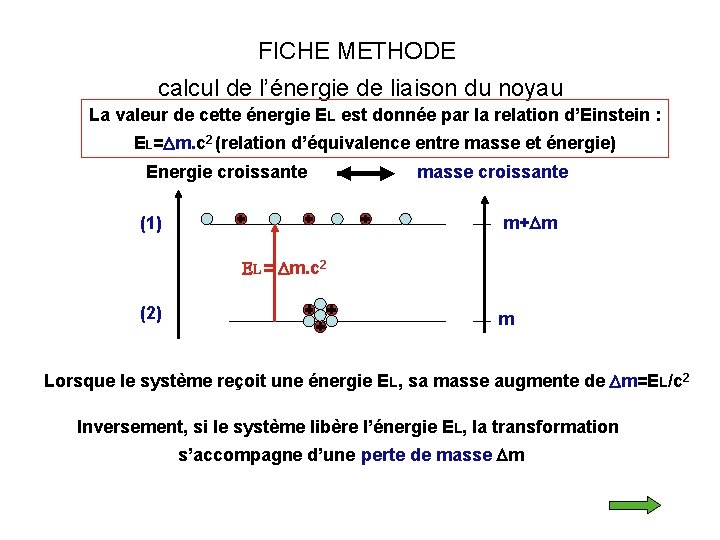
FICHE METHODE calcul de l’énergie de liaison du noyau La valeur de cette énergie EL est donnée par la relation d’Einstein : EL=Dm. c 2 (relation d’équivalence entre masse et énergie) Energie croissante masse croissante (1) m+Dm EL= Dm. c 2 (2) m Lorsque le système reçoit une énergie EL, sa masse augmente de Dm=EL/c 2 Inversement, si le système libère l’énergie EL, la transformation s’accompagne d’une perte de masse Dm

FICHE METHODE A=N+Z calcul de l’énergie de liaison du noyau Z X EL=Dm. c 2 =[Zmp + (A-Z)mn-Mx]. c 2. Il est commode d’exprimer Dm en unité de masse atomique (u) Sachant qu’ 1 mole d’unités de masse atomique a une masse de 1 gramme 6, 022. 1023 x 1 u=1, 000 g 1 u=(10 -3 kg)/ (6, 0220. 1023)=1, 66054. 10 -27 kg

D’après la relation d’Einstein, masse et énergie sont liées. Une unité de masse atomique correspond à une énergie de : E=1 u. c 2=1, 66054. 10 -27 kgx(299792458 m. s-1)2=1492, 42. 10 -13 J En chimie, on exprime parfois les énergies de liaisons chimiques en électronvolt(e. V) 1 ev=1, 602177. 10 -19 J L’énergie libérée par une réaction nucléaire est environ 1 million de fois plus grande. Pour calculer l’énergie de liaison, on utilise donc le mégaélectronvolt (Me. V) L’unité de masse atomique correspond donc à une énergie égale à : E=1492, 42. 10 -13/1, 602177. 10 -13=931, 5 Me. V. Le calcul de EL peut ainsi s’effectuer directement en unité d’énergie EL=[Zmp + (A-Z)mn-Mx]. c 2. =Dm(u). 931, 5(Me. V/u)

La stabilité du noyau Plus un noyau est lourd (A élevé), plus son énergie de liaison est importante. Toutefois, cela n’implique pas qu’il soit plus stable. (si un seul nucléon est instable, c’est tout l’édifice qui s’écroule, . . comme un château de cartes! ) La stabilité est d’autant plus grande que l’énergie de liaison par nucléon EL/A est grande Ainsi, pour l’uranium 235, EL/A=7, 7 Me. V par nucléon Pour le fer 56, EL/A=8, 79 Me. V par nucléon: le fer est plus stable que l’uranium

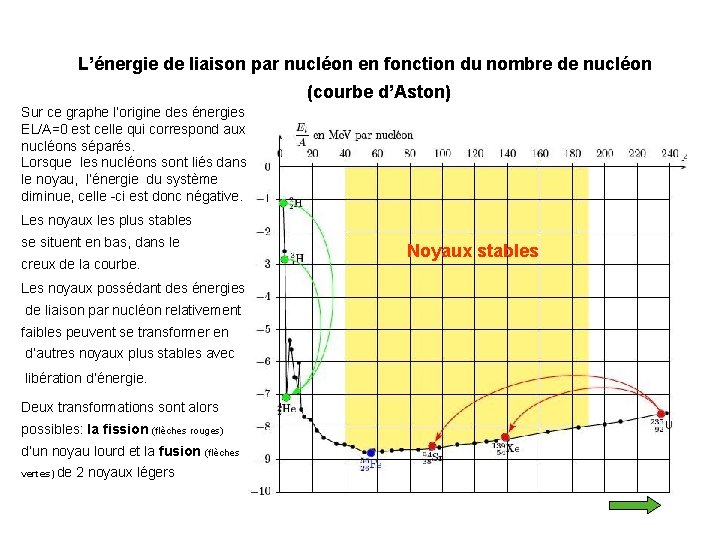
L’énergie de liaison par nucléon en fonction du nombre de nucléon (courbe d’Aston) Sur ce graphe l’origine des énergies EL/A=0 est celle qui correspond aux nucléons séparés. Lorsque les nucléons sont liés dans le noyau, l’énergie du système diminue, celle -ci est donc négative. Les noyaux les plus stables se situent en bas, dans le creux de la courbe. Les noyaux possédant des énergies de liaison par nucléon relativement faibles peuvent se transformer en d’autres noyaux plus stables avec libération d’énergie. Deux transformations sont alors possibles: la fission (flèches rouges) d’un noyau lourd et la fusion (flèches vertes) de 2 noyaux légers Noyaux stables

EXEMPLE NUMERIQUE: Calculer les énergies de liaison des deux isotopes 85 et 89 du rubidium(Z=37) L’un d’eux est radioactif , lequel? Justifier. Perte de masse lors de la formation du Rubidium 85: Dm=[37. 1, 00728+(85 -37). 1, 00866 -4, 89144]u=0, 79360 u Energie de liaison: EL=Dm(u). 931, 5 Me. V/u=0, 79360. 931, 5=739, 2 Me. V Perte de masse lors de la formation du Rubidium 89: Dm=[37. 1, 00728+(89 -37). 1, 00866 -88, 89193]u=0, 82775 u EL=Dm(u). 931, 5 Me. V/u=0, 82775. 931, 5=771, 0 Me. V Calculons l’énergie de liaison par nucléon Rubidium 85: EL/A=739, 2/85=8, 70 Me. V par nucléon Rubidium 89: EL/A=771, 0/89=8, 66 Me. V par nucléon Ce dernier est donc moins stable, c’est lui qui peut se désintégrer Pour retour: Pour quitter: « Echap »