Isotopes Latome est constitu dun noyau central charg










- Slides: 13

Isotopes

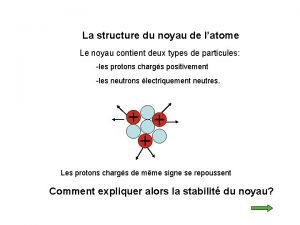
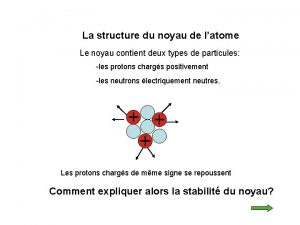
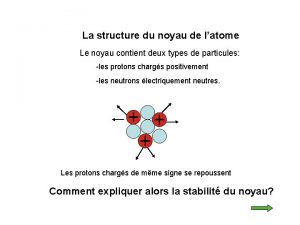
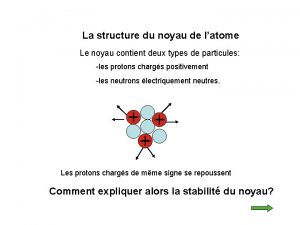
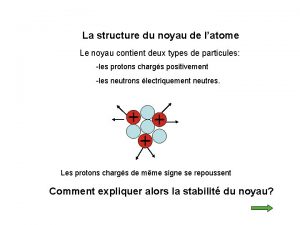
L’atome est constitué : ü d'un noyau central, chargé positivement, qui est un assemblage de protons et de neutrons. ü d'un nuage périphérique composé d'un cortège d'électrons, chargés négativement, qui tournent à des vitesses prodigieuses autour du noyau Particule Electron Proton Neutron Isotopes et masses exactes masse (uma) charge électrique (C) 5, 49. 10 -4 - 1, 6. 10 -19 1, 0073 + 1, 6. 10 -19 1, 0086 0 2

Classification des éléments Isotopes et masses exactes 3

Isotopes - Nombre de masse n Nombre de masse A = nombre de nucléons (protons + neutrons) n Isotopes : - atomes d’un même élément qui contiennent un nombre identique de protons mais un nombre différent de neutrons - atomes qui ont le même nombre Z mais un nombre A différent Exemple : le chlore naturel (Z = 17 ) est constitué de 2 isotopes : le chlore-35 et le chlore-37 Nombre Z Nombre A Electrons Protons Neutrons = A-Z Isotopes et masses exactes chlore-35 17 17 18 chlore-37 17 17 20 4

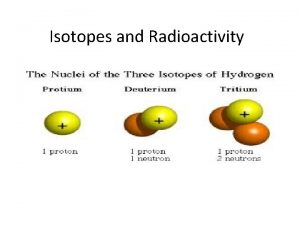
Isotopes Voici un exemple avec l’hydrogène: DEUTÉRIUM (H 2) PROTIUM (H 1) TRITIUM (H 3) N P P E N P E MASSE = 1 N E MASSE = 2 MASSE = 3 P E N PROTON ELECTRON NEUTRON

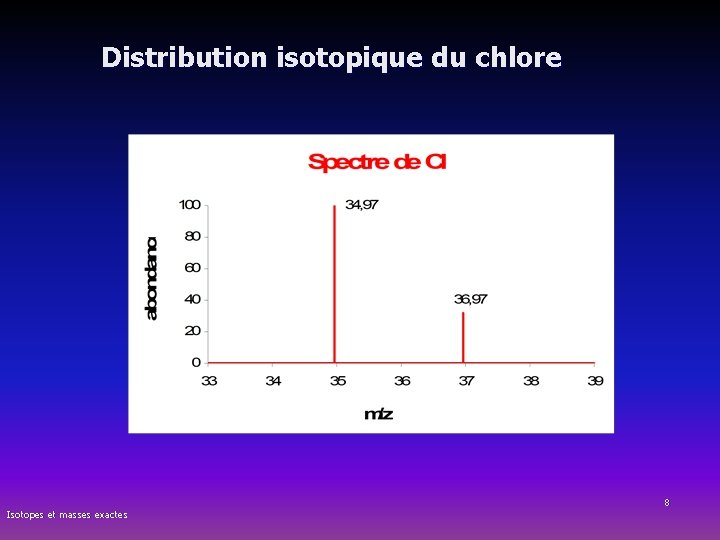
Abondance isotopique Masse moyenne pondérée n Abondance isotopique = pourcentage des isotopes d’un élément n Masse moyenne pondérée = Masse atomique apparaissant sur le tableau périodique et qui tient compte des isotopes et de leur abondance Exemple : Chlore-35 Chlore-37 nbre A 35 37 masse isotopique 34, 97 36, 97 abondance en % (1) 75, 8% 24, 2% abondance relative(2) 100 32, 5 Masse moyenne pondérée du chlore (MM) : = (0, 758 * 34, 97 uma) + (0, 242 * 36, 97 uma) = 35, 454 uma (1) (2) Isotopes et masses exactes = nombre moyen d’isotope cité pour 100 atomes de l’élément = nombre moyen d’isotope cité pour 100 isotopes majoritaires 6

Masse pondérée du chlore Masse moyenne pondérée du chlore (MM) : = (0, 758 * 34, 97 uma) + (0, 242 * 36, 97 uma) = 35, 454 uma Isotopes et masses exactes 7

Distribution isotopique du chlore Isotopes et masses exactes 8

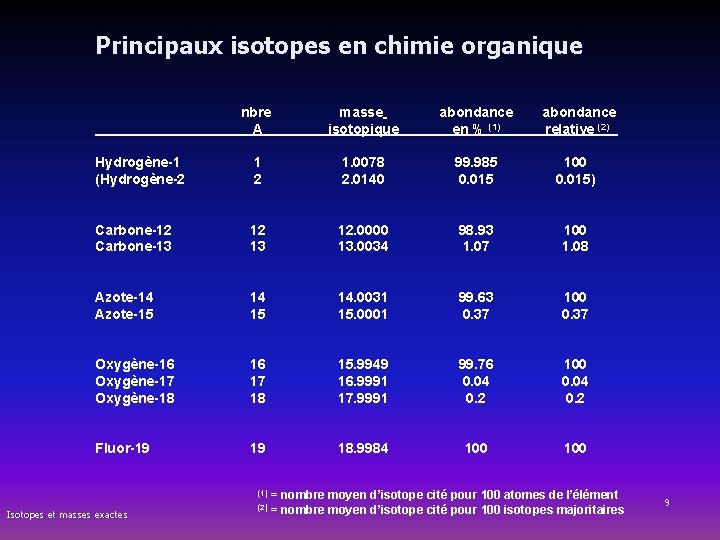
Principaux isotopes en chimie organique nbre A 1 2 masse isotopique abondance en % (1) abondance relative (2) 1. 0078 2. 0140 99. 985 0. 015 100 0. 015) Carbone-12 Carbone-13 12. 0000 13. 0034 98. 93 1. 07 100 1. 08 Azote-14 Azote-15 14. 0031 15. 0001 99. 63 0. 37 100 0. 37 Oxygène-16 Oxygène-17 Oxygène-18 16 17 18 15. 9949 16. 9991 17. 9991 99. 76 0. 04 0. 2 100 0. 04 0. 2 Fluor-19 19 18. 9984 100 Hydrogène-1 (Hydrogène-2 (1) = nombre moyen d’isotope cité pour 100 atomes de l’élément Isotopes et masses exactes (2) = nombre moyen d’isotope cité pour 100 isotopes majoritaires 9

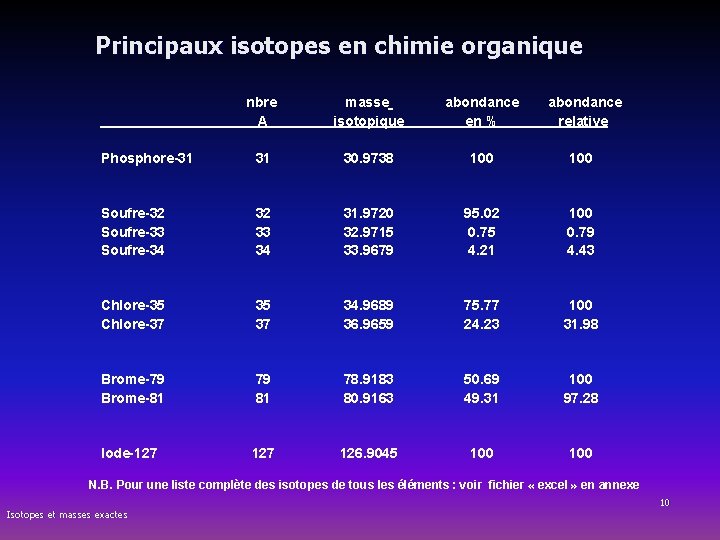
Principaux isotopes en chimie organique nbre A 31 masse isotopique abondance en % abondance relative 30. 9738 100 Soufre-32 Soufre-33 Soufre-34 32 33 34 31. 9720 32. 9715 33. 9679 95. 02 0. 75 4. 21 100 0. 79 4. 43 Chlore-35 Chlore-37 35 37 34. 9689 36. 9659 75. 77 24. 23 100 31. 98 Brome-79 Brome-81 79 81 78. 9183 80. 9163 50. 69 49. 31 100 97. 28 Iode-127 126. 9045 100 Phosphore-31 N. B. Pour une liste complète des isotopes de tous les éléments : voir fichier « excel » en annexe Isotopes et masses exactes 10

Calcul du pourcentage d’abondance de chaque isotope : Le néon possède 2 isotopes. La masse du néon 20 (20 Ne) équivaut à 19, 992 u tandis que celle du néon 22( 22 Ne) égale 21, 991 u. Sachant que la masse atomique moyenne du néon est de 20, 192 u, détermine le % abondance de chacun des isotopes. 11

Calcul du pourcentage d’abondance de chaque isotope : Le brome naturel est constitué de deux isotopes. 79 Br et 81 Br, dont les masses atomiques valent, respectivement 78, 9183, 9163. Sachant Que la masse atomique effective du brome est de 79, 904, calculer les pourcentages isotopiques présents dans le brome naturel. 12

Calcul du pourcentage d’abondance de chaque isotope : Le bore naturel est constitué de deux isotopes, 10 B et 11 B, dont les masses atomiques valent , respectivement, 10, 013 et 11, 009. Sachant que la masse atomique observée pour le bore vaut 10, 811, calculer l’abondance relative de à chaque isotope. 13
 Charg�� de mission
Charg�� de mission Bobine à noyau de fer
Bobine à noyau de fer Coude anatomie radiologique
Coude anatomie radiologique Noyau aromatique
Noyau aromatique Noyau épididymaire froid
Noyau épididymaire froid Centre semi ovale
Centre semi ovale Noyau thoracique de clarke
Noyau thoracique de clarke énergie de liaison d'un noyau
énergie de liaison d'un noyau Physiologie des noyaux gris centraux
Physiologie des noyaux gris centraux énergie de liaison d'un noyau
énergie de liaison d'un noyau étapes de la mitose
étapes de la mitose Noyau lenticulaire
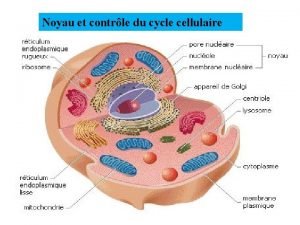
Noyau lenticulaire Noyau
Noyau Différenciation cortico-sous-corticale
Différenciation cortico-sous-corticale