Informes de Posicionamiento Teraputico IPT Evaluacin de medicamentos





















- Slides: 31

Informes de Posicionamiento Terapéutico (IPT): Evaluación de medicamentos a nivel nacional Juan Erviti López Jefe de la Sección de Información y Asesoría del Medicamento Abril 2015

Desarrollo de medicamentos Investigación básica Investigación clínica Fases I, II y III Dictamen del CHMP (Committee for Medicinal Products for Human Use)

Financiación de medicamentos La EMA / AEMPS autorizan La comisión interministerial de precios decide sobre… Si se financia o no el medicamento por el SNS A qué precio se financia

Medicamentos en el mercado Existen miles de principios activos Se necesita evaluar y seleccionar medicamentos Se necesita posicionar los medicamentos: definir el mejor abordaje de cada patología


Evaluación de medicamentos a nivel nacional

Evaluación a nivel nacional En mayo de 2013 Propuesta de colaboración para la elaboración de los informes de posicionamiento terapéutico de los medicamentos

Evaluación a nivel nacional Aprobado por la Comisión Permanente de Farmacia del SNS (Consejo Interterritorial) Consensuado por: - AEMPS - Dirección General de Cartera Básica de Servicios del SNS y Farmacia - Los representantes de las CCAA en la Comisión Permanente de Farmacia

Grupo de Coordinación del Posicionamiento Terapéutico el Jefe de Departamento de Medicamentos de Uso Humano de la AEMPS un representante de la DG Cartera Básica de Servicios un representante de cada una de las CCAA. el Secretariado: AEMPS. Podrán también asistir a las reuniones del GCPT otros técnicos

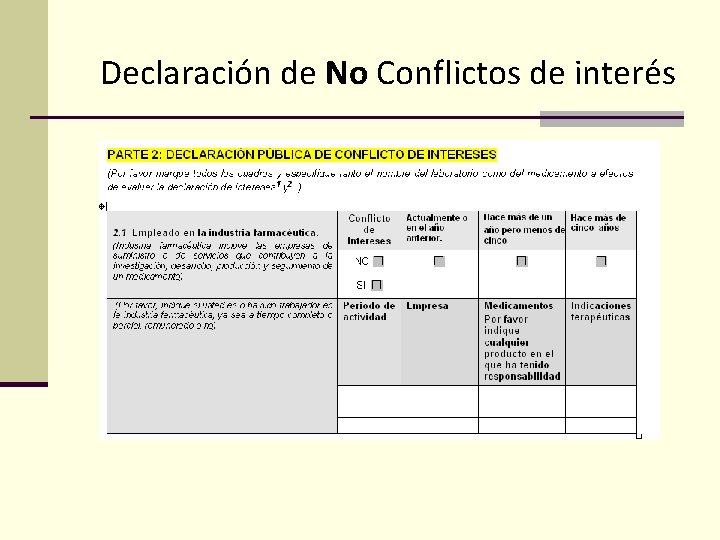
Declaración de No Conflictos de interés

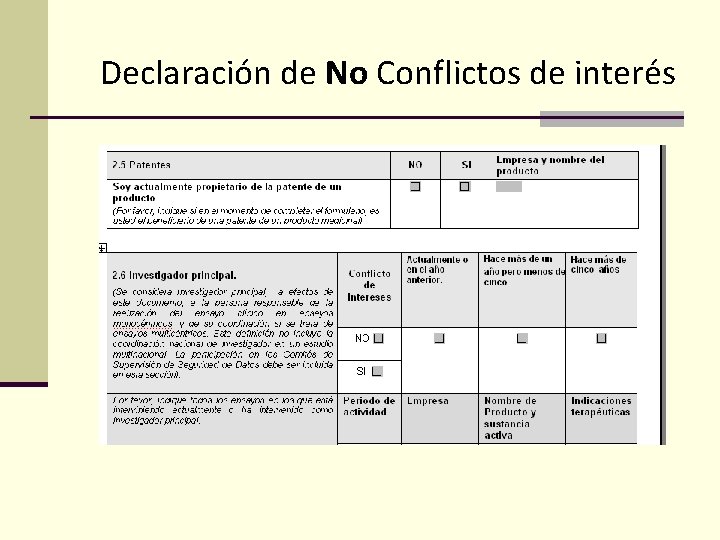
Declaración de No Conflictos de interés

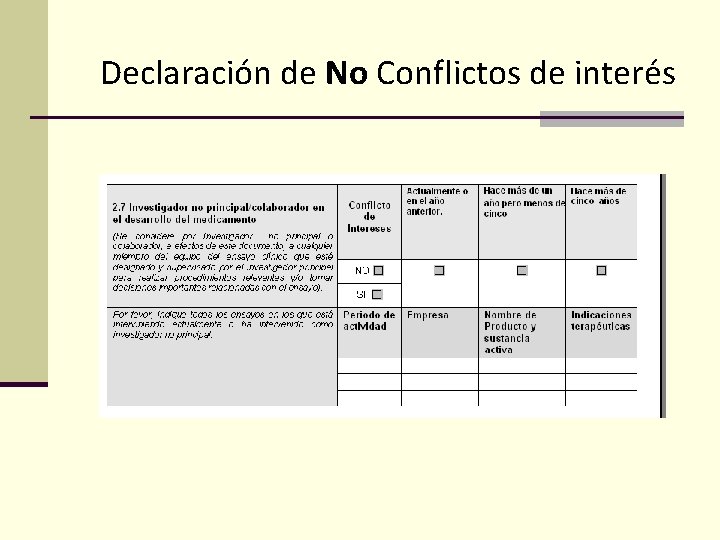
Declaración de No Conflictos de interés

Declaración de No Conflictos de interés

Declaración de No Conflictos de interés

Declaración de No Conflictos de interés

Declaración de No Conflictos de interés

Procedimiento del GCPT Se revisan las opiniones positivas del CHMP Se deciden los IPT a realizar El primer borrador lo realiza la AEMPS junto con otras 2 CCAA Se circula el borrador a las partes interesadas: laboratorio, sociedades científicas, asociaciones de pacientes, etc.

Procedimiento del GCPT Se valoran las opiniones de expertos Valoración de todas las CCAA Se remite el borrador de IPT a la comisión interministerial de fijación de precio IPT definitivo

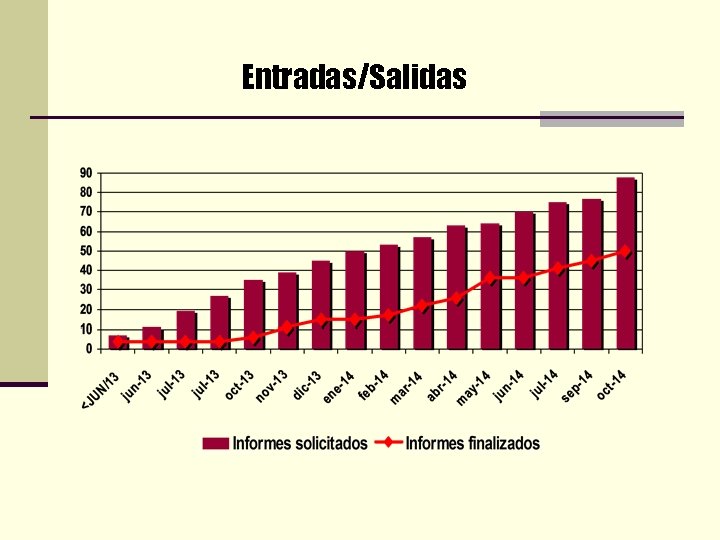
Entradas/Salidas

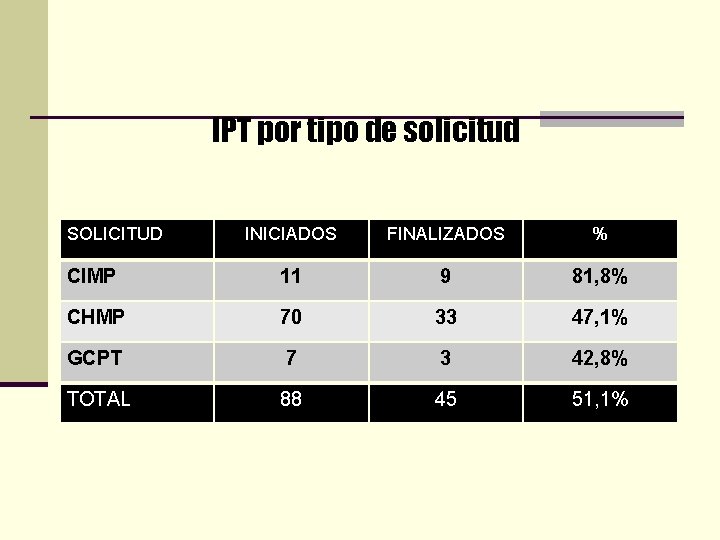
IPT por tipo de solicitud SOLICITUD INICIADOS FINALIZADOS % CIMP 11 9 81, 8% CHMP 70 33 47, 1% GCPT 7 3 42, 8% TOTAL 88 45 51, 1%

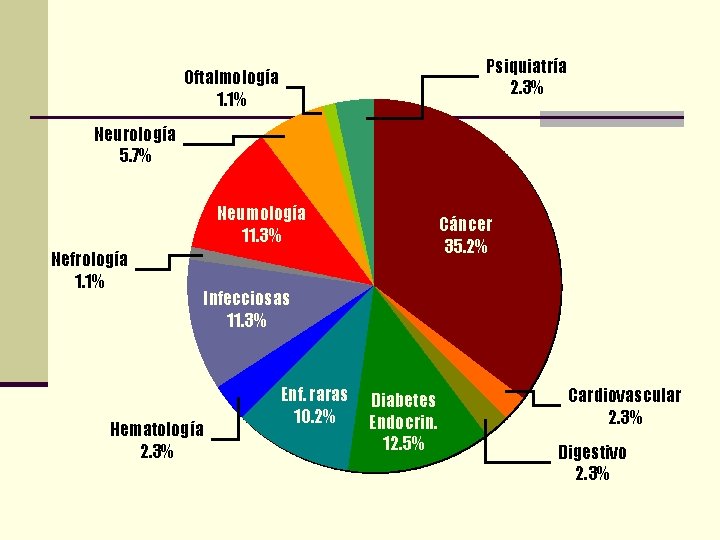
Psiquiatría 2. 3% Oftalmología 1. 1% Neurología 5. 7% Neumología 11. 3% Nefrología 1. 1% Cáncer 35. 2% Infecciosas 11. 3% Hematología 2. 3% Enf. raras 10. 2% Diabetes Endocrin. 12. 5% Cardiovascular 2. 3% Digestivo 2. 3%

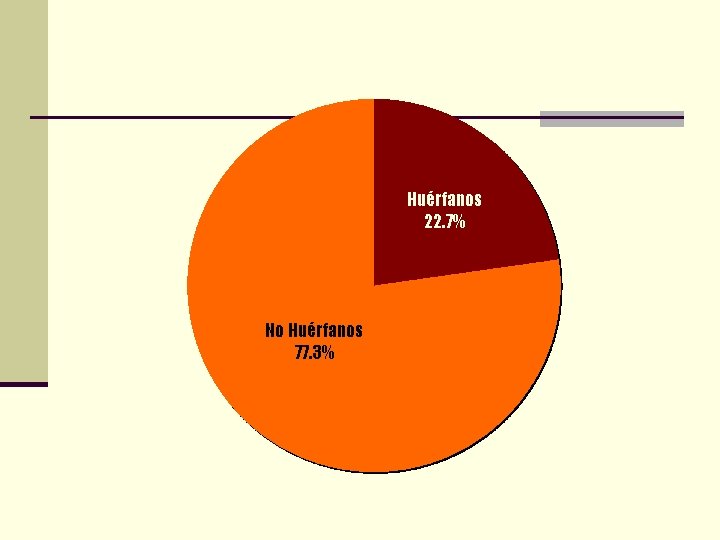
Huérfanos 22. 7% No Huérfanos 77. 3%

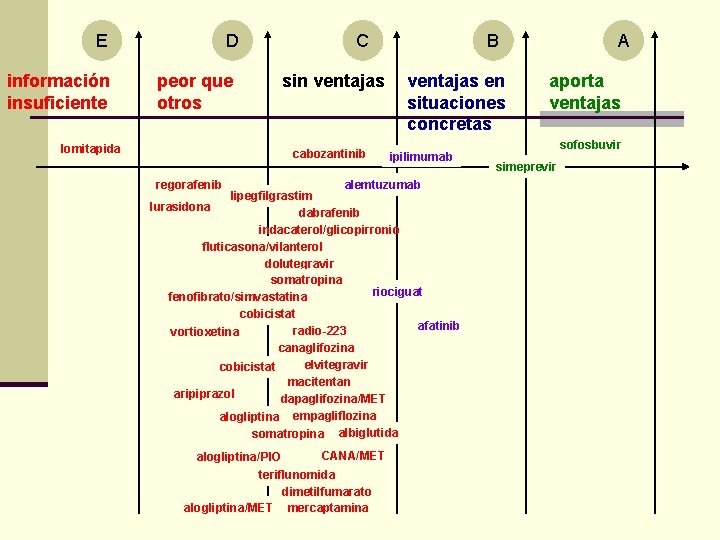
E información insuficiente D peor que otros lomitapida C sin ventajas cabozantinib regorafenib B ventajas en situaciones concretas ipilimumab alemtuzumab lipegfilgrastim lurasidona dabrafenib indacaterol/glicopirronio fluticasona/vilanterol dolutegravir somatropina riociguat fenofibrato/simvastatina cobicistat afatinib radio-223 vortioxetina canaglifozina elvitegravir cobicistat macitentan aripiprazol dapaglifozina/MET alogliptina empagliflozina somatropina albiglutida alogliptina/PIO CANA/MET teriflunomida dimetilfumarato alogliptina/MET mercaptamina A aporta ventajas sofosbuvir simeprevir


Hechos clave que condicionaron el desarrollo de medicamentos Ley de Bayh-Dole Los Departamentos de Marketing toman el control de las compañías farmacéuticas Creación de la ICH, Conferencia Internacional de Armonización

Ley de Bayh-Dole El 85% de los nuevos medicamentos: “me too” Del 15% restante (verdaderas innovaciones), 2/3 los desarrolla el sistema público de EEUU En EEUU se permite a los investigadores públicos vender la patente de los medicamentos descubiertos (ley Bayh-Dole) Algunos ejemplos: AZT, paclitaxel (Taxol), eritropoyetina, imatinib (Glivec), cerezyme, enfuvirtida (Fuzeon), abiraterona, etc.

International Conference for Harmonization, ICH 1980. Creación de la ICH. La máxima “colaboración” público-privada. Consecuencias: Relajación sutil de los requisitos para la aprobación de medicamentos Ensayos de no-inferioridad Plan de Gestión de Riesgos Comparación injustificada frente a placebo Variables intermedias (glitazonas y riesgo CV, etc. ) Duración insuficiente ECAs (asma y EPOC, 12 sem, etc. )

International Conference for Harmonization, ICH Licencia adaptativa (pilotaje) Ejemplo de “relajación en la aprobación”: umeclidinio + vilanterol en EPOC La EMA lo aprueba en 2014 (votos en contra de España e Italia): la asociación no presenta ventajas frente al umeclidinio solo. La EMA requiere un estudio fase IV para evaluar un posible aumento de incidencia de episodios CV y cerebrales La EMA permite que los estudios exigidos en el Plan de Riesgos se entreguen en el 3 er cuatrimestre de 2024 (patente ya caducada)

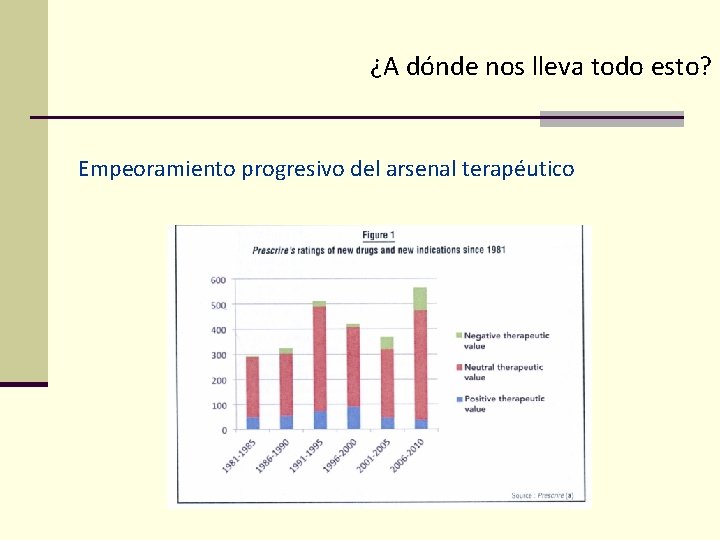
¿A dónde nos lleva todo esto? Empeoramiento progresivo del arsenal terapéutico

¿A dónde nos lleva todo esto? Aumento de las ganancias de las compañías farmacéuticas

Disponibilidad de los IPT http: //www. aemps. gob. es/medicamentos. Uso. Humano/informes. Publicos/home. htm
 Posicionamiento publicitario
Posicionamiento publicitario “control de grua” and posicionamiento
“control de grua” and posicionamiento Listado de aspectos positivos de mi desempeño en la vida
Listado de aspectos positivos de mi desempeño en la vida Ejemplos de segmentacion geografica
Ejemplos de segmentacion geografica Paradigmas de interacción
Paradigmas de interacción Teraputico
Teraputico Teraputico
Teraputico Evaluacin
Evaluacin Que es la heteroevaluacion
Que es la heteroevaluacion Pasos para elaborar un informe
Pasos para elaborar un informe Con que se evalua
Con que se evalua Ambiguo significado
Ambiguo significado Evaluacin
Evaluacin Evaluacin
Evaluacin Caratulas para informes
Caratulas para informes Evaluacin
Evaluacin Folfiri esquema
Folfiri esquema Tipos de informes sociales
Tipos de informes sociales Evaluacin
Evaluacin Teraputico
Teraputico Ejercicios activos libres
Ejercicios activos libres Teraputico
Teraputico Tipos de informe expositivo
Tipos de informe expositivo Integrated product team roles and responsibilities
Integrated product team roles and responsibilities Telephanty
Telephanty Esta ipt
Esta ipt Wmu ipt
Wmu ipt Apa itu ipt
Apa itu ipt Tofel ets
Tofel ets Fiu ipt
Fiu ipt Hsc multiple choice generator
Hsc multiple choice generator Wmu ipt
Wmu ipt