Ikatan Kovalen Koordinasi SMAN 1 Kota Serang Akmalia
















- Slides: 20

Ikatan Kovalen Koordinasi SMAN 1 Kota Serang Akmalia Mutiara Dewi

Tujuan Pembelajaran 1. Peserta didik mampu menjelaskan pengertian ikatan kovalen koordinasi 2. Peserta didik mampu menggambarkan proses pembentukan ikatan kovalen koordinasi 3. Peserta didik mampu menjelaskan sifat senyawa kovalen

Dalam ikatan kovalen terjadi penggunaan bersama pasangan elektron Masing-masing hidrogen dan klorin saling menyumbangkan 1 elektron. Masing-masing oksigen saling menyumbangkan 2 elektron Masing-masing nitrogen saling menyumbangkan 3 elektron

Bisakah pasangan elektron yang digunakan hanya berasal dari salah satu atom saja?

01 Pengertian Ikatan Kov. Koordinasi

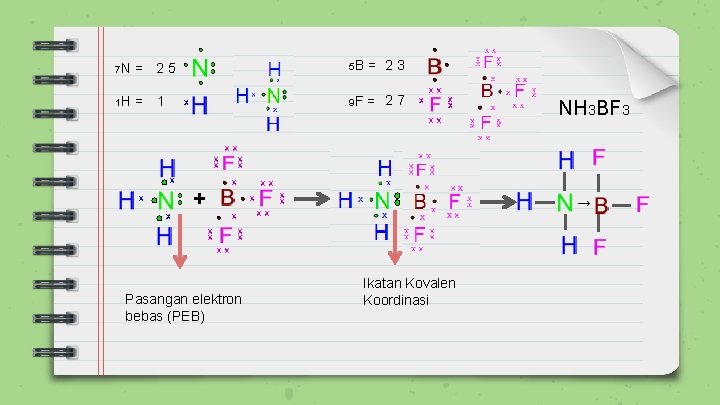
Pengertian Ikatan Kovalen Koordinasi Ikatan kovalen koordinasi adalah ikatan kovalen dimana pasangan elektron yang dipakai bersama berasal dari salah satu atom yang berikatan. Ikatan kovalen koordinasi terjadi jika salah satu atom mempunyai pasangan elektron bebas (PEB). Contoh: NH 4+ dan NH 3 BF 3.

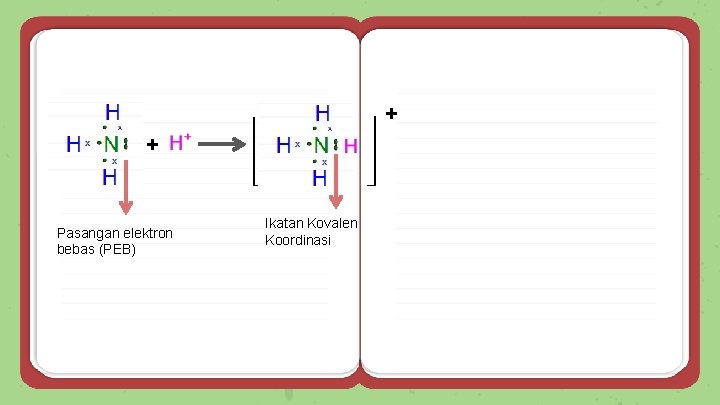
Proses pembentukan ikatan kovalen koordinasi ● 7 N =25 1 H =1 1 H = 1 (Melepaskan elektron)

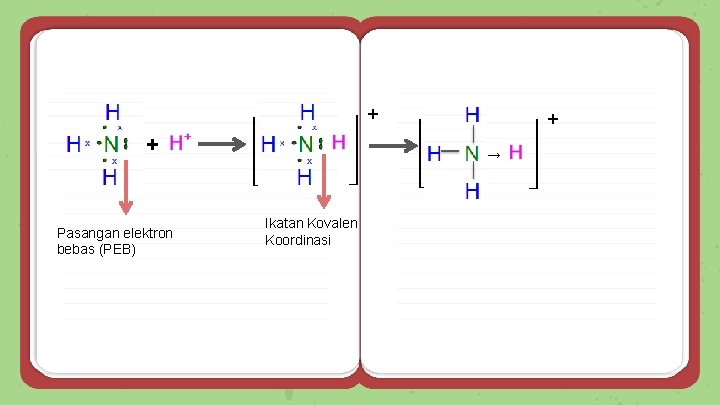
+ + Pasangan elektron bebas (PEB) Ikatan Kovalen Koordinasi

Ikatan kovalen koordinasi dinyatakan dengan tanda panah Atom penyedia pasangan elektron → Atom pengguna pasangan elektron

+ + Pasangan elektron bebas (PEB) + → Ikatan Kovalen Koordinasi

7 N = 25 5 B = 23 1 H = 1 9 F = 27 + Pasangan elektron bebas (PEB) NH 3 BF 3 → Ikatan Kovalen Koordinasi

1. Memiliki titik didih dan titik leleh yang rendah (di bawah 200°C). 2. Bersifat lunak dan tidak rapuh 3. Mudah larut dalam pelarut organik/nonpolar (alkohol, eter, dan benzena) dan sukar larut dalam pelarut polar 4. Pada umumnya larutannya tidak dapat menghantarkan arus listrik (kovalen nonpolar) tetapi ada juga yang dapat menghantarkan arus listrik (kovalen polar). Sifat -Sifa t Senya wa Koval en

2. Perhatikan tabel berikut ini: Soal Latihan 1. Gambarkan struktur Lewis untuk senyawa kovalen koordinasi berikut. a. SO 2 b. HNO 3 c. H 2 SO 4 Senyawa Titik Leleh Daya hantar listrik larutannya 1 17 Menghantarkan arus listrik 2 50 Tidak menghantarkan arus listrik 3 712 Menghantarkan arus listrik Sebutkan jenis ikatan yang membentuk ketiga senyawa tersebut!

a. SO 2 16 S 8 O = 286 = 26 + = →

7 N = 25 → c. HNO 3 1 H = 1 = 8 O = 26 + +

d. H 2 SO 4 1 H = 1 16 S + = 286 8 O = 26 + ↑ ↓

Soal Latihan 1. Gambarkan rumus titik elektron (struktur Lewis) dari molekul-molekul dibawah ini dan tentukan PEB & PEInya! a. b. c. d. e. f. g. Cl 2 O NCl 3 CH 4 PCl 3 Si. F 4 CO 2 P 2 O 3 2. Pasangan unsur berikut yang dapat membentuk senyawa dengan ikatan kovalen adalah. . . a. 17 X dan 11 Y b. 12 P dan 17 Q c. 6 R dan 17 Q d. 20 M dan 16 T e. 19 A dan 35 B

3. Senyawa berikut yang mempunyai ikatan rangkap dua adalah. . . a. CS 2 b. H 2 O c. CH 4 d. N 2 e. PCl 5 4. Diketahui nomor atom H = 1, C = 6, N = 7, O = 8, P = 15, dan Cl = 17. senyawa berikut yang tidak mengikuti aturan oktet adalah. . . a. CHCl 3 b. NH 3 c. H 2 O d. CH 4 e. PCl 5

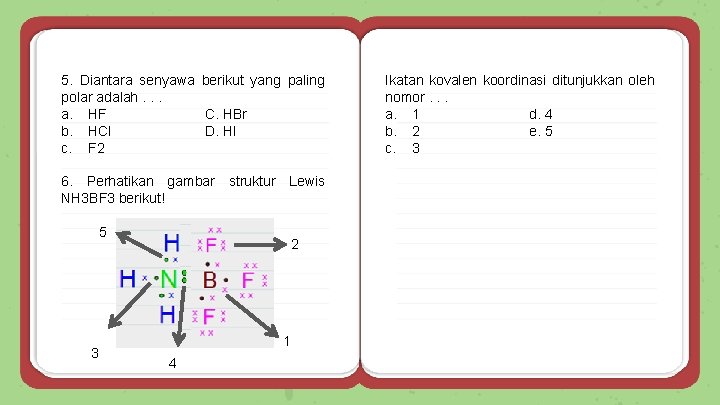
5. Diantara senyawa berikut yang paling polar adalah. . . a. HF C. HBr b. HCl D. HI c. F 2 6. Perhatikan gambar struktur Lewis NH 3 BF 3 berikut! 5 3 2 1 4 Ikatan kovalen koordinasi ditunjukkan oleh nomor. . . a. 1 d. 4 b. 2 e. 5 c. 3

Terimakasih
 Momen dipol adalah
Momen dipol adalah Susunan elektron neon
Susunan elektron neon Ikatan kovalen ialah
Ikatan kovalen ialah Maksud ikatan datif
Maksud ikatan datif Annullene
Annullene Bilangan sterik 3
Bilangan sterik 3 Pt. cakrawala mega indah
Pt. cakrawala mega indah Gambad
Gambad Akademi keperawatan pemda kabupaten serang
Akademi keperawatan pemda kabupaten serang Rumus jarak berpapasan
Rumus jarak berpapasan Sebuah mesin bila dioperasikan selama 4 jam dapat
Sebuah mesin bila dioperasikan selama 4 jam dapat Furahasekai
Furahasekai Sman 11 kab tangerang
Sman 11 kab tangerang Sman 99 jakarta
Sman 99 jakarta Sma negeri 2 kuala kapuas
Sma negeri 2 kuala kapuas Bilangan koordinasi
Bilangan koordinasi Penyusun sistem saraf pusat adalah
Penyusun sistem saraf pusat adalah Sistem koordinasi
Sistem koordinasi Combining clauses
Combining clauses Contoh penerapan wog best practice
Contoh penerapan wog best practice Koordinasi integrasi sinkronisasi simplifikasi
Koordinasi integrasi sinkronisasi simplifikasi