IKATAN ION DAN IKATAN KOVALEN Oleh Dewi Nuraini










- Slides: 17

IKATAN ION DAN IKATAN KOVALEN Oleh: Dewi Nuraini

Ikatan ion terbentuk antara atom logam dengan atom non logam. Atom Logam cenderung untuk melepas elektron, sementara atom non logam cenderung untuk menerima elektron. Atom yang melepas elektron berubah menjadi ion positif, sedangkan atom yang menerima elektron menjadi ion negatif. Antara ion-ion yang berlawanan muatan ini, terjadi tarik-menarik (gaya elektrostatik) yang disebut ikatan ion.

Ikatan ion (elektrovalen) adalah ikatan yang terjadi karena adanya gaya tarikmenarik elektrostatik antara ion positif dan ion negatif.

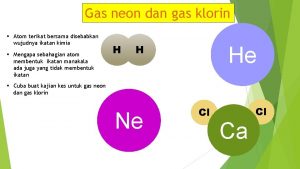
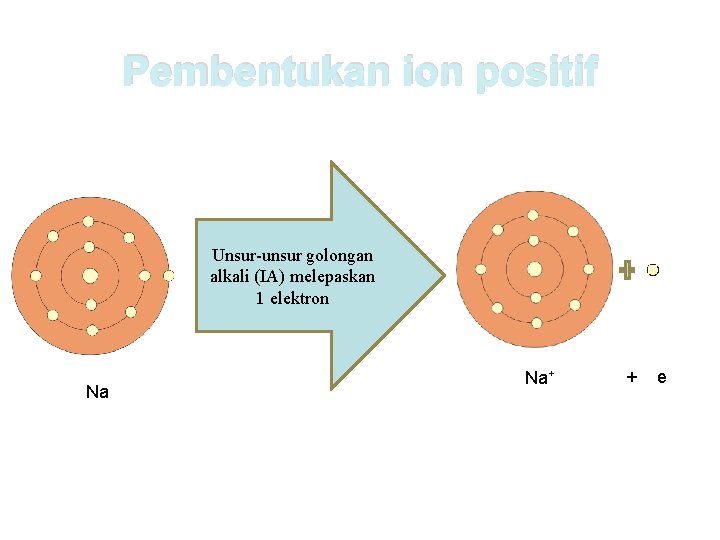
Ion positif terbentuk ketika suatu atom melepaskan elektron. Atom-atom yang cenderung mudah melepaskan elektron valensi terletak pada golongan IA (kecuali H), golongan IIA, dan golongan IIIA. Masing-masing melepaskan 1 dan 2, dan 3 elektronnya.

Pembentukan ion positif Unsur-unsur golongan alkali (IA) melepaskan 1 elektron Na Na+ + e

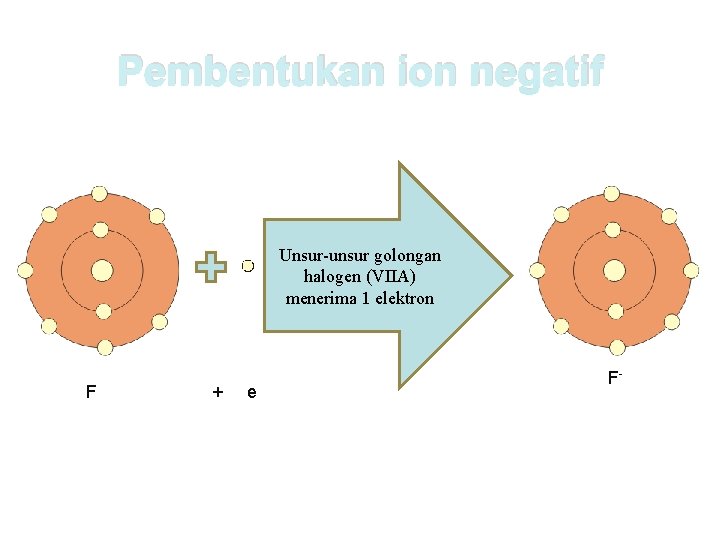
Ion negatif terbentuk ketika suatu atom menerima elektron. Atom-atom yang mudah menerima elektron terletak pada golongan VA, VIA dan VIIA. Karena mempunyai afinitas elektron yang besar. Untuk memperoleh kestabilan, sesuai dengan aturan oktet, unsur dengan valensi 5, 6 dan 7 akan dengan mudah menerima elektron.

Pembentukan ion negatif Unsur-unsur golongan halogen (VIIA) menerima 1 elektron F + e F-

Ikatan kovalen sering disebut juga dengan ikatan homo polar. Ikatan kovalen adalah ikatan yang terjadi karena penggunaan bersama elektron oleh dua atom yang berikatan. Ikatan kovalen biasanya terjadi antara atom nonlogam dengan atom nonlogam. Penggunaan bersama pasangan elektron biasanya menggunakan notasi titik elektron atau dikenal dengan struktur lewis.

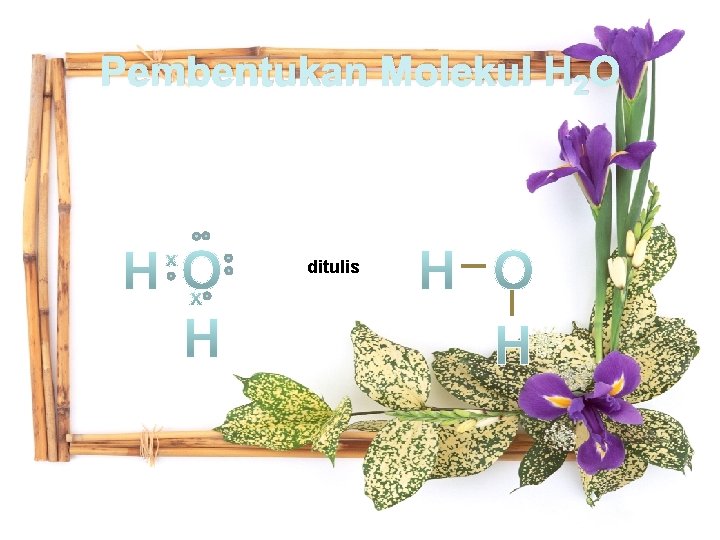
Ikatan kovalen tunggal terjadi pada senyawa seperti Hidrogen (H 2), Asamklorida (HCl), Metana (CH 4), Air (H 2 O) dll. Pembentukan kovalen tunggal dapat dilihat dari contoh berikut : 1. Pembentukan molekul H 2 2. Pembentukan Molekul H 2 O

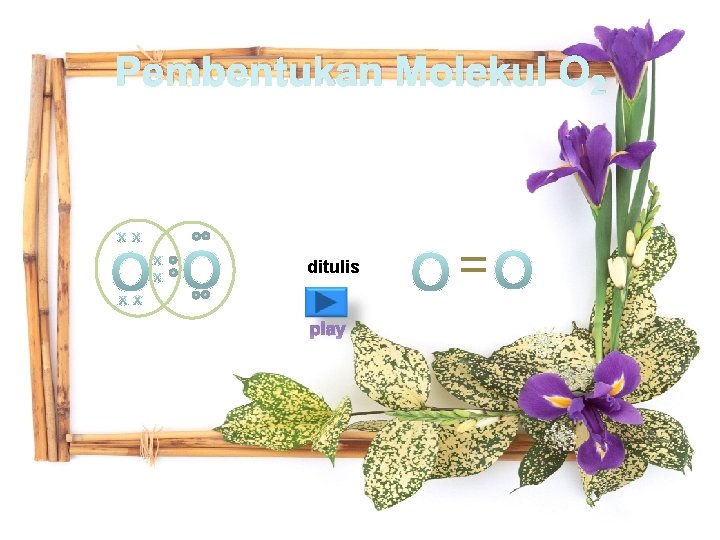
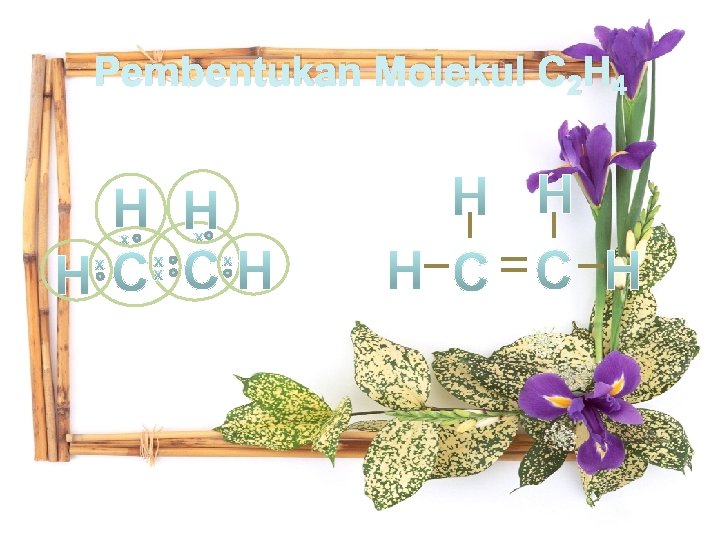
Ikatan kovalen rangkap adalah ikatan kovalen yang mempunyai ikatan tak jenuh karena ikatan antar atomnya lebih dari satu. Pembentukan ikatan rangkap dua dapat dilihat dari contoh berikut: 1. Pembentukan molekul O 2 2. Pembentukan molekul C 2 H 4

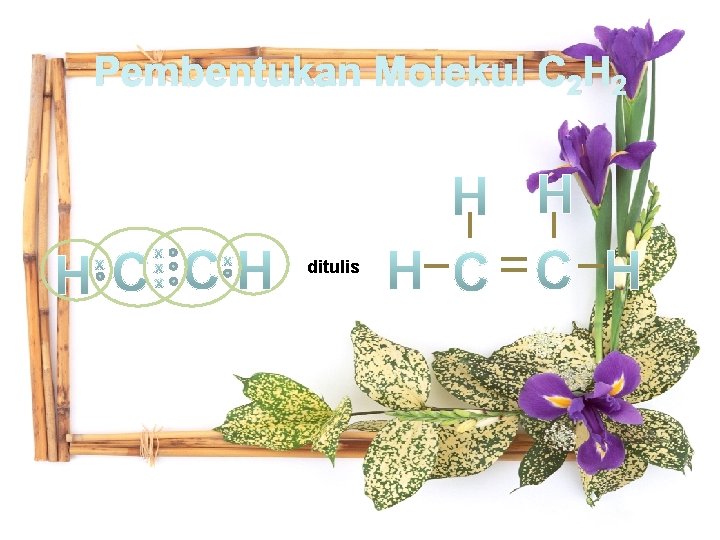
Ikatan kovalen rangkap tiga adalah ikatan kovalen yang mempunyai tiga pasangan elektron yang dipakai secara bersama Pembentukan ikatan rangkap tiga dapat dilihat dari contoh berikut: 1. Pembentukan molekul C 2 H 2

Berdasarkan asal elektron yang digunakan untuk berikatan, dikenal adanya ikatan kovalen dan ikatan kovalen koordinasi. Ikatan kovalen terjadi apabila elektron yang digunakan untuk berikatan masing-masing berasal dari dua atom yang berikatan sedangkan ikatan kovalen koordinasi adalah ikatan yang terjadi apabila elektron ikatan hanya berasal dari salah satu atom yang berikatan. Contoh: klik

Pembentukan Molekul H 2 O ditulis

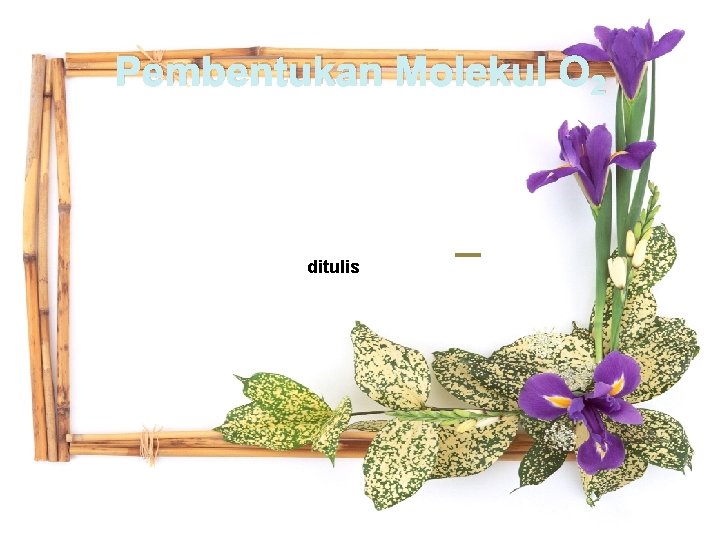
Pembentukan Molekul O 2 ditulis play

Pembentukan Molekul O 2 ditulis

Pembentukan Molekul C 2 H 4 ditulis

Pembentukan Molekul C 2 H 2 ditulis
 Klorin atom
Klorin atom Ikatan kovalen datif
Ikatan kovalen datif Bilangan sterik 3
Bilangan sterik 3 Teknik ikatan
Teknik ikatan Elektronegatifitas
Elektronegatifitas Momen dipol adalah
Momen dipol adalah Cognitevly
Cognitevly Ejemplo de fuerza ion ion
Ejemplo de fuerza ion ion Qumica
Qumica Uniones intermoleculares
Uniones intermoleculares Intermolecular forces
Intermolecular forces Ika atsari dewi
Ika atsari dewi Dewa dewi prediktor lll
Dewa dewi prediktor lll Nama lain dewi gayatri
Nama lain dewi gayatri Dewi retno suminar
Dewi retno suminar Contoh sediaan lepas lambat
Contoh sediaan lepas lambat Dewi ayu larasati
Dewi ayu larasati Dewa dewi predictor
Dewa dewi predictor