Hoofdstuk 2 Paragraaf 6 Een nieuwe eenheid de


























- Slides: 31

Hoofdstuk 2 Paragraaf 6 Een nieuwe eenheid: de mol

De wetenschappelijke notatie. In de wetenschappelijke notatie schrijf je een getal in de vorm: a. . 10 b Hierin is a een getal met één cijfer vóór. . . de komma Voorbeelden: 235, 6 =. . . . 2, 356. 102 0, 00000345 =. . . 3, 45. 10⁻ 6 61 6, 1. 101 =. . . 1, 470. 10⁻ 2 = 0, 01470. . .

Iets wat je kunt meten, noem je een. . . . grootheid Een grootheid geef je weer met een getal, gevolgd door de eenheid. . . . stelsel is een internationaal stelsel van Het SI eenheden (zie Binas, tabel 3 en 4) Voorbeelden: kilogram is een grootheid / eenheid oppervlak is een grootheid / eenheid temperatuur is een grootheid / eenheid tijd is een grootheid / eenheid seconde is een grootheid / eenheid

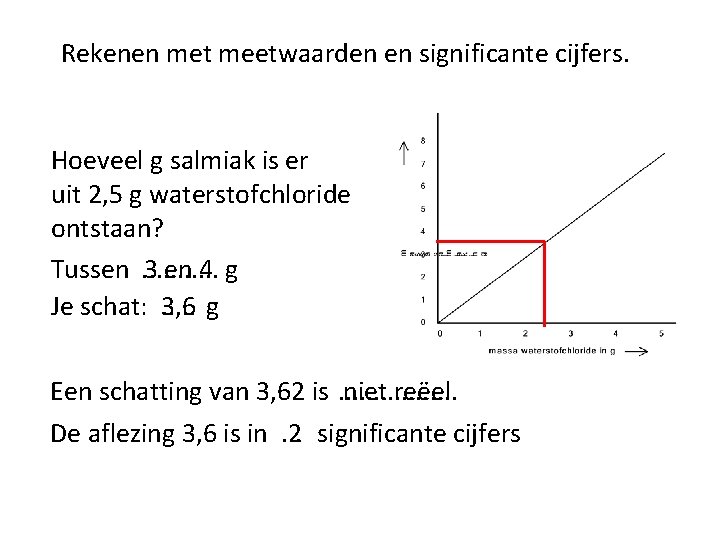
Rekenen met meetwaarden en significante cijfers. Als je ammoniak met waterstofchloride laat reageren, ontstaat salmiak: NH 3(g) + HCl(g) In een diagram is het aantal gram waterstofchloride uitgezet tegen het aantal gram salmiak: NH 4 Cl(s)

Rekenen met meetwaarden en significante cijfers. Hoeveel g salmiak is er uit 2, 5 g waterstofchloride ontstaan? Tussen. . . 3 en 4 g Je schat: . . . 3, 6 g Een schatting van 3, 62 is. . . . niet reëel De aflezing 3, 6 is in. . . 2 significante cijfers

Rekenen met meetwaarden en significante cijfers. Het getal 803, 0 is in. . . 4 significante cijfers Het getal 0, 00045 is in. . . 2 significante cijfers

Rekenen met meetwaarden en significante cijfers. Bij vermenigvuldigen of delen wordt het antwoord afgerond in het aantal significante cijfers van de meetwaarde met de minste. . significantie 8, 0 x 3, 4567 =. . . 28 0, 0045 x 3, 6789 = 0, 017. . Bij optellen of aftrekken is het aantal decimalen van het antwoord gelijk aan de meetwaarde met het minste. . . aantal decimalen. . . 3, 825 – 0, 4 = 3, 4 2100 + 0, 4 =. . 2100

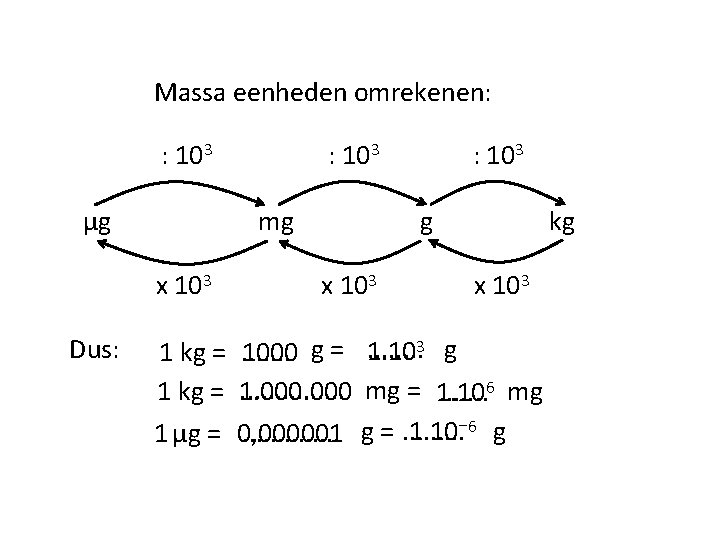
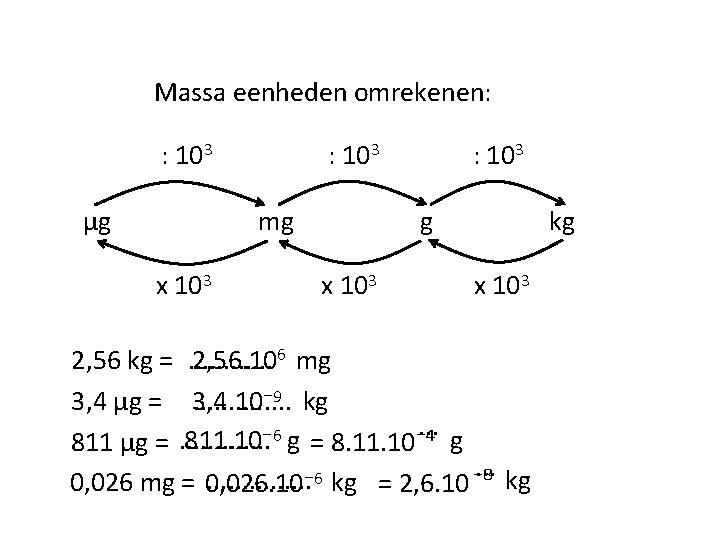
Massa eenheden omrekenen: : 103 μg mg x 103 Dus: : 103 1 kg = 1 μg = : 103 g x 103. . . . 1000 g =. . . . 1. 000 0, 000001. . . kg x 103 . . . . 3 g 1. 10 mg = 1. 10. . . . 6 mg g =. . 1. 10⁻ 6 g

Massa eenheden omrekenen: : 103 μg : 103 mg x 103 : 103 g x 103 kg x 103 2, 56. 106 mg 2, 56 kg =. . . 9 kg 3, 4 μg = 3, 4. 10⁻. . . . 6 811. 10⁻ g = 8. 11. 10⁻ 4 g 811 μg =. . . . 6 kg = 2, 6. 10 ⁻. . . 8 kg 0, 026 mg = 0, 026. 10⁻

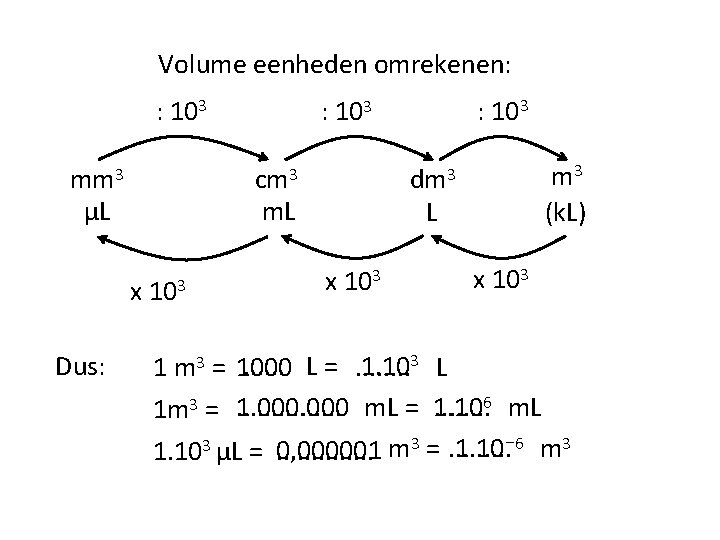
Volume eenheden omrekenen: : 103 mm 3 μL cm 3 m. L x Dus: 103 : 103 m 3 (k. L) dm 3 L x 103 1. 103 L. . . L =. . . . 1 m 3 = 1000. . . . m. L = 1. 10. . . . 6 m. L 1 m 3 = 1. 000 1. 10⁻ 6 m 3 0, 000001 m 3 =. . 1. 103 μL =. . .

Reken om: 2, 3. 109 μL 2, 3 m 3 =. . . 1, 23 m. L = 1, 23. 10⁻. . . 6 m 3 2, 50 μL = 2, 50. 10⁻. . . 6 dm 3 ⁻ 5 m 3 11, 4 m. L = 11, 4. 10⁻. . . . 6 m 3 = 1, 14. 10. . . 616 μL = 616. 10⁻. . . 6 L = 6, 16. 10⁻. . 4 L 11. . . 9 3. . . 411. 10 μL = 4, 11. 10 411 m = 0, 079 L = 0, 079. 10⁻ ⁻ 5 m 3. . . . 3 m 3 = 7, 9. 10. . .

In 6 weken tijd groeit je haar 3 cm. Bereken hoeveel μm je haar per seconde groeit 3 cm = 3. 10. . . . 4 μm 6 weken = 42 1008 uur = 3, 6. 10. . . dagen =. . . . 6 sec. Je haar groeit dan 3. 104. . . 3, 6. 106. . . 8. 10⁻ 3. . μm s⁻ 1 =. .

De MOL !!!!! • • • 1 dozijn = 12 1 gros = 144 Dus: …………………. . (? ? ? ). . . 23 1 mol = 6, 02. 10 Dit noemen we de. . . . . chemische hoeveelheid 6, 02. 1023 heet de constante van. . . . Avogadro (NA) Zie Binas, tabel 7

Waarom is 1 mol 6, 02. 1023 ? Tabel 7 B: . . . . 24 g 1 u = 1, 66. 10⁻ 27 kg = 1, 66. 10⁻ Hoeveel u is dan 1, 00 gram? x= u x 1, 00 gram 1, 66. 10⁻ 24 1, 00. . . . 1, 00 23 u = 6, 02. 10. . . 24 1, 66. 10⁻ Dus 1 gram = 6, 02. 1023 u 6, 02. 1023 is dus een omrekeningsfactor van gram u. . . . naar. .

1 molecuul H 2 O heeft massa: 2 x 1, 008 + 16, 00 = 18, 016. . . . . u Wat is de massa van 1 mol (= 6, 02. 1023) moleculen H 2 O? 6, 02. 1023 moleculen H 2 O hebben massa. . . . 6, 02. 1023 x 18, 016 = 1, 50. 10. . . 27 u Hoeveel gram is dit? 1, 50. 1027 u 1, 00 gram 1, 66. 10⁻ 24 x . . . . 1, 66. 10⁻ 24 x 1, 50. 1027 = 18, 016. . . gram x=. . . . 1, 00 Dus 1 mol (=6, 02. 1023) H 2 O moleculen hebben massa 18, 016 g

1 molecuul H 2 O heeft massa: 2. . . . . x 1, 008 + 16, 00 = 18, 02. . . u 1 moleculen H 2 O hebben massa 18, 02. . . g Het getal is dus hetzelfde, maar de eenheid is verschillend: De massa van een molecuul wordt uitgedrukt in. . . u De massa van 1 moleculen wordt uitgedrukt in. g. .

Dus: 1 mol = M gram !!! Waarin M de. . . atoom- of molecuulmassa. . . is De massa van 1 moleculen / atomen heet de MOLAIRE MASSA. . . . De molaire massa van CO 2 is 44, 010 g. . mol⁻ 1 Dit wil zeggen dat de massa van. . . . 1 mol CO 2 44, 010 g is

Bereken de molaire massa van CH 3 CH 2 OH. De molecuulmassa van CH 3 CH 2 OH is: 2 x 12, 01 u + 6. . . . x 1, 008 u +. . . 16, 00 u = 46, 07. . . . u 1 molecuul CH 3 CH 2 OH heeft dus massa 46, 07. . u. . g 1 mol CH 3 CH 2 OH moleculen hebben massa: 46, 07 Maar: kijk een naar tabel 98 !

Tabel 98 mol⁻ 1 De molaire massa van CH 3 OH is 32, 042. . g. . Dus: 1 mol CH 3 OH moleculen hebben massa. . . 32, 042 g Wat is de massa van 0, 0325 mol CH 3 OH moleculen? 0, 0325 aantal mol 1 aantal gram 32, 042 x 0, 0325 x 32, 042 = 1, 0414 x= 1. . . g De massa van 0, 0325 mol CH 3 OH moleculen is 1, 04

Tabel 98 mol⁻ 1 98, 079 g. . De molaire massa van H 2 SO 4 is. . . Dus: 1 mol H 2 SO 4 moleculen hebben massa. . . 98, 079 g Hoeveel (mol) H 2 SO 4 moleculen zitten in 2, 45 mg H 2 SO 4 ? aantal mol 1 x aantal gram 98, 079 2, 45. 10⁻ 3 1 x 2, 45. 10⁻ 3 x= = 2, 49799. 10⁻ 5 98, 079 In 2, 45 mg H 2 SO 4 zitten. . . . 2, 50. 10⁻ 5 moleculen

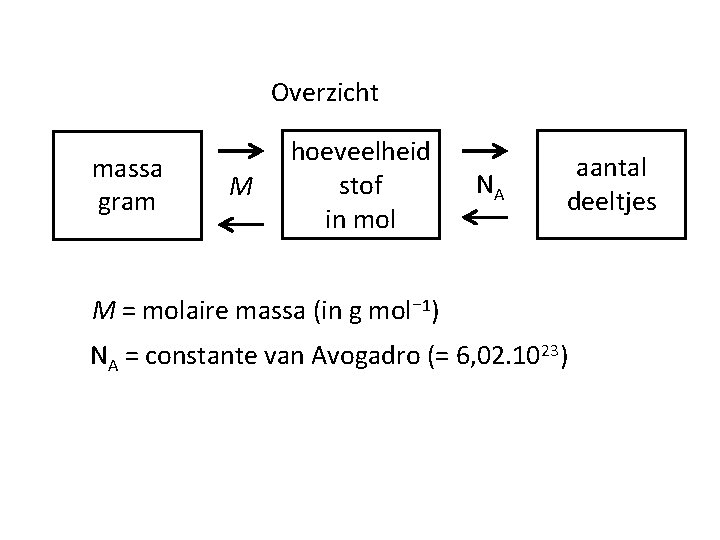
Overzicht massa gram M hoeveelheid stof in mol NA aantal deeltjes M = molaire massa (in g mol⁻ 1) NA = constante van Avogadro (= 6, 02. 1023)

En nu zelf: 1. Bereken de massa van 5, 13 mmol KMn. O 4 2. Hoeveel moleculen zitten in 0, 918 mg H 2 CO ? 3. Bereken de massa van 2, 80 kmol HNO 3 4. Hoeveel moleculen zitten in 3, 18. 103 kg HCl? Antwoorden: 1. 811 mg (0, 811 g) 2. 3, 06. 10⁻ 5 mol H 2 CO moleculen 3. 1, 76. 105 g (176 kg) 4. 8, 72. 104 mol HCl moleculen (872 kmol)

1. Bereken de massa van 5, 13 mmol KMn. O 4 Tabel 98: de molaire massa van KMn. O 4 = 158, 03 g mol⁻ 1 Dus 1 mol KMn. O 4 = 158, 03 g 5, 13 mmol KMn. O 4 = 5, 13. 10⁻ 3 mol KMn. O 4 is dan: 5, 13. 10⁻ 3 mol 1 massa 158, 03 g xg 5, 13. 10⁻ 3 x 158, 03 = 0, 811 g (= 811 mg) x= 1 iets handiger is het zó te doen:

1. Bereken de massa van 5, 13 mmol KMn. O 4 Tabel 98: de molaire massa van KMn. O 4 = 158, 03 g mol⁻ 1 Dus 1 mol KMn. O 4 = 158, 03 g Maar ook: 1 mmol KMn. O 4 = 158, 03 mg 5, 13 mmol KMn. O 4 is dan: mmol 1 massa 158, 03 mg x= 5, 13 x 158, 03 1 5, 13 x mg = 811 mg

2. Hoeveel moleculen zitten in 0, 918 mg H 2 CO ? Tabel 99: de molaire massa van H 2 CO = 2 x 1, 008 + 12, 01 + 16, 00 = 30, 026 g mol⁻ 1 Dus 1 mol H 2 CO = 30, 026 g 0, 918 mg H 2 CO = 9, 18. 10⁻ 4 g mol massa 1 30, 026 g 1 x 9, 18. 10⁻ 4 x= 30, 026 x 9, 18. 10⁻ 4 g = 3, 06. 10⁻ 5 mol H 2 CO moleculen

3. Bereken de massa van 2, 80 kmol HNO 3 Tabel 98: de molaire massa van HNO 3 = 63, 013 g mol⁻ 1 Dus 1 mol HNO 3 = 63, 013 g 2, 80 kmol HNO 3 = 2, 80. 103 mol HNO 3 is dan: 2, 80. 103 mol 1 massa 63, 013 g xg 2, 80. 103 x 63, 013 = 1, 76. 105 g (= 176 kg) x= 1 iets handiger is het zó te doen:

3. Bereken de massa van 2, 80 kmol HNO 3 Tabel 98: de molaire massa van HNO 3 = 63, 013 g mol⁻ 1 Dus 1 mol HNO 3 = 63, 013 g Maar ook: 1 kmol HNO 3 = 60, 013 kg 2, 80 kmol HNO 3 is dan: kmol 1 massa 63, 013 kg x= 2, 80 x kg 2, 80 x 63, 013 = 176 kg 1

4. Hoeveel moleculen zitten in 3, 18. 103 kg HCl? Tabel 99: de molaire massa van HCl = 36, 461 g mol⁻ 1 Dus 1 mol HCl = 36, 461 g 3, 18. 103 kg H 2 CO = 3, 18. 106 g mol massa 1 36, 461 g 1 x 3, 18. 106 x= 36, 461 x 3, 18. 106 g = 8, 72. 104 mol HCl moleculen

Nog een keer zelf 5. Bereken de massa (in g) van 2, 31. 1024 moleculen CO 2 6. Bereken hoeveel moleculen er in 3, 02 g water zitten Antwoorden: 5. 169 g 6. 1, 01. 1023 moleculen H 2 O

5. Bereken de massa (in g) van 2, 31. 1024 moleculen CO 2 1 mol CO 2 bevat 6, 02. 1023 moleculen CO 2 Hoeveel mol CO 2 is dan 2, 31. 1024 moleculen CO 2? mol 1 x aantal 6, 02. 1023 2, 31. 1024 24 2, 31. 10 x= = 3, 837 mol CO 2 moleculen 23 1 x 6, 02. 10 Binas, tabel 98: de molaire massa van CO 2 = 44, 010 g mol⁻ 1 3, 837 mol CO 2 moleculen hebben massa: 3, 837 x 44, 01 = 169 g

6. Bereken hoeveel moleculen er in 3, 02 g water zitten Binas, tabel 98: de molaire massa van H 2 O = 18, 015 g mol⁻ 1 Hoeveel mol H 2 O moleculen zitten in 3, 02 g H 2 O? mol 1 x massa 18, 015 g 3, 02 g 1 x 3, 02 x= = 0, 1676 mol H 2 O moleculen 18, 015 1 mol H 2 O is 6, 02. 1023 moleculen H 2 O 0, 1676 mol H 2 O bevat dan: 0, 1676 x 6, 02. 1023 = 1, 01. 1023 moleculen H 2 O
 Wat is een paragraaf
Wat is een paragraaf Nectarkliertjes
Nectarkliertjes Hoofdstuk in een opera
Hoofdstuk in een opera Significantie natuurkunde
Significantie natuurkunde Zorgbehoefte vaststellen
Zorgbehoefte vaststellen Paragraaf symbool
Paragraaf symbool Aardrijkskunde hoofdstuk 2 havo 4
Aardrijkskunde hoofdstuk 2 havo 4 Samenvatting bespiegeling hoofdstuk 9 massacultuur
Samenvatting bespiegeling hoofdstuk 9 massacultuur Exploitatiebegroting betekenis
Exploitatiebegroting betekenis Wiskunde a havo 4 hoofdstuk 3
Wiskunde a havo 4 hoofdstuk 3 Watt grootheid
Watt grootheid Noughts and crosses chapter 6 summary
Noughts and crosses chapter 6 summary Begeleidingsstijlen leerling
Begeleidingsstijlen leerling De belofte van pisa samenvatting
De belofte van pisa samenvatting Wiskunde havo 4 handig tellen
Wiskunde havo 4 handig tellen Wat is de functie van de spierschede?
Wat is de functie van de spierschede? Tongbreker
Tongbreker Een eigen huis een plek onder de zon
Een eigen huis een plek onder de zon Kop van de stamper in bloemkelk
Kop van de stamper in bloemkelk Bedrijvende vorm voorbeeld
Bedrijvende vorm voorbeeld Ruimtefiguren prisma
Ruimtefiguren prisma Ei schouwen
Ei schouwen Draaiboek maken
Draaiboek maken Balans is een momentopname
Balans is een momentopname Een leven zonder dromen is als een tuin zonder bloemen
Een leven zonder dromen is als een tuin zonder bloemen Bladwijzer in atlas
Bladwijzer in atlas Schaaldeel liniaal
Schaaldeel liniaal Hoe herken je de inleiding van een tekst
Hoe herken je de inleiding van een tekst Wrijvingskrachten
Wrijvingskrachten Smeltdrade
Smeltdrade Veerconstante eenheid
Veerconstante eenheid Manometer absolute druk
Manometer absolute druk