Hoofdstuk 11 Paragraaf 3 Redoxkoppels Een Mgatoom heeft















- Slides: 21

Hoofdstuk 11 Paragraaf 3 Redoxkoppels

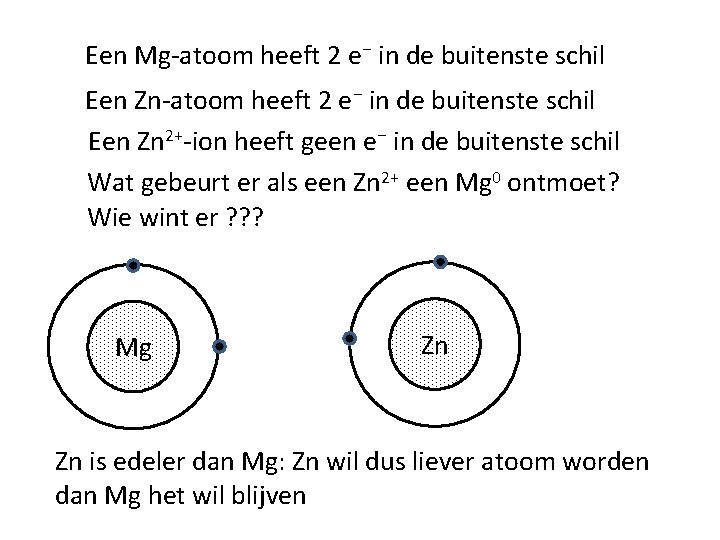
Een Mg-atoom heeft 2 e⁻ in de buitenste schil Een Zn 2+-ion heeft geen e⁻ in de buitenste schil Wat gebeurt er als een Zn 2+ een Mg 0 ontmoet? Wie wint er ? ? ? Mg Zn Zn is edeler dan Mg: Zn wil dus liever atoom worden dan Mg het wil blijven

Een Mg-atoom heeft 2 e⁻ in de buitenste schil Een Zn 2+-ion heeft geen e⁻ in de buitenste schil Wat gebeurt er als een Zn 2+ een Mg 0 ontmoet? Wie wint er ? ? ? Mg Zn Zn is edeler dan Mg: Zn wil dus liever atoom worden dan Mg het wil blijven

Alle metalen kunnen. . . positieve ionen vormen Alle metalen zijn dus reductor. . . af Een edel metaal staat zijn elektronen moeilijk. . reductor Een edel metaal is een zwakke Hoe onedeler een metaal, hoe. . . . . gemakkelijker deze elektronen afstaat Hoe onedeler een metaal, des te sterkere. . . reductor het is

Positieve metaalionen zijn. . . oxidator Positieve ionen van edele metalen zullen graag. . . . elektronen opnemen Dit zijn dus sterke. . . . oxidatoren Naar mate het metaal onedeler wordt, des te. . . zwakker de oxidatorsterkte van het positieve ion is.

Bekijk de halfreactie van zilver: + + e⁻ Ag Ag. . . Ag en Ag+ noem je een redoxkoppel. . . . . Waarbij Ag+ de geconjugeerde oxidator. . . is van Ag of Ag de geconjugeerde. . . reductor van Ag+ is Hoe sterker een oxidator is, des te zwakker. . . de geconjugeerde reductor is of Hoe sterker een reductor is, des te. . . zwakker de geconjugeerde oxidator is

Koper is een veel edeler metaal dan aluminium Je doet een stukje aluminium in een oplossing van Cu 2+ ionen Zal er een reactie optreden? . . metaal. . . Ja , want koper is een edeler De reactievergelijking is dan: 2+ + 2 e⁻. . . Cu Cu. . . . 3+ + 3 e⁻ Al. . . . Al 2 Al(s) + 3 Cu 2+(aq). . . . 3 x 2 x 2 Al 3+ (aq) + 3 Cu (s). . . .

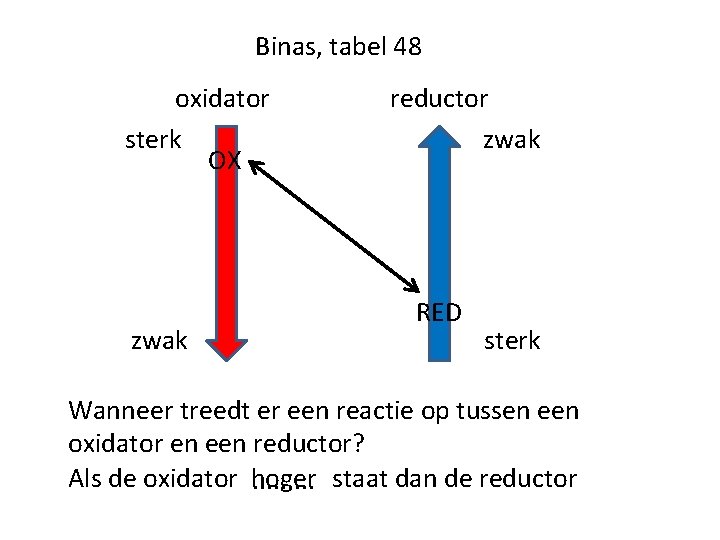
Binas, tabel 48 oxidator sterk OX zwak reductor zwak RED sterk Wanneer treedt er een reactie op tussen een oxidator en een reductor? Als de oxidator hoger. . staat dan de reductor

Binas, tabel 48 In tabel 48 staat naast elk redoxkoppel een standaardelektrodepotentiaal: . . . V 0 Hoe hoger de waarde van V 0, hoe sterker. . . de oxidator Hoe lager de waarde van V 0, hoe sterker. . . de reductor

Binas, tabel 48 Wat kan er gebeuren als je een oxidator en een reductor samenbrengt? Je krijgt: . . . . Een aflopende reactie als ΔV 0 = V 0(ox) – V 0(red) ≥ 0, 3 V Geen reactie als ΔV 0 =. . . . V 0(ox) – V 0(red) ≤ -0, 3 V Een evenwicht als. . . . -0, 3 V < ΔV 0 < 0, 3 V

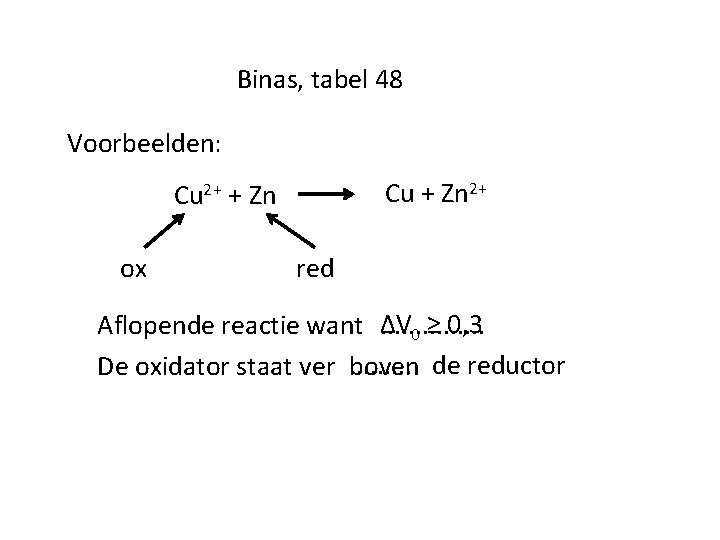
Binas, tabel 48 Voorbeelden: Cu + Zn 2+ Cu 2+ + Zn ox red Aflopende reactie want ΔV. . . . 0 ≥ 0, 3. . . . de reductor De oxidator staat ver boven

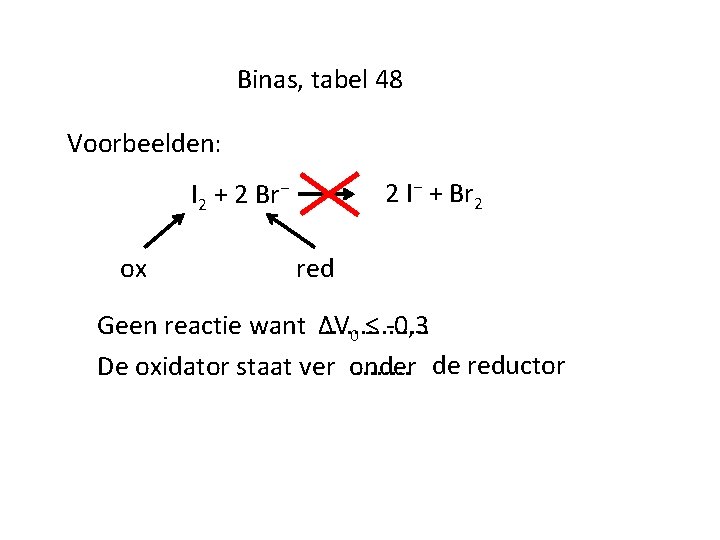
Binas, tabel 48 Voorbeelden: 2 I⁻ + Br 2 I 2 + 2 Br⁻ ox red Geen reactie want ΔV. . . . 0 ≤ -0, 3 De oxidator staat ver onder. . . . de reductor

Binas, tabel 48 Kijk uit: Sommige deeltjes kunnen zowel oxidator. . . als. . . reductor zijn 2+. . . 2+ Bijvoorbeeld: H. . . O. . . Fe Sn 2

Hoe stel je een redoxreactie op? Het stappenplan: 1. Welke deeltjes heb je? 2. Wie is oxidator en wie is reductor? 3. Wie is de sterkste oxidator en wie de sterkste reductor? 4. Verloopt de reactie? 5. Stel de halfreacties en de totaalreactie op

Overzicht belangrijke oxidatoren en reductoren Eenvoudige oxidatoren en reductoren Oxidator Metaalionen + Cu 2+ Zn 2+ Ag. . . . . Reductor Metalen Ag Cu Zn. . . . Niet-metalen. . . . Cl 2 I 2 S O 2 Niet-metaalionen Cl⁻. . . I⁻ S 2⁻ . . . H+ . . H 2

Overzicht belangrijke oxidatoren en reductoren Bijzondere oxidatoren en reductoren Oxidator Permanganaationen Ozon Waterstofperoxide Dichromaationen Salpeterzuur Mn. O 4⁻ O 3 H 2 O 2 Cr 2 O 72⁻ H+ + NO 3⁻

Overzicht belangrijke oxidatoren en reductoren Bijzondere oxidatoren en reductoren Reductor Zwaveldioxide SO 2 Sulfietionen SO 32⁻ Thiosulfaationen S 2 O 3 2 ⁻ Oxaalzuur H 2 C 2 O 4

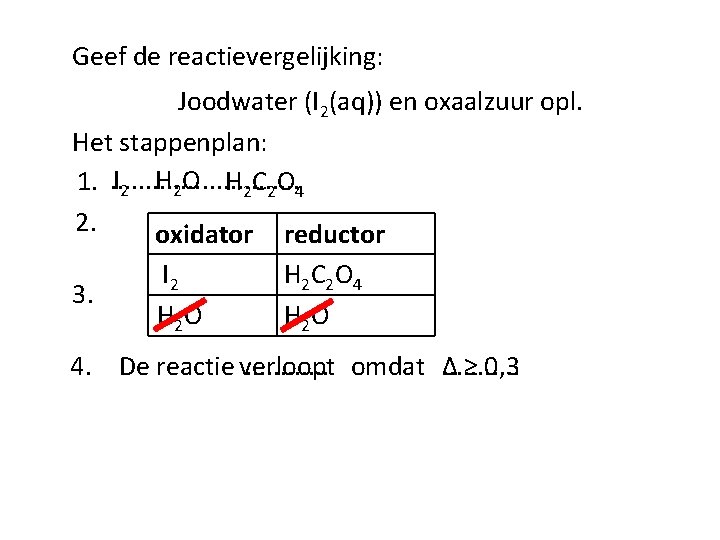
Geef de reactievergelijking: Joodwater (I 2(aq)) en oxaalzuur opl. Het stappenplan: I 2 H 2 O H 2 C 2 O 4 1. . . . 2. oxidator reductor 3. I 2 H 2 O H 2 C 2 O 4 H 2 O 4. De reactie verloopt. . . omdat Δ. . . ≥ 0, 3

Geef de reactievergelijking: Joodwater (I 2(aq)) en oxaalzuur opl. Het stappenplan: 5. I 2 + 2 e⁻. . . . H 2 C 2 O 4. . . I 2 (aq) + H 2 C 2 O 4 (aq) 2 I⁻. . . . 2 CO 2 + 2 H+ + 2 e⁻. . . . . 2 CO 2 (g) + 2 H+ (aq)+ 2 I ⁻ (aq)

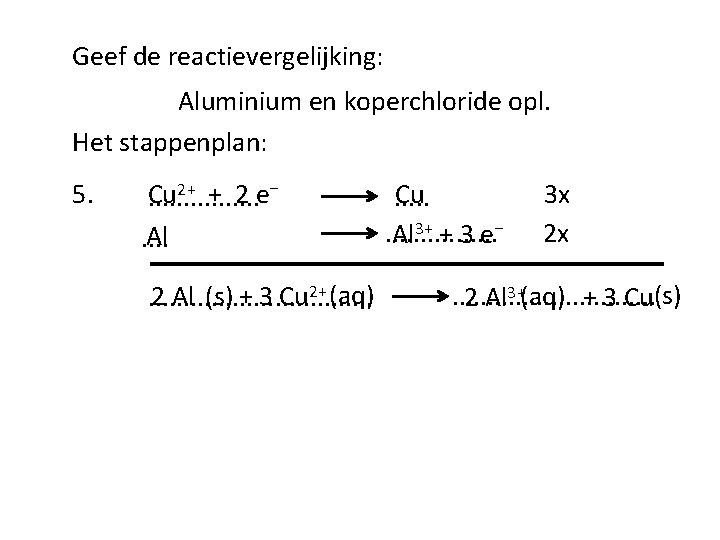
Geef de reactievergelijking: Aluminium en koperchloride opl. Het stappenplan: . . . . H 2 O Cu 2+ Cl⁻ 1. Al 2. 3. oxidator Cu 2+ H 2 O reductor Al H 2 O Cl⁻ 4. De reactie verloopt. . . omdat. . . Δ ≥ 0, 3

Geef de reactievergelijking: Aluminium en koperchloride opl. Het stappenplan: 5. 2+ + 2 e⁻ Cu. . . . Al. . 2 Al (s) + 3 Cu 2+ (aq). . . . Cu. . . . . Al 3+ + 3 e⁻ 3 x 2 x . . . . 2 Al 3+(aq) + 3 Cu(s)
 Niets dan lof
Niets dan lof Hoeveel ribben heeft een rechthoek
Hoeveel ribben heeft een rechthoek Wat is een paragraaf
Wat is een paragraaf Lengtedoorsnede van een stamper
Lengtedoorsnede van een stamper Hoofdstuk in een opera
Hoofdstuk in een opera Hoeveel bloedverlies shock
Hoeveel bloedverlies shock Worteltrekken uitleg
Worteltrekken uitleg Seismisch gat chili
Seismisch gat chili Hoeveel stenen heeft een sjoelbak
Hoeveel stenen heeft een sjoelbak Sjaak en de bonenstaak
Sjaak en de bonenstaak Hoeveel vakjes heeft een schaakbord
Hoeveel vakjes heeft een schaakbord Maandnummer september
Maandnummer september Juf sanne kerst
Juf sanne kerst De huid heeft een zintuigfunctie
De huid heeft een zintuigfunctie Waarom heeft chili een unieke ligging
Waarom heeft chili een unieke ligging Halfreacties opstellen
Halfreacties opstellen Financiele paragraaf zorgschade
Financiele paragraaf zorgschade Negatieve getallenlijn
Negatieve getallenlijn Noughts and crosses chapter summaries
Noughts and crosses chapter summaries Hoofdstuk 3
Hoofdstuk 3 De belofte van pisa boek samenvatting
De belofte van pisa boek samenvatting Wiskunde havo 4 handig tellen
Wiskunde havo 4 handig tellen








































