Fsica y Qumica gua interactiva para la resolucin












- Slides: 22

Física y Química: guía interactiva para la resolución de ejercicios LA ESTRUCTURA DE LA MATERIA Y LA REACCIÓN QUÍMICA Átomos, moléculas y estructuras gigantes I. E. S. Élaios Departamento de Física y Química

Índice § Átomos, moléculas y estructuras gigantes. © Estructura de las sustancias. § Ejercicio 1 © Ejercicio 11 § Ejercicio 2 © Ejercicio 12 § Ejercicio 3 © Ejercicio 13 § Ejercicio 4 © Ejercicio 14 § Ejercicio 5 © Ejercicio 15 § Ejercicio 6 © Ejercicio 16 § Ejercicio 7 © Ejercicio 17 § Ejercicio 8 © Ejercicio 18 § Ejercicio 9 © Ejercicio 19 § Ejercicio 10

Ayuda La observación de las propiedades de las sustancias permite clasificarlas en dos grandes grupos, uno de los cuales se divide en tres subgrupos: (a) Sustancias moleculares: Forman moléculas, es decir agrupaciones de un número limitado de átomos, que pueden ser iguales si se trata de elementos o diferentes si se trata de compuestos. Sus puntos de fusión y ebullición son relativamente bajos. El hidrógeno, el nitrógeno, el yodo, el amoniaco, el agua, el cloruro de hidrógeno o el butano son ejemplos de este tipo de sustancias. (b) Estructuras gigantes: Forman estructuras gigantes o cristales con un número indefinido de átomos, siempre muy grande. Se clasifican en tres subgrupos: Compuestos iónicos: Están formados por iones, tienen puntos de fusión y ebullición elevados, son duros y frágiles. Muchos de ellos son solubles en agua. No conducen la corriente eléctrica en estado sólido, pero si fundidos o disueltos en agua. El cloruro de sodio, el sulfato de calcio, el óxido de bario o el nitrato de potasio son ejemplos de este tipo. Metales: Son buenos conductores del calor y de la electricidad, son dúctiles y maleables. Son metales el cobre, la plata, el hierro, el níquel, el mercurio, el sodio, entre otros. Estructuras gigantes covalentes: Tienen puntos de fusión y ebullición elevados, son duros y frágiles, insolubles en agua y no conducen la corriente eléctrica salvo en el caso del grafito. De este tipo son el diamante, el grafito y el dióxido de silicio.

EJERCICIO 1 El dióxido de carbono es una sustancia molecular de fórmula CO 2, mientras que el dióxido de silicio es una estructura gigante de fórmula Si. O 2. ¿Cuál es el significado de la anterior afirmación? Una sustancia molecular está formada por moléculas. La molécula de CO 2 está formada por la unión de dos átomos de oxígeno a un átomo de carbono. Por el contrario la fórmula Si. O 2 referida a una estructura gigante significa que un gran número de átomos de Si y O, en la proporción 1 átomo de silicio por 2 átomos de oxígeno forman una estructura en tres dimensiones. La fórmula representa la unidad fórmula. Esta diferencia se observa en las propiedades físicas de las sustancias, que en este caso son: el dióxido de carbono es un gas, el de las bebidas carbónicas, mientras que el dióxido de silicio es un sólido de punto de fusión muy elevado, que es el principal componente de la arena de la playa.

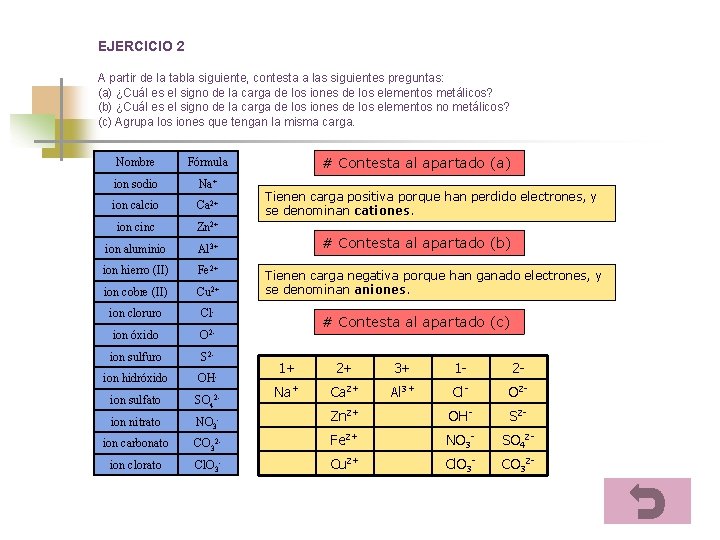
EJERCICIO 2 A partir de la tabla siguiente, contesta a las siguientes preguntas: (a) ¿Cuál es el signo de la carga de los iones de los elementos metálicos? (b) ¿Cuál es el signo de la carga de los iones de los elementos no metálicos? (c) Agrupa los iones que tengan la misma carga. Nombre Fórmula ion sodio Na+ ion calcio Ca 2+ ion cinc Zn 2+ ion aluminio Al 3+ ion hierro (II) Fe 2+ ion cobre (II) Cu 2+ ion cloruro Cl- ion óxido O 2 - ion sulfuro S 2 - ion hidróxido OH- ion sulfato SO 42 - ion nitrato NO 3 - ion carbonato ion clorato # Contesta al apartado (a) Tienen carga positiva porque han perdido electrones, y se denominan cationes. # Contesta al apartado (b) Tienen carga negativa porque han ganado electrones, y se denominan aniones. # Contesta al apartado (c) 1+ 2+ 3+ 1 - 2 - Na+ Ca 2+ Al 3+ Cl- O 2 - Zn 2+ OH- S 2 - CO 32 - Fe 2+ NO 3 - SO 42 - Cl. O 3 - Cu 2+ Cl. O 3 - CO 32 -

EJERCICIO 3 Explica el significado de las siguientes fórmulas iónicas: (a) NH 4+ (b) PO 43 - # Contesta al apartado (a) Cuatro átomos de hidrógeno están unidos a un átomo de nitrógeno y el conjunto ha perdido un electrón. El resultado es el ion amonio. # Contesta al apartado (b) Es la unión, mediante enlaces químicos, de un átomo de fósforo y cuatro átomos de oxígeno que, en conjunto, han ganado tres electrones. El ion resultante se denomina fosfato.

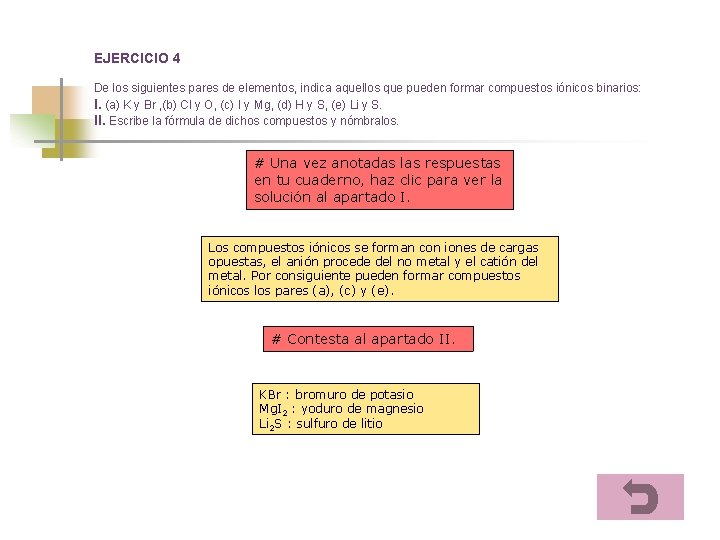
EJERCICIO 4 De los siguientes pares de elementos, indica aquellos que pueden formar compuestos iónicos binarios: I. (a) K y Br , (b) Cl y O, (c) I y Mg, (d) H y S, (e) Li y S. II. Escribe la fórmula de dichos compuestos y nómbralos. # Una vez anotadas las respuestas en tu cuaderno, haz clic para ver la solución al apartado I. Los compuestos iónicos se forman con iones de cargas opuestas, el anión procede del no metal y el catión del metal. Por consiguiente pueden formar compuestos iónicos los pares (a), (c) y (e). # Contesta al apartado II. KBr : bromuro de potasio Mg. I 2 : yoduro de magnesio Li 2 S : sulfuro de litio

EJERCICIO 5 Indica los iones que forman la estructura gigante iónica de los siguientes compuestos: (a) KCl, (b) Na. OH, (c) Mg(OH)2, (d) Ba. O, (e) NH 4 Cl, (f) Na. NO 3, (g) K 2 SO 4 En los compuestos iónicos, los cationes son los iones metálicos, y el resto de la unidad fórmula indica los aniones. El ion amonio (NH 4+) lo conoces de un ejercicio anterior y se comporta como un ion metálico. Por tanto: (a) K+ y Cl(b) Na+ y OH(c) Mg 2+ y OH(d) Ba 2+ y O 2(e) NH 4+ y Cl(f) Na+ y NO 3(g) K+ y SO 42 -

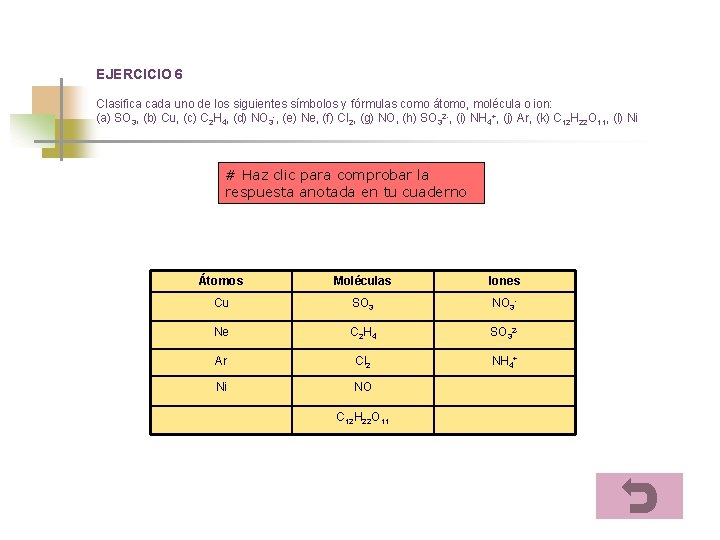
EJERCICIO 6 Clasifica cada uno de los siguientes símbolos y fórmulas como átomo, molécula o ion: (a) SO 3, (b) Cu, (c) C 2 H 4, (d) NO 3 -, (e) Ne, (f) Cl 2, (g) NO, (h) SO 32 -, (i) NH 4+, (j) Ar, (k) C 12 H 22 O 11, (l) Ni # Haz clic para comprobar la respuesta anotada en tu cuaderno Átomos Moléculas Iones Cu SO 3 NO 3 - Ne C 2 H 4 SO 32 - Ar Cl 2 NH 4+ Ni NO C 12 H 22 O 11

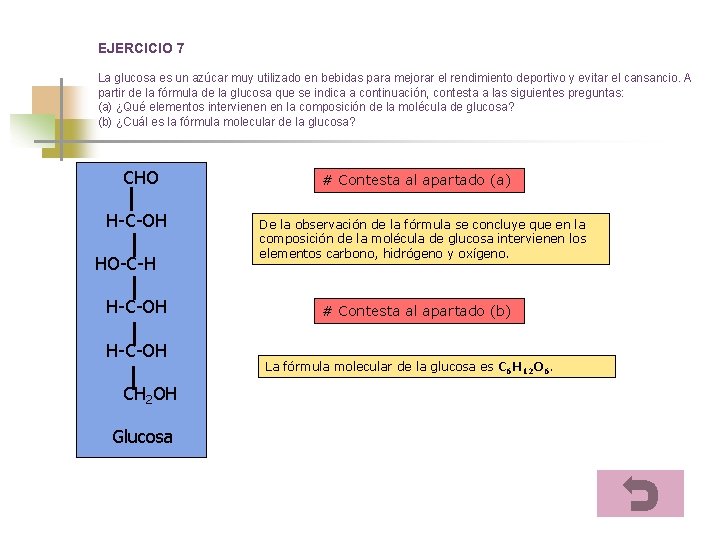
EJERCICIO 7 La glucosa es un azúcar muy utilizado en bebidas para mejorar el rendimiento deportivo y evitar el cansancio. A partir de la fórmula de la glucosa que se indica a continuación, contesta a las siguientes preguntas: (a) ¿Qué elementos intervienen en la composición de la molécula de glucosa? (b) ¿Cuál es la fórmula molecular de la glucosa? CHO H-C-OH HO-C-H H-C-OH CH 2 OH Glucosa # Contesta al apartado (a) De la observación de la fórmula se concluye que en la composición de la molécula de glucosa intervienen los elementos carbono, hidrógeno y oxígeno. # Contesta al apartado (b) La fórmula molecular de la glucosa es C 6 H 12 O 6.

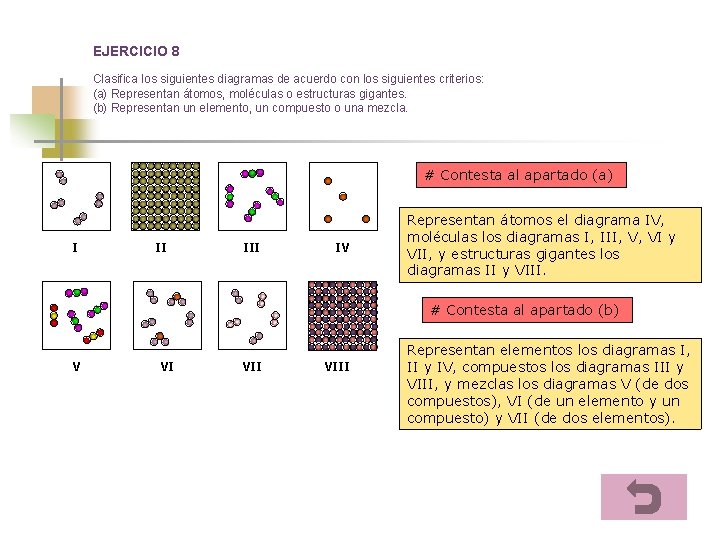
EJERCICIO 8 Clasifica los siguientes diagramas de acuerdo con los siguientes criterios: (a) Representan átomos, moléculas o estructuras gigantes. (b) Representan un elemento, un compuesto o una mezcla. # Contesta al apartado (a) I II IV Representan átomos el diagrama IV, moléculas los diagramas I, III, V, VI y VII, y estructuras gigantes los diagramas II y VIII. # Contesta al apartado (b) V VI VIII Representan elementos los diagramas I, II y IV, compuestos los diagramas III y VIII, y mezclas los diagramas V (de dos compuestos), VI (de un elemento y un compuesto) y VII (de dos elementos).

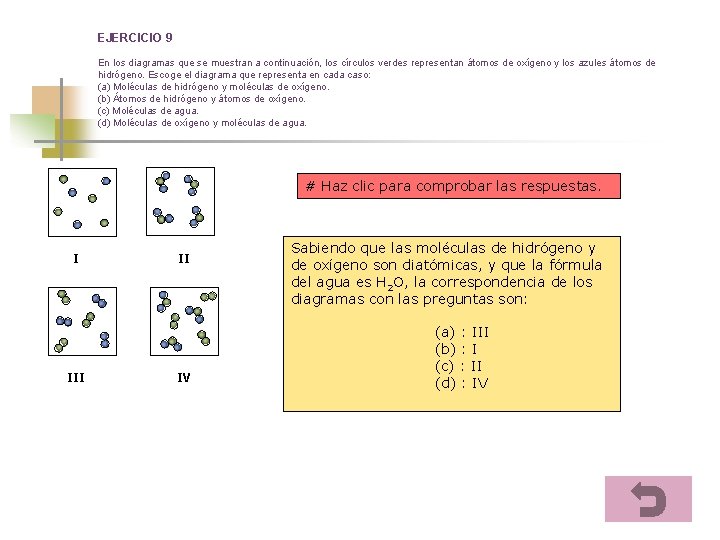
EJERCICIO 9 En los diagramas que se muestran a continuación, los círculos verdes representan átomos de oxígeno y los azules átomos de hidrógeno. Escoge el diagrama que representa en cada caso: (a) Moléculas de hidrógeno y moléculas de oxígeno. (b) Átomos de hidrógeno y átomos de oxígeno. (c) Moléculas de agua. (d) Moléculas de oxígeno y moléculas de agua. # Haz clic para comprobar las respuestas. I II IV Sabiendo que las moléculas de hidrógeno y de oxígeno son diatómicas, y que la fórmula del agua es H 2 O, la correspondencia de los diagramas con las preguntas son: (a) : III (b) : I (c) : II (d) : IV

EJERCICIO 10 Indica cuáles son los iones de los siguientes compuestos iónicos y nombra dichos compuestos (a) KI, (b) Mg(OH)2, (c) Ba. Br 2, (d) Pb. S 2, (e) Ca. Cl 2, (f) Na. OH, (g) Li 2 O # Haz clic para comprobar las respuestas. Dado que se trata de compuestos binarios metal no metal, salvo dos hidróxidos, uno de los iones es el catión metálico y el otro el anión no metálico. Por tanto: (a) (b) (c) (d) (e) (f) (g) K+ y I Mg 2+ y OHBa 2+ y Br. Pb 4+ y S 2 Ca 2+ y Cl. Na+ y OHLi+ y O 2 - Yoduro de potasio Hidróxido de magnesio Bromuro de bario Sulfuro de plomo (IV) Cloruro de calcio Hidróxido de sodio Óxido de litio

EJERCICIO 11 Explica la diferencia entre las fórmulas indicadas en el apartado (a) y las indicadas en el apartado (b). (a) Fe, I 2, C, Na. Cl, CO, Si. O 2, Ca. O (b) Fe(s), I 2(s), C(s), Na. Cl(s), Si. O 2(s), Ca. O(s) Las fórmulas del apartado (a) indican moléculas diatómicas de yodo y moléculas de monóxido de carbono y unidades fórmula de la estructura metálica del hierro, de las estructuras gigantes covalentes del carbono y del dióxido de silicio y de las estructuras gigantes iónicas del cloruro de sodio y del óxido de calcio. Las fórmulas del apartado (b) son las del apartado (a) incluyendo el estado físico de las sustancias, lo que se hace para referirse macroscópicamente a dichas sustancias, a diferencia de las fórmulas del apartado (a) que tienen un significado microscópico.

EJERCICIO 12 (a) ¿Cuál es la estructura más frecuente de los elementos? ¿Por qué? (b) ¿Cuál es la estructura más frecuente de los elementos no metálicos? (c) ¿Conoces algún elemento que no tenga ninguna de las dos estructuras anteriores? # Contesta al apartado (a) La estructura más frecuente de los elementos es la estructura gigante metálica, puesto que metales son la mayor parte de los elementos químicos. # Contesta al apartado (b) La estructura más frecuente de los elementos no metálicos es la molecular. # Contesta al apartado (c) El carbono, en sus dos variedades diamante y grafito, tiene una estructura gigante covalente. También la tiene el silicio y algún otro elemento de su mismo grupo de la tabla periódica.

EJERCICIO 13 Los compuestos binarios pueden estar formados por dos elementos no metálicos o por un elemento no metálico y otro metálico. (a) ¿Qué estructuras pueden tener cada uno de los tipos de compuestos binarios? (b) Pon cuatro ejemplos de cada uno de los tipos. # Contesta al apartado (a) Los compuestos binarios entre no metales son moleculares, salvo algunas excepciones significativas que forman estructuras gigantes covalentes. Los compuestos binarios metal – no metal forman estructuras gigantes iónicas. # Contesta al apartado (b) Ejemplos de compuestos binarios moleculares son: H 2 O(l), HCl(g), CO 2(g) y NH 3(g). Ejemplos de estructura gigante covalente son: Si. O 2(s) y Si. C(s). Son compuestos iónicos: KCl(s), Ba. O(s), Na 2 S(s) y Li. Br(s)

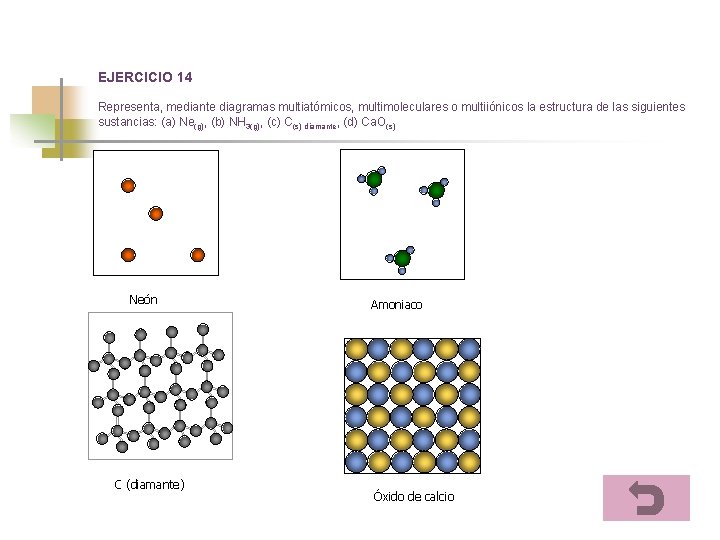
EJERCICIO 14 Representa, mediante diagramas multiatómicos, multimoleculares o multiiónicos la estructura de las siguientes sustancias: (a) Ne(g), (b) NH 3(g), (c) C(s) diamante, (d) Ca. O(s) Neón C (diamante) Amoniaco Óxido de calcio

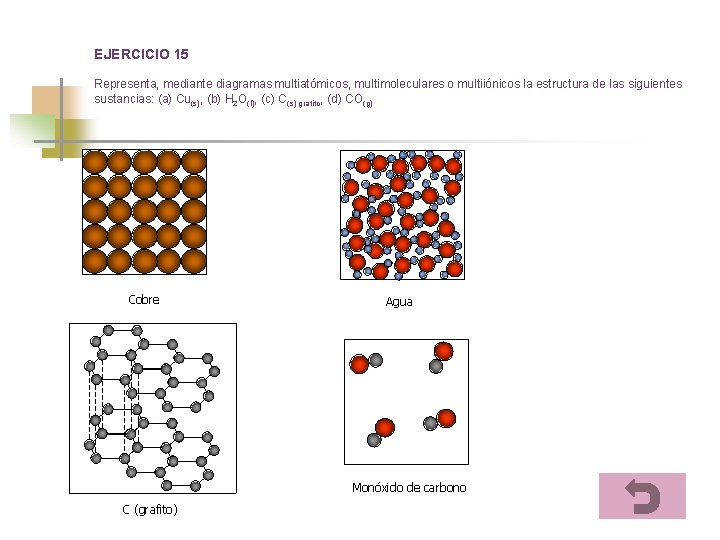
EJERCICIO 15 Representa, mediante diagramas multiatómicos, multimoleculares o multiiónicos la estructura de las siguientes sustancias: (a) Cu(s), (b) H 2 O(l), (c) C(s) grafito, (d) CO(g) Cobre Agua Monóxido de carbono C (grafito)

EJERCICIO 16 Representa, mediante diagramas multiatómicos, multimoleculares o multiiónicos la estructura de las siguientes sustancias: (a) Br 2(l), (b) Na(s), (c) HCl(g), (d) KBr(s) Bromo Cloruro de hidrógeno Sodio Bromuro de potasio

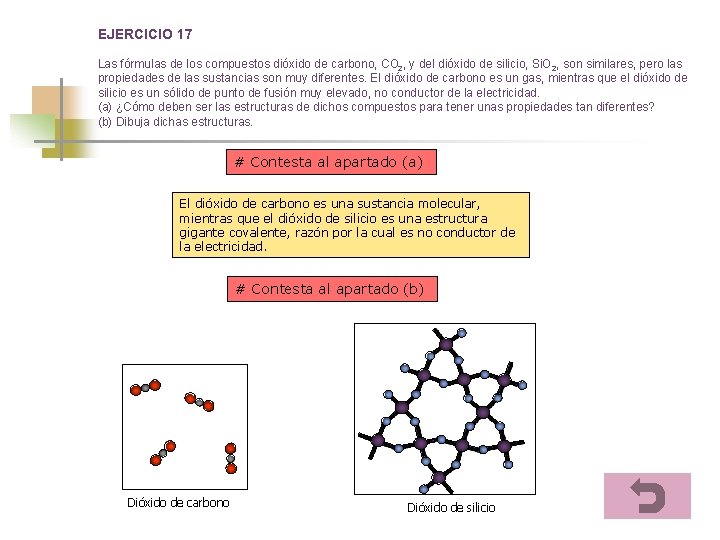
EJERCICIO 17 Las fórmulas de los compuestos dióxido de carbono, CO 2, y del dióxido de silicio, Si. O 2, son similares, pero las propiedades de las sustancias son muy diferentes. El dióxido de carbono es un gas, mientras que el dióxido de silicio es un sólido de punto de fusión muy elevado, no conductor de la electricidad. (a) ¿Cómo deben ser las estructuras de dichos compuestos para tener unas propiedades tan diferentes? (b) Dibuja dichas estructuras. # Contesta al apartado (a) El dióxido de carbono es una sustancia molecular, mientras que el dióxido de silicio es una estructura gigante covalente, razón por la cual es no conductor de la electricidad. # Contesta al apartado (b) Dióxido de carbono Dióxido de silicio

EJERCICIO 18 Los sólidos iónicos no conducen la electricidad en estado sólido, pero sí la conducen al fundirlos o al disolverlos en agua. Justifica este comportamiento Las estructuras gigantes iónicas están formadas por iones en puntos fijos de la misma. Como un conductor de la electricidad debe tener cargas que se puedan mover, los sólidos iónicos no conducen la corriente eléctrica. Al fundir un sólido iónico los iones tienen la movilidad propia de las partículas del estado líquido, por lo que conducen la electricidad. Lo mismo sucede al disolver un sólido iónico en agua, ya que el cristal se desmorona y los iones pueden moverse con facilidad a través del disolvente.

EJERCICIO 19 El punto de fusión del cloruro de potasio, KCl, es 770ºC, mientras que el punto de fusión del óxido de magnesio, Mg. O, es 2. 852ºC. Teniendo en cuenta que en los sólidos iónicos la unión entre átomos se debe a la fuerza electrostática entre los iones, intenta dar una explicación a los valores anteriores de los puntos de fusión. En la estructura del cloruro de potasio los iones son K+ y Cl-, mientras que en el óxido de magnesio los iones son Mg 2+ y O 2 -. La fuerza electrostática entre cargas viene dada por la ley de Coulomb, siendo directamente proporcional al producto de las cargas. Como los iones del óxido de magnesio tienen doble carga que los iones del cloruro de potasio, la atracción electrostática es mayor, y en consecuencia también lo es el punto de fusión.
 Agua gua gua
Agua gua gua Resolucin de problemas
Resolucin de problemas Problemas aditivos y multiplicativos
Problemas aditivos y multiplicativos Problema
Problema Ejemplos de programación de computadoras
Ejemplos de programación de computadoras Resolucin
Resolucin Resolucin
Resolucin Resolucin
Resolucin Resolucin
Resolucin Resolucin
Resolucin Perspectiva interactiva
Perspectiva interactiva Tehnica diamantul
Tehnica diamantul Etapas de la lectura interactiva
Etapas de la lectura interactiva Teoría de la comunicación digital interactiva
Teoría de la comunicación digital interactiva Metode interactive de grup
Metode interactive de grup Afa cartas de porte
Afa cartas de porte Cuerpos geometricos senati
Cuerpos geometricos senati Zona interactiva dreamweaver
Zona interactiva dreamweaver Fsica
Fsica Division de la fisica clasica
Division de la fisica clasica Fsica
Fsica Produto escalar
Produto escalar Trabajo neto ciclo de carnot
Trabajo neto ciclo de carnot